蒲公英内生真菌PG23抗癌活性的初步研究
孙新城,李 丹,罗 宇,张慧茹,3*
(1.郑州轻工业学院食品与生物工程学院,河南 郑州 450002;2.河南工业大学,河南 郑州 450001;3.郑州大学,河南 郑州 450001)
药用植物内生真菌(endophytic fungus)是一类自然界中存在的、能产生多种生物活性物质的新型微生物药物资源[1-2]。人们发现植物内生真菌与宿主长期共生,也能产生出植物抗癌物质,如黄酮类、萜类、生物碱类、多糖、肽类等[2],因此,研究内生真菌的次级代谢产物,从中寻找新型的抗癌、抗病毒、抗氧化的微生物药物,具有诱人的应用前景。
蒲公英是一味清热解毒类中草药,具有抗菌[3]、抑癌和抗突变[4]、抗氧化[5]等多种药理作用,并能提高免疫功能低下小鼠的免疫力[6]。张慧茹等[7]从蒲公英中分离出3株具有抗菌特性的蒲公英内生真菌,并对其抑菌活性物质进行分析,初步判定为多糖类物质[8],研究发现,蒲公英内生真菌PG23具有抗菌、消除耐药质粒的生物活性,并且无急性和致死性毒性,其发酵液主要含有糖类、酚类、有机酸类等生物活性物质[9]。为检验蒲公英内生真菌PG23多糖类物质的抗癌作用,本研究通过PG23发酵液对A549细胞的抑制作用,探讨其抗癌作用,为其应用提供基础资料。
1 材料与方法
1.1 材料
蒲公英内生真菌PG23,河南工业大学生物工程学院动物生理实验室分离并保存;A549细胞株,购自美国 ATCC细胞库;RPMI-1640、胎牛血清(FBS),购自美国Gibco公司;四甲基偶氮唑盐(MTT)、二甲基亚砜(DMSO)、胰酶,均购自美国Sigma公司;环磷酰胺(CTX),江苏恒瑞医药公司生产;葡萄糖,天津市科密欧化学试剂有限公司生产;0.1g/mL的蒲公英浸汁,自制;豆油、玉米粉、马铃薯,均为市售。
1.2 方法
1.2.1 PG23发酵液的制备及粗多糖的提取 将保存的PG23菌种接马铃薯固体培养基平板活化;以马铃薯浸出液为基础培养液,制备种子液;在基础培养基中添加2.6%葡萄糖、0.53%豆油、0.10%玉米粉、7.06%蒲公英浸汁(0.1g/mL)作为发酵液体培养基,接种10%的种子液,26℃、160r/min发酵7 d。发酵液8000r/min离心20min,取上清液1000 mL,950mL/L乙醇沉淀得沉淀物,挥干,称重计算粗多糖得率,粗多糖得率(%)=粗多糖克数/1000×100%。将所得粗多糖溶于500mL无菌水中作为储备液,4℃贮藏备用。
1.2.2 PG23粗多糖含量的测定 精密称取已干燥至恒重的葡萄糖0.1g,配制成100μg/mL葡萄糖溶液,准确量取0、0.2、0.4、0.6、0.8、1.0mL葡萄糖溶液加蒸馏水至1.0mL,各管加5g/L的苯酚溶液1.0mL摇匀,再加入5.0mL浓硫酸,沸水浴15 min后冷却,酶标仪测490nm处吸光度值(OD值),以葡萄糖浓度为横坐标、OD值为纵坐标绘制葡萄糖标准曲线。准确量取1.0mL发酵储备液,稀释至200倍,取稀释液1.0mL,按上述方法操作,于490nm处测吸光值,对应标准曲线,计算稀释液中多糖含量,并计算储备液中多糖含量,多糖含量(%)=测量得出的稀释液中多糖含量/沉淀溶解在储备液中的含量×100%。
1.2.3 细胞培养 将A549细胞以5×105个/mL浓度接种于直径为9cm培养皿中,加入含200 mL/L FBS的 RPMI-1640培养基,置于37℃、5%CO2、饱和湿度的培养箱中培养,隔日更换培养液,待细胞生长近80%融合时,用胰酶消化传代、扩增,取对数生长期细胞用于试验。
1.2.4 MTT法检测PG23多糖对肺癌细胞A549细胞的增殖抑制率及IC50取对数生长期的A549细胞,调整细胞浓度为2.0×104个/mL接种于96孔培养板中,每孔200μL,培养24h后,弃去培养液。以RPMI-1640培养液为稀释液,将多糖稀释液进行倍比稀释,获得1组~8组分别为原液、稀释2-1、稀释2-2、稀释2-3、稀释2-6、稀释2-9、稀释2-10、稀释2-11共8组含不同粗多糖浓度的培养液,每孔加培养液200μL,以不加药的细胞培养作为阴性对照,以100μg/mL环磷酰胺(CTX)作为阳性对照,以不加药的培养基作为空白对照,每个药物浓度设8个平行,分别培养24、48、72h后,吸去上清,加入5mg/mL的MTT每孔20μL,继续培养4h,弃去培养液,每孔加入DMSO 200μL,振荡10min,用酶标仪测490nm波长下各孔的吸光值(OD值),计算PG23多糖对A549细胞的抑制率。
抑制率(IR)%=(阴性对照组平均OD值-试验组平均OD值)÷(阴性对照组平均OD值)×100%;
根据抑制率,利用PASW Statistics 18软件计算蒲公英PG23多糖抑A549肺癌细胞的IC50。
1.2.5 统计学分析 采用PASW Statistics 18软件进行统计学处理。计量数据以¯X±SD表示,One-Way ANOVA 分析、Duncan's检验,以P<0.05(或P<0.01)表示差异有统计学意义。
2 结果
2.1 PG23发酵液多糖含量的测定
以葡萄糖为标准品,采用苯酚-硫酸法,绘制葡萄糖标准液在490nm处吸光值的标准曲线(图1),求得标准回归方程为A=0.0098C+0.0233,线性相关系数R2=0.9931。
用950mL/L乙醇沉淀PG23发酵上清液,获得27.54g粗多糖,多糖得率为2.754%。
取多糖稀释液在490nm处的吸光值为0.747,多糖稀释液的糖含量为73.85μg/mL,故PG23多糖储备液的多糖为14.77mg/mL,粗多糖的含量为26.82%。

图1 葡萄糖含量的标准曲线Fig.1 The standard curve of glucose content
2.2 PG23发酵液对A549生长的抑制率和IC50
以RPMI-1640为稀释液,将多糖稀释液进行倍比稀释,各培养液中多糖含量见表1。

表1 各组培养液中多糖含量Table1 Polysaccharide contents in different groups mL
以上述培养液为A549肺癌细胞培养液,以100 μg/mL环磷酰胺(CTX)作为抗癌药物的阳性对照,以不加药的培养细胞作为阴性对照,培养24h、48h、72 h,采用MTT法测定吸光度(OD值),计算PG23多糖对A549细胞的抑制率(表2)。
从表2中可以看出,各组A549细胞随着培养时间的延长,细胞数量逐渐增加;PG23多糖对A549细胞的抑制率以第1天最强,CTX也表现同样的抑制A549细胞的趋势;不同的多糖浓度对A549的抑制率有所不同,第1天第5组(0.23mg/mL)、第6组(28.85μg/mL)、第7组(14.42μg/mL)三组培养液对A549的抑制率超过80%,为高度抑制(P<0.01),第8组(7.21μg/mL)的抑制率超过50%,为中度抑制,这四组培养液的抑制率均高于CTX阳性对照,第4组(1.85mg/mL)培养液的抑制率同CTX阳性对照相当,为49%,而第2组(7.38mg/mL)和第1组(14.77mg/mL)培养液不仅抑制率下降明显,第1组培养液还表现促进细胞生长的趋势(图2)。
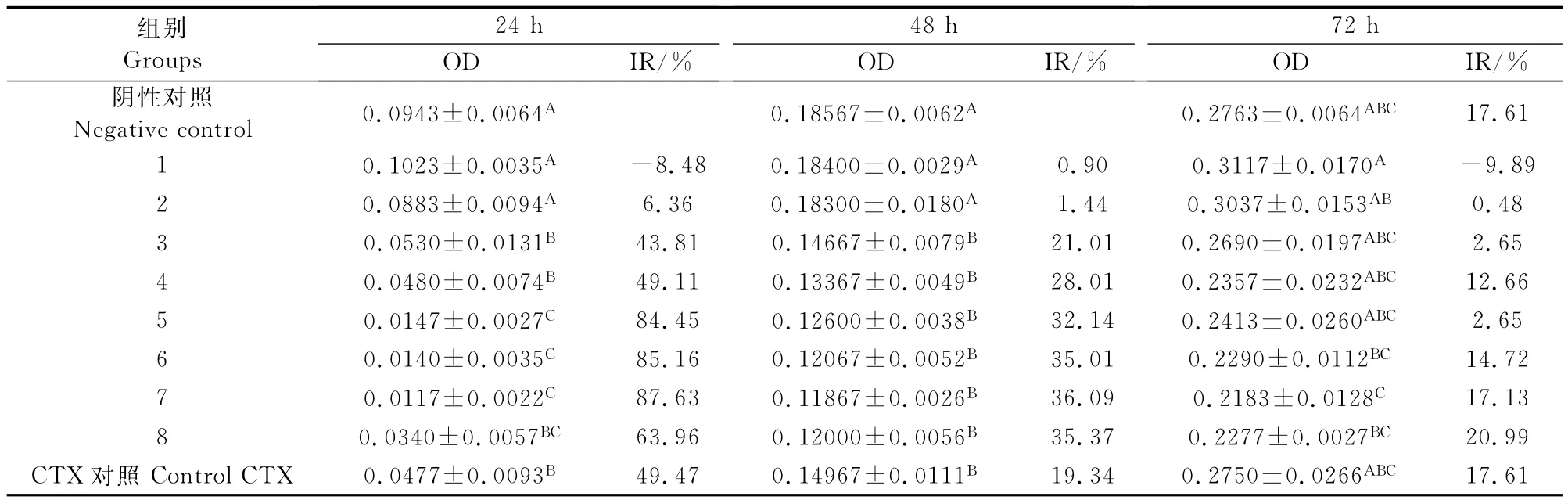
表2 PG23多糖对A549的抑制率Table2 The inhibitory rate in A549cells after treatment with polysaccharide from PG23broth
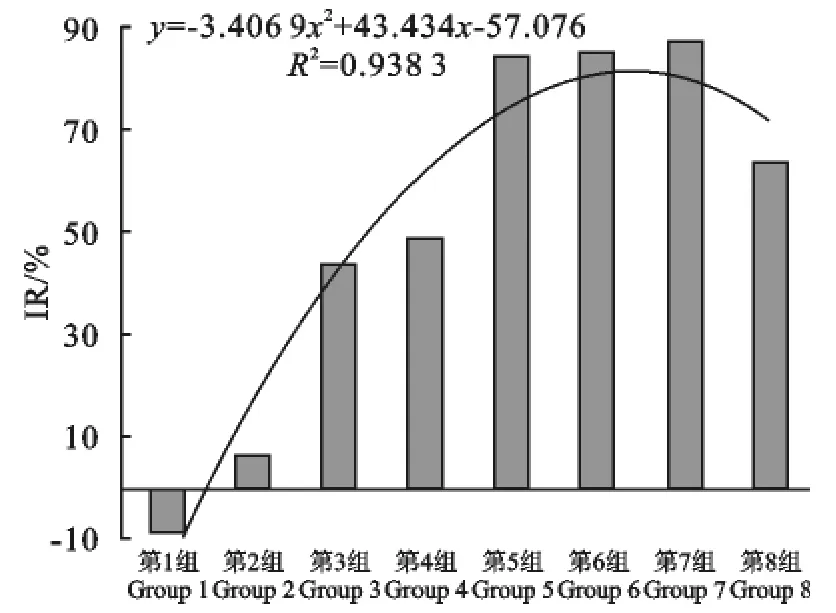
图2 多糖浓度与抑制率的相关性曲线图Fig.2 The relativity curve between polysaccharide concentration and inhibited rate
根据抑制率,用PASW statistics 18计算PG23发酵液多糖对A549抑制率的IC50为1.073mg/mL(24h)。
3 讨论
多糖类物质具有增强免疫、抗肿瘤、抗氧化、降血糖等多种功效,多糖作为药物最初是在食用真菌方面,例如,虫草多糖、灵芝多糖、香菇多糖、猴头多糖和灰树花多糖等等,通过淋巴细胞、巨噬细胞和网状内皮系统调节机体的免疫功能,提高身体抵抗病毒和细菌入侵的能力[10-11],食用菌多糖有着极强的抗氧化特性,能够清除多种自由基对人体的伤害,通过提高机体溶菌酶、SOD、CAT的含量发挥抗氧化、抗衰老功能[12]。
对于药物植物内生真菌产抗癌性多糖类物质的研究国内外并不多见。蒲公英是一类清热解毒类常用抗菌、抗病毒类药物,其药性成分比较复杂,多种成分相互协调发挥多种生物活性作用,对于蒲公英内生真菌的研究,目前仅限于笔者,在研究出PG2的抗菌物质主要为多糖后,后续分离的PG23菌株具有多种生物活性,其发酵液中也含大量的多糖类物质,经测量多糖含量为0.23mg/mL,通过研究发现,蒲公英内生真菌发酵液多糖的抗癌效果并不与多糖浓度成正比,而是具有最佳作用浓度,抑制A549肺癌细胞的最佳多糖浓度为14.42μg/mL,远远高于蒲公英多糖的抑癌效果[4];在作用后24h内,230μg/mL ~14.42 μg/mL的PG23多糖浓度抑制A549肺癌细胞的抑制率(84.45%~63.96%)均高于环磷酰胺的阳性对照(49.47%),通过计算,IC50为1.073mg/mL,远远低于山茱萸多糖对 A549的IC50(37.2mg/mL)[13],证明PG23发酵液具有较好的抑制肺癌A549细胞的效果。PG23对肺癌A549细胞的抑制作用机理,以及PG23多糖的其他生物活性还需要进一步深入研究。
[1]Stierle A,Strobel G,Stierle D.Taxol and taxane production by paxomyces dreanae,an endophytic fungus of pacific yew[J].Science,1993,260(9):214-216.
[2]Strobel G,Daisy B.Bioprospecting for microbial endophytes and their natural products[J].Microbio Mol Bio Rev,2003,67(4):491-102.
[3]Paul N C,Kim W K,Woo S K,et al.Diversity of endophytic fungi associated with taraxacum coreanum and their antifungal activity[J].Mycobiology,2006,34(4):185-190.
[4]杨晓杰,付学鹏.蒲公英多糖体外抑瘤和抗突变作用研究[J].时珍国医国药,2009,20(10):2470-2471.
[5]杨晓杰,郑云姬,李 娜,等.亚洲蒲公英多糖的抑菌性和抗氧化性研究[J].时珍国医国药,2012,23(1):109-110.
[6]宋宝辉,念 红.蒲公英及其多糖提取物对小鼠免疫功能的调节研究[J].中国食物与营养,2011,17(10):68-70.
[7]李伟南,张慧茹.3株蒲公英内生真菌的分离鉴定及抗禽类致病菌活性的初步研究[J].安徽农业科学,2008,36(22):9540-9542.
[8]张慧茹,伊艳杰,赵红月,等.蒲公英内生真菌PG2分子鉴定及抑菌物质的研究[J].饲料工业,2012,33(9):30-33.
[9]张慧茹,袁 元,赵红月,等.产酚类活性物质的蒲公英内生真菌PG23的研究[A].中国粮油学会饲料专业分会2011饲料科技论坛暨学术年会,广东湛江,2011.
[10]Mandal EK,Maity K,Maity S,et al.Structural characte-rization of an immunoenhancing cytotoxic heteroglycan isolated from an edible mushroomCalocybe indicavar.APK2[J].Carbohyd Res,2011,346(14):2234-2240.
[11]fSarangi I,Ghosh D,Bhutia S K,et al.Anti-tumor and immunomodulating effects of Pleurotus ostreatus mycelia-derived proteoglycans[J].Inter Immun,2006,6:1287-1297.
[12]Wang M,Meng X Y,Yang R L,et al.Cordyceps militaris polysaccharides can enhance the immunity and antioxidation activity in immunosuppressed mice[J].Carbohyd Poly,2012,89:461-466.
[13]王恩军,靳 祎,刘 斌,等.山茱萸多糖对肺癌A549细胞凋亡的影响及机制[J].山东医药,2012,52(3):46-47.

