去氢甲睾酮ELISA 试剂盒的研制
姚 萍,董 英,王 云,张 勋
(江苏大学食品与生物工程学院,江苏 镇江 212013)
去氢甲睾酮(1-dehydro-17a-methyltestosterone,DMT)是一种人工合成的蛋白同化类激素,又名大力补、美雄酮,化学名为17β-羟基-17α-甲基雄甾-1,4-二烯-3-酮。在临床上DMT可用于再生障碍性贫血、男性发育迟缓、烧伤处理等疾病的治疗[1-2]。DMT还具有促进动物体内营养物质沉积和改善生产性能的作用,在畜牧业上被用作动物饲料添加剂,以促进动物生长,提高产量[3-4]。但蛋白同化激素作为饲料添加剂应用于畜牧生产时,会在动物体内残留。当人们长期食用含有该药物残留的动物性食品时,会严重危害人类健康,如导致肝功能障碍,生殖功能紊乱,增加患心血管疾病的风险等[5]。因此,研制灵敏、高效、稳定的DMT残留检测方法非常重要。目前,激素的检测方法主要有GC-LC和LCMS[6],具有定量检测、准确可靠的优点,但是其检测成本高、样品预处理繁琐、费时耗力,不适于大量样品的筛检。免疫学检测方法具有灵敏准确,快速简便等特点,特别适合于小分子药物的现场快速检测[7-9],近年来得到了较为广泛的应用。
本研究以江苏大学食品营养与安全实验室自主研发的一株能稳定分泌去氢甲睾酮单克隆抗体的杂交瘤细胞株为基础[10],应用 ELISA 原理[11]研制去氢甲睾酮残留快速检测试剂盒,并且对其各项指标进行了测定,为开发利用该试剂盒提供试验依据和技术基础。
1 材料与方法
1.1 材料
1.1.1 实验动物和杂交瘤细胞株 Balb/c小鼠由扬州大学实验动物中心提供;DMT-BSA完全抗原、稳定分泌去氢甲睾酮单克隆抗体的杂交瘤细胞株1D6F10B4,江苏大学食品营养与安全实验室自制。
1.1.2 主要试剂 去氢甲睾酮、丙酸睾酮酯、群勃龙,Sigma公司;辣根过氧化物酶标记的羊抗鼠IgG(HRP-IgG),Genescript公司;Tween 20,国药集团化学试剂有限公司;透析袋(截留分子质量14ku),上海华美生物工程公司;试验所用其他试剂均为分析纯。
0.06 mol/L、pH 4.8的醋酸缓冲液,包被缓冲液CBS(0.05mol/L、pH 9.6的碳酸盐缓冲液),稀释液PBS(0.01mol/L、pH 7.4的磷酸盐缓冲液),封闭液(含20g/L甘氨酸的PBS),洗涤缓冲液PBST(含5mL/L Tween-20的 PBS),终止液(2 mol/L的硫酸溶液),酶底物(四甲基联苯胺的柠檬酸缓冲溶液),均自行配制。
1.1.3 仪器设备 多功能酶标检测仪synergy HT,美国 Bio-TEK instruments;万分之一电子天平,北京赛多利斯仪器系统有限公司;PH050A型培养箱/干燥箱,上海一恒科学仪器有限公司;96孔可拆卸酶标板,Corning公司;移液器,德国Eppendorf;WH-2微型漩涡振荡仪,上海沪西仪器分析厂。
1.2 方法
1.2.1 单克隆抗体的制备与纯化 将冻存的可以稳定分泌去氢甲睾酮单克隆抗体的杂交瘤细胞株1D6F10B4复苏,置于培养箱中培养。取6周龄左右的健康Balb/c小鼠腹腔注射灭菌石蜡,10d后腹腔注射处于对数生长期的去氢甲睾酮杂交瘤细胞,每只1.0×106个。间隔1周后采集腹水,经12000 r/min离心15min预处理,弃沉淀,收集上清液。
将采集的小鼠腹水用辛酸-硫酸铵法纯化获得单克隆抗体,具体步骤如下:①取适量经预处理的小鼠腹水,用0.06mol/L、pH 4.8的醋酸缓冲液稀释2倍;②按33μL/mL原始腹水的比例,30min内逐滴加入正辛酸,边滴边搅拌;于4℃静置2h后,12000r/min离心20min,取上清液经过滤纸过滤;②加入1/10上清液体积的0.1mol/L、pH 7.4的PBS,并用1mol/L NaOH 调pH 至7.4;④上清液在4℃冰浴条件下,按277g/L的比例加入硫酸铵粉末,边加边搅拌,30min内加完,4℃静置2h以上;⑤在4℃ 以12000r/min离心30min,弃上清液,收集沉淀,将沉淀溶于一定体积的PBS,并于4℃下置于50倍~100倍的PBS中透析除盐2d~3 d,期间每天更换3次透析液。分装之后冻存于-20℃备用。
1.2.2 单抗效价的测定 间接ELISA法测定单抗效价。将单抗分别稀释4000、8000、16000、32000、64000、128000倍,设置平行,并加稀释5000倍的阴性血清作为对照。酶标仪测定450nm的吸光度值OD 450nm。阳性血清的OD 450nm≥阴性对照OD 450nm的2.1倍,此时的单抗的最高稀释倍数即为效价。
1.2.3 DMT包被抗原与单抗工作浓度的确定 方阵滴定法确定DMT包被抗原与单抗的最佳工作浓度。
1.2.4 试剂盒竞争ELISA检测方法的建立DMT间接竞争ELISA的具体操作步骤如下:①包板:每孔加入1μg/mL的完全抗原DMT-BSA 100μL进行包被,置于4℃过夜,PBST洗板3次,在吸水纸上拍干;②封闭:每孔加入封闭液200μL,置于37℃培养箱内温育2h,PBST洗板3次,在吸水纸上拍干;③加一抗:每孔加入DMT标准品或处理好的待测样品(40μL/孔),各做3个重复,然后加入稀释8000倍的DMT抗体(60μL/孔),置于37℃培养箱内温育50min,PBST洗板3次,在吸水纸上拍干;④加二抗:每孔加入100μL稀释5000倍的HRP酶标山羊抗鼠IgG,置于37℃培养箱内温育1h,PBST洗板4次、在吸水纸上拍干;⑤显色:每孔加入100μL TMB显色液,37℃温育10min;⑥终止:每孔加入终止液2mol/L H2SO450μL。酶标仪测定吸光度OD 450nm值。
1.2.5 标准曲线的绘制与曲线拟合 用竞争ELISA 法测定单抗对不同浓度(0、0.1、0.5、1、2.5、5、10、25、50、100ng/mL)DMT标准品的抑制率,以吸光率百分比B/B0(B是不同浓度标准液的OD 450 nm值,B0是零浓度标准液的OD 450nm值)为y轴,以不同浓度标准品的对数值lg(DMT)为x轴,绘制标准曲线,推导出回归方程,并计算半数抑制浓度IC50。
1.2.6 试剂盒准确度的检测 以加标猪肉糜为样品,对试剂盒进行检测回收率试验:猪肉糜阳性样品的制备[12]:取5g(精确至0.01g)猪肉糜置于50mL离心管中,加入5mL纯水,再加入不同浓度的DMT标准品;加入叔丁基甲醚20mL,涡旋混匀器混匀1min,超声波发生器中超声波提取10min,之后8000r/min离心5min,上层有机相转移至另一支50mL离心管中;下层再用20mL叔丁基甲醚分2次提取,合并有机相;将有机相40℃旋转蒸发,加20mL/L甲醇-PBS定容至10mL,使DMT的终浓度分别为0.1、1、5、10、50、100ng/mL;进行ELISA测定,计算检测回收率。
1.2.7 试剂盒精密度的检测 一般用变异系数来表示,包括标准可重复试验和样品可重复试验。
1.2.7.1 标准可重复试验 取3块不同酶标板,每板随机抽取4个孔,均测定1ng/mL DMT标准溶液的OD 450nm值,计算变异系数(CV)。
1.2.7.2 样品可重复试验 取3块不同酶标板,每板随机抽取4个孔,测定DMT终浓度为5ng/mL的猪肉糜的回收率,计算变异系数。
1.2.8 试剂盒特异性的检测 选择DMT的结构类似物丙酸睾酮酯、群勃龙作抑制物,浓度均设定为系列浓度 0、0.1、0.5、1、2.5、5、10、25、50、100 ng/mL,竞争ELISA测定其IC50,计算与DMT的交叉反应率。
交叉反应率=(DMT的IC50/竞争物的IC50)×100%。
1.2.9 试剂盒稳定性的检测 对在4℃下保存0、30、90、180d的试剂盒做竞争ELISA试验,检测系列浓度0、0.1、0.5、1、2.5、5、10、25、50、100ng/mL DMT标准品的ODmax值、IC50值。
2 结果
2.1 单抗的效价
将抗体分别稀释4000、8000、16000、32000、64000、128000、256000倍,阴性血清稀释5000倍,ELISA测定其OD 450nm值,结果如表1所示。以抗体的OD 450nm值大于等于阴性血清对照的OD 450nm值的2.1倍作为抗血清的效价,对照表1所示,其抗体效价为64000,达到制备酶联免疫试剂盒的要求。
2.2 DMT包被抗原和单抗的工作浓度
棋盘法结果如表2所示,吸光值最接近1.0所对应的DMT包被抗原的工作浓度1μg/mL,单抗的稀释倍数为1∶8000,即为包被抗原和抗体的最佳工作浓度。
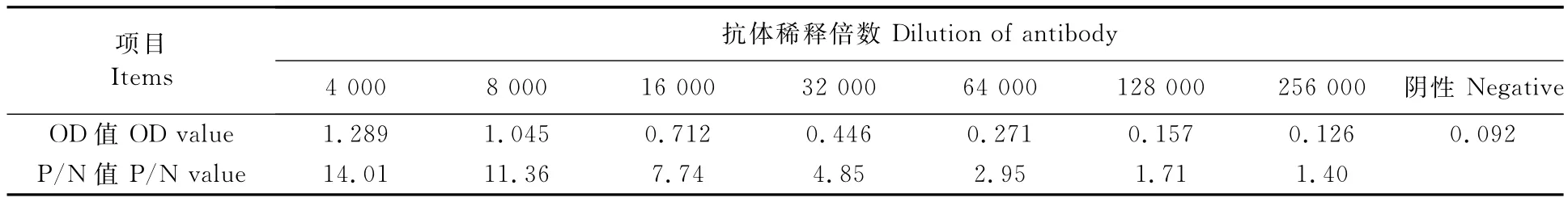
表1 抗体效价的测定Table1 Determination of antibody titer
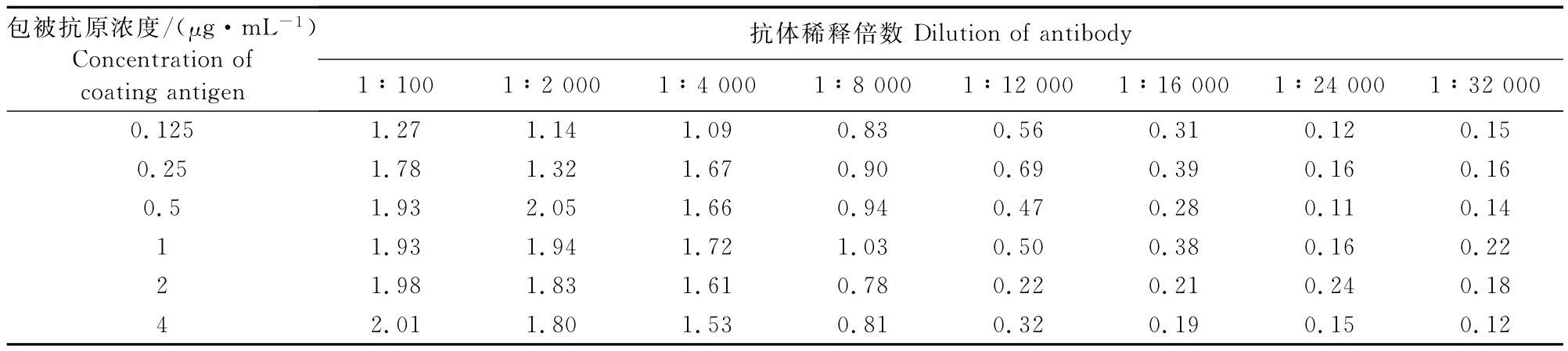
表2 棋盘法结果Table2 The result of checkerboard method
2.3 标准曲线
标准曲线如图1所示,线性回归方程为y=-0.2055x+0.516,相关系数R2=0.9931,线性范围为0.1ng/mL~100ng/mL。根据回归方程计算出IC50值为3.20ng/mL。最低检测限LOD(相当于IC10值)为0.014ng/mL。
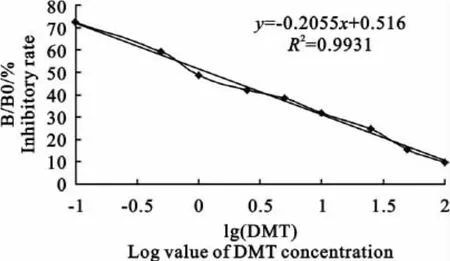
图1 ELISA方法检测DMT的标准曲线图Fig.1 The calibration curve of ELISA for DMT
2.4 准确度
如表3所示,对已知DMT浓度为0.1、1、5、10、50、100ng/mL的猪肉糜样品进行检测,回收率在87.41%~110.70%之间,平均回收率为100.03%;变异系数在2.05%~10.81%之间,平均变异系数为5.76%,变异系数均小于15%,说明该试剂盒是可靠的,可用于DMT在猪肉糜中残留量的分析测定。
2.5 精密度
如表4所示,从3块不同的酶标板中随机抽取4个孔,测定1ng/mL DMT标准溶液的OD 450 nm值,得到的变异系数在3.16%~4.64%之间,小于15%,结果较为可靠。
我国农业部于2002年发布的第235号文件中规定了丙酸睾酮、甲睾酮、群勃龙等类固醇激素在动物性食品中的最高残留限量为不得检出。因此本试验选取低浓度5ng/mL作为加标浓度,结果如表5所示,得到的变异系数在6.97%~10.48%之间,小于15%,表明该试剂盒具有较好的重复性。
2.6 特异性
如表6所示,用试剂盒测得DMT与两种结构类似物丙酸睾酮酯、群勃龙的交叉反应率均小于1%,说明制备的DMT酶联免疫检测试剂盒与DMT的结构类似物几乎没有交叉反应,特异性良好。
2.7 稳定性
如表7所示,将试剂盒在4℃下保存6个月,随着试剂盒保存期的延长,ODmax值有所下降但幅度并不高,仍为新制备试剂盒的90%,能满足试剂盒的吸光值要求(吸光值小于0.5时,一般试剂盒不予使用)。IC50值波动范围为2.961ng/mL~3.206 ng/mL,波动幅度较小,在新包被板正常的波动幅度内。比值ODmax/IC50变化也不大,这都说明试剂盒在4℃6个月保存期内质量可以保持稳定。

表3 猪肉样品加标回收率Table3 Recoveries of pork samples
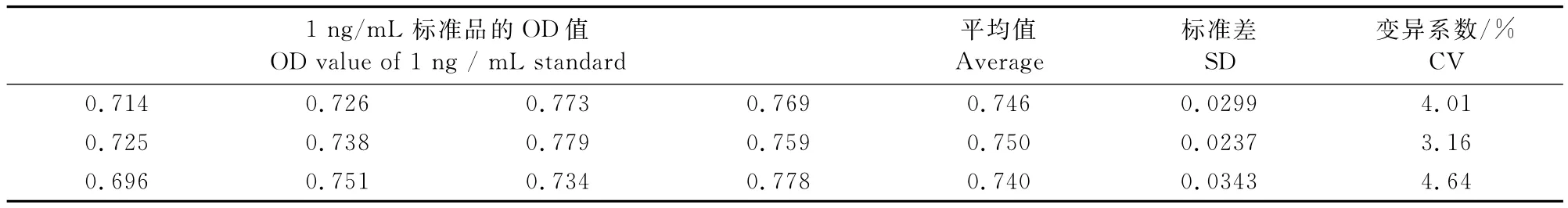
表4 标准品可重复性试验Table4 The repetition experiment of standards
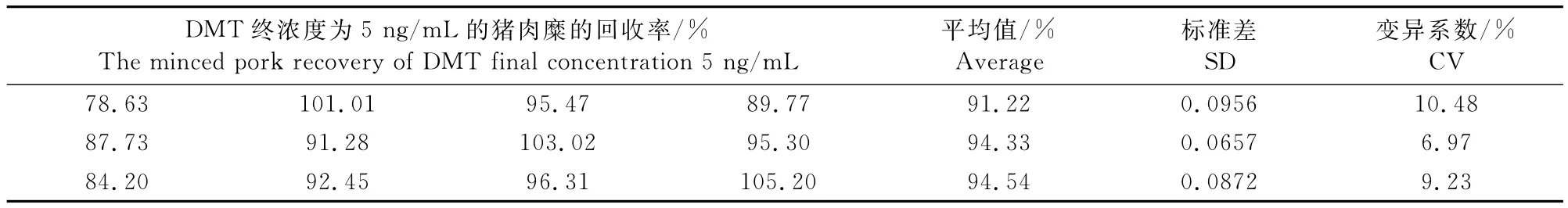
表5 加标回收的可重复性试验Table5 The repetition experiment of spiked recoveries
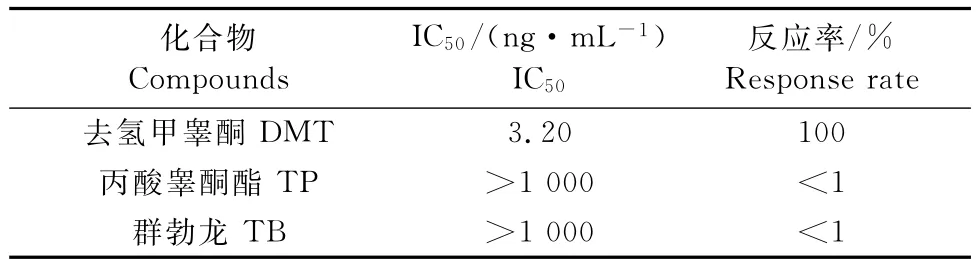
表6 交叉反应率的测定Table6 Determination the cross-reactivity
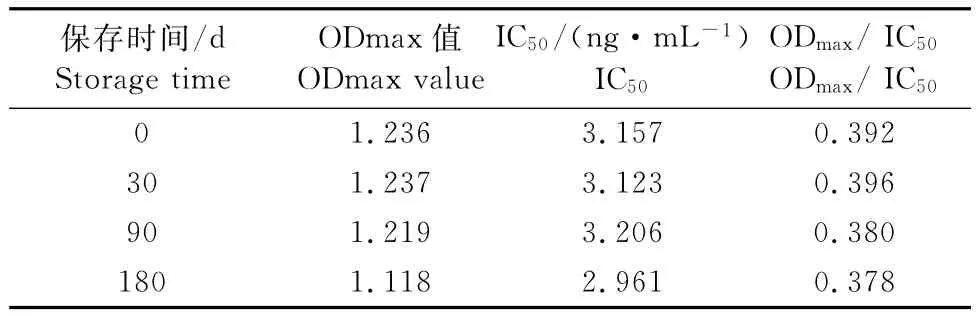
表7 4℃保存试验Table7 The preservation experiment at 4℃
3 讨论
DMT具有外源激素的一切特征,自20世纪50年代中期问世以来,作为生长促进剂广泛应用在畜牧养殖生产中以达到大幅提高养殖经济效益的目的。但是,消费者长期摄入含有此类激素类药物的动物源性食品会导致内分泌紊乱和性早熟,影响儿童的正常生长发育,损伤肝脏功能,同时会增加致癌、致畸的风险。早在1988年1月1日欧盟就禁止使用促生长同化激素,我国农业部也在1988年6月30日发布的《兽药管理条例实施细则》中规定“不得添加激素类药品”。目前,检测DMT的主要可行方法有 GC-MS[13]和 LC-MS[14],虽然检测准确,但缺点是费时耗力、费用高而且样品预处理要求较高。ELISA检测方法具有的灵敏度高、可以在纳克水平上进行定量检测、具有高度的特异性,同时又操作简单等特点是仪器方法所无法比拟的[15]。
间接竞争酶联免疫吸附法的基本原理是抗原抗体的结合反应。本试验在酶标板上包被DMT-BSA完全抗原,经过封闭步骤后将DMT标准品或样品、抗DMT抗体先后加入微孔,温育时,游离的DMT和固相载体上的DMT-BSA完全抗原竞争结合抗DMT抗体的结合位点,其中抗体与DMT-BSA完全抗原结合形成固相抗原抗体复合物,经过洗涤后固相载体上只留下与固相抗原结合了的特异性抗体,加入酶标二抗与固相复合物中的特异性抗体结合,从而使该抗体间接地被标记上了酶。结合了的酶可以由显色剂显示出来,因为酶可以使无色的显色剂转变成蓝色,反应终止液加入后使颜色由蓝色转变为黄色。用酶标仪进行测量,吸收光强度与样品中的DMT的含量成反比。
依据上述反应原理设计组装了DMT-ELISA检测试剂盒。试验所用DMT单抗效价达到64000,保证了试剂盒的高灵敏性;根据试剂盒采用的反对数曲线拟合成直线进行线性定量的原理,将标准点B/B0与DMT浓度的对数值设置在同一条曲线上体现其线性,结果显示工作范围为0.1 ng/mL~100ng/mL;猪肉糜添加回收试验结果证实,本试剂盒准确度较高;标准品可重复试验与样品加标回收的可重复性试验的变异系数均小于15%,说明该试剂盒精密度良好;采用交叉反应试验鉴定试剂盒的特异性,结果证实DMT与结构类似物丙酸睾酮酯和群勃龙的交叉反应率均小于1%,表明该试剂盒特异性较高;保存试验表明该试剂盒在4℃条件下能保持其稳定性6个月。本试验研制的DMT-ELISA试剂盒既可用于DMT在动物性食品中的残留检测,也为深入研究去氢甲睾酮的免疫学检测技术奠定了基础。
[1]Geyer H,Bredehoft M,Mareck U,et al.High doses of the anabolic steroid metandienone found in dietary supplements[J].Eur J Sport Sci,2003,3(1):1-5.
[2]李 凯,岑 瑛.蛋白同化激素及其应用[J].现代临床医学,2006,32(4):306-308.
[3]陈慧华,应永飞,吴乎谷,等.液相色谱-串联质谱同时测定动物组织中22种同化激素[J].分析化学,2009,37(2):181-186.
[4]湛 嘉,俞雪钧,李佐卿,等.气质联用法同时测定猪尿中的20种同化激素[J].分析化学简报,2009,37(2):251-254.
[5]Maravelias C,Dona A,Stefanidou M,et al.Adverse effects of anabolic steroids in athletes a constant threat[J].Toxicol Let,2005,158(3):167-175.
[6]Kaklamanos G,Theodoridis G,Dabalis T.Determination of anabolic steroids in bovine urine by liquid chromatography-tandem mass spectrometry[J].J Chromat B,Analytical TechnolBiomed Lif Sci,2009,877(23):2330-2336.
[7]Kaw C H,Hefle S L,Taylor S L.Sandwich enzyme-linked immunosorbent assay(ELISA)for the detection of lupine residues in foods[J].Food Sci,2008,3(8):135-140.
[8]Kondo M,Yamashita H,Uchigashima M,et al.Development of an enzyme-linked immunosorbent assay for residue analysis of the insecticide emamectin benzoate in agricultural products[J].J Agr Food Chem,2009,57(2):359-364.
[9]Lifrani A,Dos Santos J,Dubarry M,et al.Development of animal models and sandwich-ELISA tests to detect the allergenicity and antigenicity of fining agent residues in wines[J].J Agri Food Chem,2009,57(2):525-534.
[10]张 勋,董 英,王 云,等.去氢甲睾酮单克隆抗体的制备与鉴定[J].细胞与分子免疫学,2011,27(10):1103-1105.
[11]Sheng W,Xu T,Ma H X,et al.Development of an indirect competitive enzyme-linked immunosorbent assay for detection of danofloxacin residues in beef,chicken and pork meats[J].Food Agricult Immunol,2009,20(1):35-47.
[12]贺利民,黄显会,方炳虎.超高效液相色谱一串联质谱法测定动物肌肉组织和鸡蛋中残留的11种甾体激素类药物[J].色谱,2008,26(1):714-719.
[13]杨悦武,吴如金,王宗镰,等.气相色谱-质谱法测定尿中去氢甲睾酮及其代谢物[J].中国药科大学学报,1991,22(5):282-285.
[14]Pihlainen K,Sippola E,Kostiainen R.Rapid identification and quantitation of compounds with forensic interest using fast liquid chromatography–ion trap mass spectrometry and library searching[J].J Chromatog A,2003,994(1-2):93-102.
[15]申宏丹,窦 红,高春平,等.直接竞争酶联免疫检测莱克多巴胺研究[J].动物医学进展,2009,30(8):58-63.

