小花棘豆总黄酮对小鼠游泳运动能力的影响
王 帅,蒋 慧,席琳乔,陈根元,张 玲,马春晖
(新疆生产建设兵团塔里木畜牧科技重点实验室 塔里木大学动物科学学院,新疆 阿拉尔 843300)
小花棘豆(Oxytropis glabra)是豆科棘豆属植物,在新疆分布广泛,具有一定的药用价值,能够治疗关节炎、牙痛、神经衰弱等,有麻醉、镇静、止痛的功效[1]。黄酮类化合物是小花棘豆的有效成分之一[2]。于荣敏等[3]分离得到了小花棘豆中的黄酮甙,并对其进行了结构鉴定,刘璐等[4]比较了5种棘豆属植物的黄酮类物质含量,发现小花棘豆的黄酮含量高于急弯棘豆、黄花棘豆和冰川棘豆,具有一定的利用前景。国内外对小花棘豆的生物碱成分的研究较多,但对黄酮类物质的含量、组成等研究相对较少,小花棘豆黄酮类物质抗脂质氧化活性的研究未见报道。本试验通过建立小鼠力竭游泳模型,研究小花棘豆总黄酮的运动保健和抗脂质过氧化作用,为小花棘豆的综合利用提供基础资料。
1 材料与方法
1.1 材料
1.1.1 材料 小花棘豆2011年8月采集于新疆阿拉尔市托喀依乡,由塔里木大学动物科学学院草业科学学科组鉴定。取植株的地上部分,阴干、粉碎、过20目筛后备用。
1.1.2 试剂 超氧化物歧化酶(SOD),谷胱甘肽过氧化物酶(GSH-Px),脂褐素(LPO),肌酸激酶(CK),谷草转氨酶(AST),谷丙转氨酶(ALT),过氧化氢酶(CAT),丙二醛(MDA),肌糖原(Muscle glycogen),肝糖原(liver glycogen),乳酸(lactic acid),尿素氮(BUN)检测试剂盒,均购自南京建成生物技术有限公司;其余试剂均为国产分析纯;实验室用水为超纯水。
1.1.3 仪器 VetTest 8008型生化分析仪,StatSpin VT型离心机,北京安普生化科技有限公司;BS124型精密电子天平,德国赛多力斯;Direct-Q3型超纯水系统,美国Millipore。
1.1.4 实验动物 选用6周龄~8周龄昆明种小鼠,体重20g±2g,雌雄各半,由塔里木大学动物科学学院实验站提供。
1.2 方法
1.2.1 小花棘豆总黄酮的提取 参考刘璐等[4]的方法进行。称取小花棘豆样品100g,加600mL/L乙醇300mL,超声浸提45min,超声波功率800W,温度45℃。过滤后残渣再加600mL/L乙醇300 mL浸提1次,合并滤液,回收乙醇得到总黄酮浸膏,加水稀释后上处理好的大孔吸附树脂,乙醇洗脱。收集洗脱液,挥干后即得到小花棘豆总黄酮样品。经 NaNO2-Al(NO3)3-NaOH 显色方法测定小花棘豆总黄酮含量为16.54mg/g。该样品与生理盐水混匀,用于小鼠灌胃。
1.2.2 小鼠游泳训练 小鼠游泳训练在特制的游泳箱(半径为50cm,水深为50cm)中进行,水温保持在37℃±1℃。第1天训练时间为15min,以后逐日递增5min,加至30min维持该训练量至训练结束[5]。共训练14d,剔除不会游泳的小鼠。
1.2.3 小鼠分组与给药 选取训练合格的40只小鼠随机分为对照组(A组)和黄酮低剂量组(B组,剂量10mg/kg)、中剂量组(C组,剂量30mg/kg)、高剂量组(D组,剂量50mg/kg),每组10只。对照组灌服生理盐水,各试验组连续灌服15d后进行正式实验。
1.2.4 小鼠负重游泳试验 末次给药后1h,在小鼠尾部缚其体重5%的砝码,放入游泳箱中进行负重游泳试验。记录从开始游泳到力竭(沉入箱底后10s不浮出水面)所用的时间。力竭后将小鼠取出,采血制备抗凝全血及血清,即刻采用颈椎脱臼法致小鼠死亡,迅速取出小鼠的肝组织制备成100g/L的组织匀浆,取脑组织制备组织匀浆,取小鼠趾长伸肌。
1.2.5 检测指标 血液成分采用生化仪测定13项生理指标:白细胞总数(WBC),红细胞数(RBC),淋巴细胞数(Lym),中值细胞数(Mid),粒细胞数(Gran),淋巴细胞百分数(Lym%),中值细胞百分数(Mid%),粒细胞百分数(Gran%),血红蛋白浓度(HGB),红细胞压积 (HCT),平均红细胞体积(MCV),平均红细胞血红蛋白浓度(MCHC),红细胞体积分布宽度(RDW)。血清指标和组织指标均采用试剂盒测定,血清指标包括AST、ALT、CK、SOD、MDA、CAT、GSH-Px、乳酸和BUN;组织指标包括SOD、MDA、CAT、GSH-Px和肝糖原(肝脏组织),LPO(脑组织),肌糖原(趾长伸肌)。
1.2.6 数据分析 试验数据用Excel处理,数据分析用SPSS 11.5中One-Way ANOVA进行单因素方差分析,差异显著时采用LSD法进行多重比较,结果用平均数±标准差表示。
2 结果
2.1 小花棘豆总黄酮对小鼠负重游泳时间的影响
由表1可知,与对照组相比,用小花棘豆总黄酮灌胃15d后高剂量组可极显著延长小鼠游泳至力竭所需时间(P<0.01),中剂量组可显著延长小鼠游泳至力竭所需时间(P<0.05)。

表1 小花棘豆总黄酮对小鼠负重游泳时间的影响Table1 Effects of total flavonoids fromOxytropis glabra on weight-loaded swimming time in mice
2.2 小花棘豆总黄酮对小鼠白细胞的影响
由表2可知,高剂量组小鼠Mid%和Gran均极显著高于对照组,WBC和Gran%极显著低于对照组(P<0.01);中剂量组和低剂量组小鼠 Mid%均显著高于对照组(P<0.05),其他白细胞成分与对照组相比,差异不显著(P>0.05)。

表2 小花棘豆总黄酮对小鼠白细胞的影响Table2 Effects of total flavonoids fromOxytropis glabra on leukocytes in mice
2.3 小花棘豆总黄酮对小鼠红细胞和血红蛋白的影响
由表3可知,中剂量组和高剂量组小鼠HGB和HCT均极显著高于对照组(P<0.01),高剂量组小鼠MCV和MCHC显著高于对照组(P<0.05),RBC和RDW与对照组差异不显著(P>0.05);低剂量组小鼠所有指标与对照组差异不显著(P>0.05)。
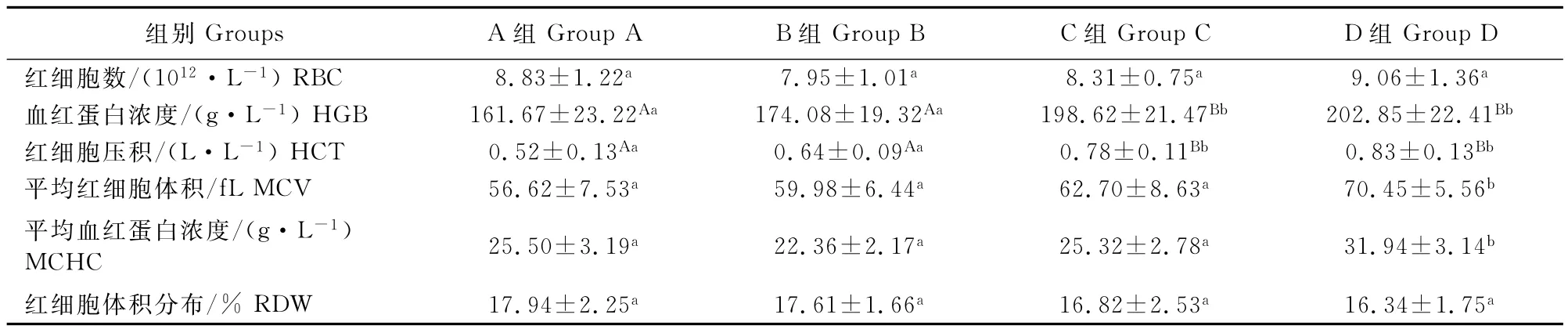
表3 小花棘豆总黄酮对小鼠红细胞和血红蛋白的影响Table3 Effects of total flavonoids fromOxytropis glabra on red blood cell and hemoglobin in mice
2.4 小花棘豆总黄酮对小鼠血清指标的影响
由表4可知,使用小花棘豆总黄酮灌胃15d后,高剂量组小鼠力竭运动后血清SOD、GSH-Px和CAT活性均极显著高于对照组,而AST和CK活性及MDA、乳酸和BUN含量均极显著下降(P<0.01)。中剂量组小鼠SOD和CAT活性显著高于对照组,而MDA和BUN含量显著低于对照组(P<0.05)。低剂量组小鼠血清MDA含量显著低于对照组(P<0.05),其他各项指标均差异不显著(P>0.05)。

表4 小花棘豆总黄酮对小鼠血清指标的影响Table4 Effects of total flavonoids fromOxytropis glabra on serum indexes in mice
2.5 小花棘豆总黄酮对小鼠组织指标的影响
由表5可知,高剂量组小鼠力竭运动后肝组织中SOD和GSH-Px活性及肝糖原含量均极显著高于对照组,肝组织中MDA含量和脑组织中LPO含量均极显著低于对照组(P<0.01);肝组织CAT活性显著高于对照组(P<0.05)。中剂量组脑组织LPO含量极显著低于对照组(P<0.01),肝组织中SOD活性和肝糖原含量均显著高于对照组(P<0.05),MDA含量显著低于对照组(P<0.05)。低剂量组小鼠肝糖原含量显著高于对照组(P<0.05),其他各项指标差异均不显著(P>0.05)。
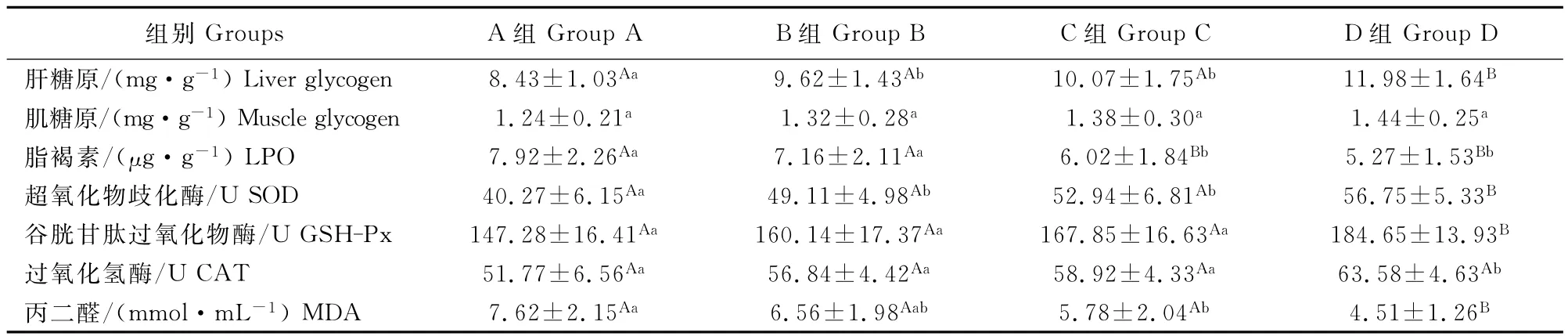
表5 小花棘豆总黄酮对小鼠组织指标的影响Table5 Effects of total flavonoids fromOxytropis glabra on tissue indexes in mice
3 讨论
大量研究结果表明,高强度运动会显著提高机体脂质过氧化水平[6]。其原因为机体在长时间运动时肌肉所需的能量为有氧和无氧作用混合供能,既要求供能快,又要求供能的持续时间长,而且整个过程缺氧程度较深。故高强度运动后机体产生了大量的氧自由基(·O2)和中间代谢产物,自由基将不饱和脂肪酸氧化生成脂质过氧化物,最终转变为MDA,所以体内MDA含量的高低可直接反应机体组织细胞受损伤的程度[7];乳酸、尿素氮等代谢产物造成内环境稳定性失调,从而引起机体疲劳[8]。正常动物机体内存在着许多清除自由基的物质,其中SOD可将·O2转化为H2O2,再经CAT作用分解为O2和H2O;GSH-Px在H2O2的转化过程中保护细胞和生物大分子免受自由基的破坏。降低机体脂质过氧化的程度又可以减少机体的无氧供能,从而减少中间代谢产物,延缓疲劳发生。
本试验发现,高剂量的小花棘豆黄酮可以极显著延长小鼠负重游泳的时间,说明小花棘豆黄酮可以有效减轻长时间游泳运动引起的小鼠体内脂质过氧化程度。有研究表明,抗氧化剂可以减少·O2对细胞器的伤害,减轻细胞的应激反应[9]。黄酮类物质具有很强的抗·O2活性,可以有效清除·O2,从而提高小鼠的游泳运动能力。而小花棘豆黄酮类物质在体内是减少·O2的生成还是加快其清除速率,有待进一步探讨。
小花棘豆总黄酮可降低血液中WBC和Gran%,提高 Gran、Mid%、Lym% 、HGB、HCT等指标;降低了血清中AST和CK的活性,增强了血清和组织中的SOD、CAT和GSH-Px的活性。其中AST在血清中含量较低,当肝细胞发生坏死或破裂时血清AST活性显著升高[10],试验中黄酮灌服组血清AST活性均低于对照组,说明小花棘豆总黄酮可以有效保护肝细胞免受·O2的损害。SOD、CAT和GSH-Px均在·O2的清除过程中发挥重要作用,试验研究发现随着小花棘豆总黄酮灌服剂量的增加,三种酶活性呈上升趋势,表明小花棘豆总黄酮能显著提高小鼠抗力竭运动所导致损伤的能力。
在小鼠游泳运动过程中,当机体有氧氧化不能满足能量的要求时,就必须靠加速糖的无氧酵解来提供能量,在这一过程中机体会产生大量的乳酸并最终进入血液;而当机体可利用的糖耗竭或糖代谢不能提供足够的能量时,机体的蛋白质与氨基酸分解代谢会随之增强,使得血清中BUN含量增加[11]。小花棘豆总黄酮有效降低了游泳运动后小鼠血清乳酸和BUN的含量,可能与其减少了细胞膜通透性和葡萄糖无氧酵解,保护肾小球滤过膜以及肾线粒体[12],改善了小鼠有氧供能的能力从而提高机体的耐力有关。
游泳运动初期,机体首先利用血中葡萄糖的有氧氧化和肌糖原酵解供给能量,而当肌糖原被分解耗竭时,肝糖原分解增加以维持血糖水平,故肝糖原和肌糖原含量是反映疲劳程度的敏感指标[13]。试验结果表明,高剂量的小花棘豆总黄酮可有效提高游泳运动后小鼠肌糖原和肝糖原含量,但总黄酮低剂量组与对照组差异不显著。小花棘豆总黄酮是通过增加肝、肌糖原储备,还是减少运动时对肝、肌糖原的消耗来发挥作用,或者两者兼有之,仍有待进一步研究。
综上所述,小花棘豆总黄酮可明显提高小鼠游泳运动能力,增强血清和组织中抗脂质过氧化酶的活性,降低代谢中间产物和MDA的含量,有较好的体内抗脂质过氧化活性,具有一定的应用前景。
[1]高木木,阎 平,翟 伟.新疆棘豆属植物新资料[J].西北植物学报,2008,28(7):1474-1477.
[2]罗 扬.鄂尔多斯草原小花棘豆黄酮含量及化感作用的研究[D].北京:北京林业大学,2011.
[3]于荣敏,李 铣,针谷义宏,等.小花棘豆中黄酮甙的2D-NMR研究[J].波谱学杂志,1991,14(3):14-20.
[4]刘 璐,付明哲,王 侠,等.5种棘豆总黄酮含量的测定比较[J].草业科学,2011,28(4):683-686.
[5]龚梦鹃,王立为,刘新民.大小鼠游泳实验方法的研究概况[J].中国比较医学杂志,2005,15(5):311-314.
[6]帅学宏,胡庭俊,陈炅然,等.鬼臼多糖对小鼠免疫功能和抗氧化能力的影响[J].畜牧兽医学报,2008,39(7):1000-1004.
[7]Li H Y,Hao Z B,Wang X L,et a1.Antioxidant activities of extracts and fractions fromLysimachia foenumgraecumHance[J].Bioresour Technogy,2009,100(2):970-974.
[8]宋怡敏,毛跟年,黄小双,等.阿胶泡腾颗粒对小鼠造血功能及抗疲劳作用的影响[J].动物医学进展,2011,32(10):83-86.
[9]陈福星,陈文英,郝艳霜.蒲公英多糖对小鼠免疫器官的影响[J].动物医学进展,2008,29(4):10-12.
[10]曹授俊,雷莉辉,王金秋,等.中药复合剂AFF-Ⅰ口服液对小鼠急性肝损伤血液生化指标的影响[J].动物医学进展,2012,33(1):79-81.
[11]Zhang Q F,Zhang Z R,Cheung H Y.Antioxidant activity of Rhizoma smilacis Glabrae extracts and its key constituentastilbin[J].Food Chem,2009,115(1):297-303.
[12]Ozsoy N,Can A,Yanardag R,et al.Antioxidant activity of Smilaa excelsa L.leaf extracts[J].Food Chem,2008,110(3):571-583.
[13]姚庆智,何秀玲,张智毓,等.蒙古口蘑及其多糖提取物对小鼠免疫功能的影响[J].动物医学进展,2011,32(2):47-51.

