无乳链球菌表面蛋白Rib 基因克隆与重组表达
张 荣,杜欣军,徐桂香,王 菲,王 硕
(食品营养与安全省部共建教育部重点实验室 天津科技大学食品工程与生物技术学院,天津 300457)
奶牛乳房炎是奶牛乳腺的炎症反应,通常由微生物感染引起。在世界范围内,奶牛乳房炎都是危害奶牛养殖业最重要的因素之一,并且难以控制[1]。乳房炎对于奶牛养殖业的危害包括产奶量下降、牛奶质量降低和生产成本增高等[2]。奶牛乳房炎的预防和控制必须采取持之以恒的综合性防治措施才有效,加强饲养管理和环境卫生是控制奶牛乳房炎的基本措施,而利用疫苗来控制奶牛乳房炎是防治本病的发展趋势。
导致奶牛乳房炎的病原微生物有细菌、真菌、病毒等,其中以细菌最为常见[3]。无乳链球菌是奶牛乳腺炎的病原菌,按Lance-field氏血清学分类,无乳链球菌划归B群。无乳链球菌为革兰阳性菌,菌体为圆形或卵圆形,直径约0.6μm~1.2μm,无鞭毛,无芽胞,最适生长温度为36℃~37℃[4]。
传统的无乳链球菌荚膜多糖疫苗免疫原性较弱,使其应用受到限制[5],而表面蛋白免疫原性较强,是一种理想的候选疫苗。此外,表面蛋白作为微生物特征性的大分子,具有较高的种属特异性,是一种理想的免疫检测靶标。因此,无乳链球菌表面蛋白的研究对于高效疫苗的研制与免疫检测方法的建立具有重要的意义。
Alp蛋白(α-like protein,Alp)是无乳链球菌重要的一类表面蛋白,目前已鉴定出α、Rib、R28和Alp2等4种。其中Rib蛋白是从Ⅲ型菌株细胞壁提取物中分离出的一种高分子质量蛋白质(123ku),其纯化蛋白质的特性与α蛋白有许多相似性,特别是这两种纯化蛋白质的N端氨基酸顺序有61%是相同的,但在免疫学性质上无交叉反应[6]。Rib蛋白质对胰蛋白酶有耐受性,抗Rib抗体对Rib菌株所致的感染具有保护免疫作用[7]。Areschoug T等[8]的研究表明大多数Ⅲ型菌株和少量的Ⅱ型及Ⅴ型菌株亦能表达有Rib蛋白质。大部分无乳链球菌具有Rib或α蛋白,而且已有研究显示,如果用Rib和α蛋白一起免疫接种老鼠,不需用佐剂就可以对大部分无乳链球菌产生很强的免疫保护作用,因此Rib与α联合疫苗与其他疫苗相比有很大优势[9]。
本研究成功克隆了Rib蛋白N端基因片段,并重组构建了rib-pET26b表达载体,通过转化宿主细胞以及诱导蛋白表达获得了重组蛋白,并以此作为抗原免疫获得了多克隆抗体,为无乳链球菌疫苗的开发和免疫检测方法的建立奠定了良好的基础。
1 材料与方法
1.1 材料
无乳链球菌ATCC BAA-1176(Ⅲ型)购自ATCC公司;胰酶大豆肉汤培养基(Tryptone soya broth)购自Oxiod公司;蛋白酶K、十二烷基磺酸钠(Sodium dodecyl sulfate,SDS)、Tris、酚、氯仿、异戊醇(25∶24∶1)、琼脂糖,均购自BBI公司;GoTaq酶购自Promega公司;其他试剂均为国产分析纯。
1.2 方法
1.2.1 基因组DNA的提取 将 ATCC BAA-1176菌株培养至对数期,用基因组DNA提取试剂盒(Tiangen)提取其基因组DNA。
1.2.2 Rib基因扩增 以提取到的基因组DNA为模板,利用引物Rib F1(5′-AAGTTTGGTGCAGCTTCTGT-3′)和Rib R1 (5′-TTAGGATTATTATCAATATC-3′)进行 PCR 扩增。反应条件为:94℃3min;94℃30s,45℃45s,72℃45 s,共进行35次循环;72℃10min。取5μL样品进行10g/L琼脂糖凝胶电泳检测,并用凝胶回收试剂盒(Tiangen)进行胶回收。
1.2.3 目的基因的测序 将胶回收得到的目的基因与pEASY-T1载体连接并测序。
1.2.4 表达片段的扩增 根据测序结果,设计表达引 物 Rib F2(5′-TACTCAGAATTCGATTGGTATTAGTTTTTTAGG-3′,斜体部分为限制性内切酶位点EcoRⅠ)和 Rib R2(5′-TACTCACTCGAGCTCGTCCCATTTAGGGTCTT-3′,斜体部分为限制性内切酶位点XhoⅠ),以rib-pEASY-T1为模板进行PCR,反应条件为94℃3min;94℃30s,53℃45s,72℃45s,共进行35次循环;72℃10 min。将扩增后的片段进行琼脂糖凝胶电泳检测,并进行胶回收。
1.2.5 rib-pET26b重组质粒的构建 过夜培养含有pET-26b的DH5α菌株培养过夜,提取pet26b质粒,将此质粒与PCR回收得到的Rib目的基因分别用EcoRⅠ和XhoⅠ酶切,用DNA纯化回收试剂盒分别回收后加入T4DNA连接酶连接过夜。将连接产物转化大肠埃希菌DH5α感受态细胞,筛选阳性克隆。从阳性克隆中提取质粒,利用载体引物T7 promoter和T7terminater对重组质粒进行PCR鉴定,利用限制性内切酶EcoRⅠ和XhoⅠ对重组质粒进行酶切鉴定。
1.2.6 诱导表达 将重组质粒转化BL21(DE3)感受态细胞,加入终浓度为0.1mmol/L的IPTG 37℃诱导5h,SDS-PAGE检测表达结果。
1.2.7 Rib蛋白诱导条件的优化 由于37℃条件下表达蛋白不单一,因此在低温条件下进行诱导表达,并对IPTG浓度进行优化。分别选取0.1、0.05、0.01、0.005、0.001mmol/L的IPTG,在20℃条件下诱导12h。为了检测蛋白是否形成了包涵体,离心收集菌体进行超声波破碎,利用SDS-PAGE对不同条件下的上清液和沉淀进行检测。
1.2.8 包涵体变性复性及纯化 首先利用缓冲液A(50mmol/L Tris-HCl,5mmol/L EDTA,pH 8.0)和缓冲液 B(50mmol/L Tris-HCl,5mmol/L EDTA,2mol/L脲,pH 8.0)分别对包涵体蛋白进行充分洗涤,然后使用缓冲液 C(0.1mol/L Tris-HCl,10mmol/L DTT,8mol/L脲,pH 8.0)将沉淀悬起,充分混匀,于37℃摇床快摇1h,离心将上清液置于50倍体积透析液(0.1mol/L Tris-HCl,5 mmol/L EDTA,5mmol/L Cysteins,pH 8.0)中透析2d。将透析袋中的复性蛋白取出离心,上清液与沉淀分别进行SDS-PAGE检测。用His-tag凝胶亲和柱(Novagen)纯化上清液,步骤按照操作手册进行,洗脱收集的蛋白用Bradford法测浓度,SDSPAGE检测纯化效果。
1.2.9 质谱鉴定 将SDS-PAGE凝胶上的目的蛋白条带切成小块,用乙腈及胰蛋白酶等处理,完成样品制备,然后将样品放入质谱仪4700Proteomics Analyzer(ABI),用4000Series及GPS软件进行检测,选择NCBI数据库检索蛋白。
1.2.10 Rib多克隆抗体制备 将纯化后Rib蛋白进行SDS-PAGE电泳,切取目的蛋白后,利用液氮充分研磨,溶于9.0g/L NaCl;将0.5mg/mL的抗原1mL与弗式完全佐剂1mL乳化后初次免疫,对雄性新西兰大白兔背部进行多点皮内注射;将0.25 mg/mL的抗原1mL与弗式不完全佐剂1mL乳化后加强免疫,分别于初次免疫后2、4、6周共加强免疫3次,于第3次免疫后7d,从耳缘静脉处采血,利用间接ELISA方法[9]对抗血清效价进行测定。
2 结果
2.1 Rib蛋白基因克隆
以基因组DNA为模板,用基因特异性引物扩增目的基因,将此片段与T载体连接后进行测序,经BLAST比对,与Rib蛋白基因同源性达到99%。根据测序结果设计表达引物,扩增目的基因,电泳结果显示,目的基因在480bp左右,与预期相符(图1)。
2.2 rib-pET26b重组质粒的构建
将目的片段与pET26b分别酶切后进行连接,转化大肠埃希菌感受态DH5α并筛选阳性克隆。得到的阳性克隆利用PCR和酶切对重组质粒进行验证,琼脂糖凝胶电泳检测,结果显示重组表达质粒构建成功(图2)。
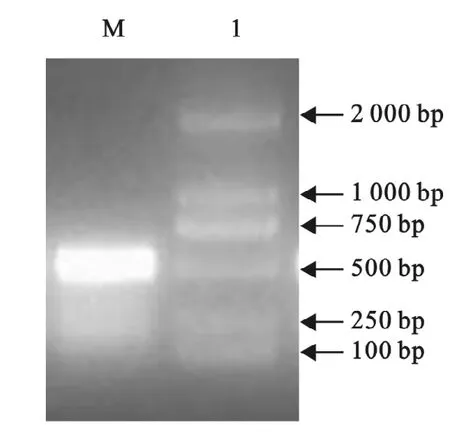
图1 rib基因片段的扩增Fig.1 Amplification of rib gene fragment
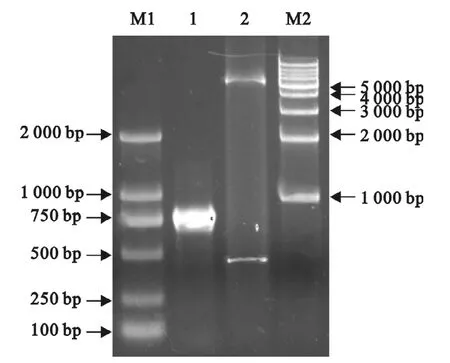
图2 PCR及酶切鉴定重组质粒Fig.2 Recombinant plasmid verified by PCR and enzyme digestion
2.3 诱导表达及SDS-PAGE
重组质粒转化大肠埃希菌感受态BL21(DE3),IPTG诱导蛋白表达(图3)。SDS-PAGE电泳检测结果显示,诱导后目的蛋白能够大量表达,但同时存在两种形式的蛋白,根据蛋白大小,推测分子质量较高的(约23ku)为目的基因与膜间隙定位信号融合蛋白,分子质量较低的(约18ku)为膜间隙定位信号切除后的目的蛋白。
2.4 重组蛋白表达条件优化及蛋白形式鉴定
对诱导后菌体进行超声波破碎,将上清和沉淀分别电泳,结果显示在所有条件下,重组表达蛋白均形成包涵体。在低温条件下,表达的蛋白仅为分子质量较小的目标蛋白。比较不同IPTG诱导表达的差异,IPTG浓度为0.05mmol/L时,目的蛋白的表达量最高(图4)。
2.5 Rib蛋白的纯化与浓度测定
对包涵体进行变性、复性,利用亲和凝胶对复性后Rib重组表达蛋白进行纯化,结果显示目的蛋白得到了较好的纯化(图5),蛋白浓度为0.480mg/mL。
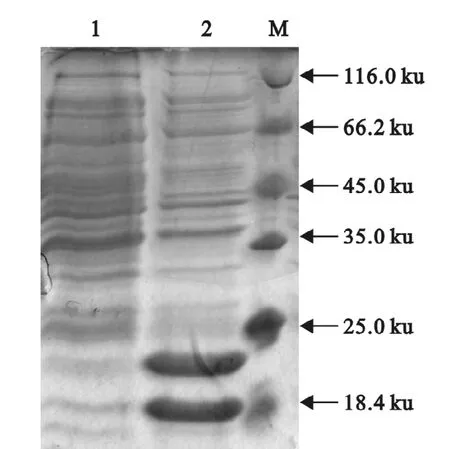
图3 SDS-PAGE检测诱导表达Fig.3 SDS-PAGE analysis of induced protein
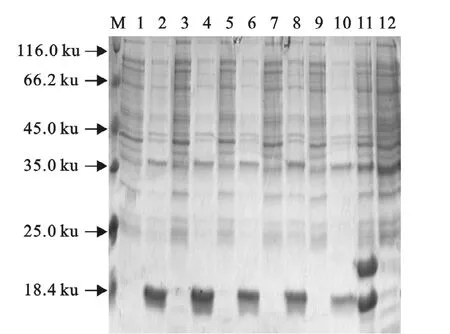
图4 SDS-PAGE检测包涵体Fig.4 SDS-PAGE analysis of inclusion bodies
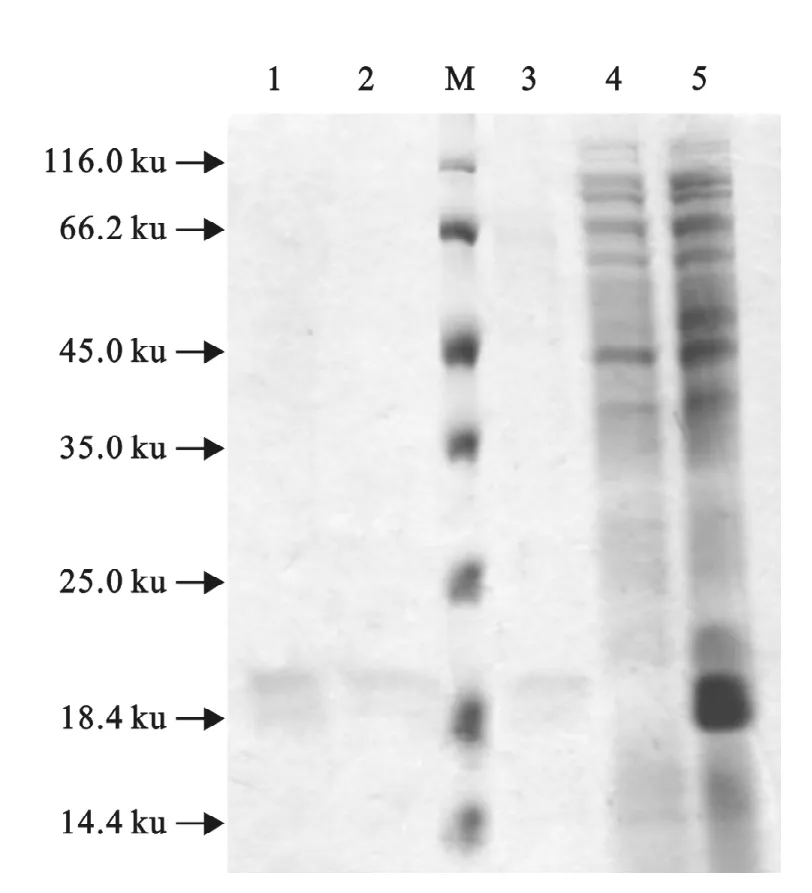
图5 纯化后以及复性后SDS-PAGEFig.5 SDS-PAGE analysis of renatured and purified protein
2.6 重组蛋白的质谱鉴定
将纯化后的蛋白进行质谱鉴定(图6),结果显示该蛋白与无乳链球菌Rib蛋白的相似性达到99.99%,确定获得的蛋白为正确的目的蛋白。
2.7 多克隆抗体的制备
利用间接ELISA测定多克隆抗体效价,结果显示多克隆抗体效价为1∶480000。
3 讨论
本研究选择了pET26b作为表达载体,该载体的多克隆位点上有一段融合表达标签(His-Tag),表达产物为His融合蛋白,方便后续的亲和凝胶纯化。此外,该载体还含有pelB信号肽序列,位于起始密码和目的基因之间,可以引导目的蛋白穿越细胞膜,使蛋白分泌到细胞膜和细胞壁之间的周质空间,减少形成包涵体的可能性。本试验在对表达的蛋白进行SDS-PAGE时有2个蛋白条带,我们推测分子质量较大的蛋白正是由于融合了pelB而形成的。虽然使用pET26b载体进行表达比较容易获得可溶性蛋白,但本试验的蛋白仍然形成了包涵体,经过变性复性才最终获得可溶蛋白。以上结果显示,pET26b表达载体并不适合可溶性Rib蛋白的表达。但是这并不妨碍这一蛋白作为疫苗或作为免疫检测靶标应用于后续研究。
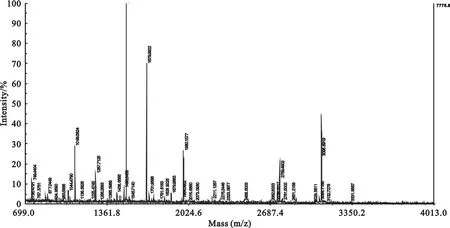
图6 Rib质谱鉴定Fig.6 Rib identification by MS
根据已有文献[6]报道,对Rib蛋白的鉴定显示它与α蛋白具有类似的结构及序列,它们都含有N端结构域和重复序列,经过比对发现,两种蛋白这两个区域的相似度分别达到61%和47%。因此通常把它们与另外两种结构相似的蛋白R28与Alp2同归为Alp(α-like protein)蛋白家族,但是这两种蛋白没有交叉免疫性。而且α蛋白主要存在于Ia、Ib以及Ⅱ型菌株中,在Ⅲ型中不存在此蛋白,而Rib蛋白是在Ⅲ型菌株中发现的,而且大多数表达α蛋白的菌株都不表达Rib蛋白[10]。可见,仅利用α蛋白作为疫苗虽然能够对多种血清型病原菌的感染产生免疫保护作用,但是仍然会遗漏部分菌株。因此,利用Alp蛋白作为疫苗应该将多种表面蛋白混合使用。本研究获得了Rib重组蛋白,为无乳链球菌全面保护性疫苗的开发奠定了良好的基础。
Gravekamp C等[11]通过动物试验发现重复序列会减弱整个蛋白的免疫反应,而且通过对Rib蛋白的结构域分析 (http://smart.embl-heidelberg.de)发现该蛋白N端结构域包含跨膜区,文献[12]显示该区域不仅与细菌的防御机制有关,而且与细菌毒性(包括黏附,侵染甚至诱发感染性休克)密切相关,根据这些研究推测N端结构域在刺激宿主免疫系统方面发挥重要作用,是一段理想的候选疫苗与免疫检测靶标。因此,本研究选择Rib的N端序列,一方面由于片段较短便于克隆、表达,另一方面,能够更好的保证蛋白的免疫原性。
[1]Forsman P,Tilsala-Timisjarvil A,Alatossava A.Identification of staphylococcal and streptococcal causes of bovine mastitis using 16S-23SrRNA spacer regions[J].Microbiology,1997,143(11):3491-3500.
[2]Riffon R,Sayasith K,Khalil H,et al.Development of a rapid and sensitive test for identification of major pathogens in bovine mastitis by PCR[J].J Clin Microbiol,2001,39(7):2584-2589.
[3]张继东,李淑芳,苑方重,等.奶牛乳房炎病原菌的分离鉴定和中药防治试验[J].中国兽医杂志,2006,42(11):32-33.
[4]金慧心,王 艳,张丹莹.关于无乳链球菌感染的新进展[J].黑龙江医学,1998(12):12.
[5]岳丽琴,周育森,张庶民,等.B族链球菌C5a肽酶表位的预测、分段表达及其免疫原性[J].中国生物制品学杂志,2010,23(5):460-465.
[6]Lindahl G,Stalhammar-Carlemalm M,Areschoug T.Surface proteins of Streptococcus agalactiae and related proteins in other bacterial pathogens[J].Clin Microbiol Revi,2005,18(1):102-127.
[7]Stalhammar-Carlemalm M,Stenberg L,Lindahl G.Protein Rib:a novel group B streptococcal cell surface protein that confers protective immunity and is expressed by most strains causing invasive infections[J].J Exp Med,1993,177(6):1593-1603.
[8]Areschoug T,Stalhammar-Carlemamm M,Larsson C,et al.Group B streptococcal surface proteins as targets for protective antibodies:identification of two novel proteins in strains of serotype V[J].Infect Immun,1999,67(12):6350-6357.
[9]清华大学.大肠杆菌菌体多克隆抗体及其制备方法与应用:中国,200610113827.9[P].2007-03-28.
[10]Larsson C,Stalhammar-Carlemalm M,Lindahl G.Protection against experimental infection with group B Streptococcus by immunization with a bivalent protein vaccine[J].Vaccine,1999,17(5):454-458.
[11]Gravekamp C,Kasper D L,Michel J L,et al.Immunogenicity and protective efficacy of the alpha C protein of group B streptococci are inversely related to the number of repeats[J].Infect.Immun,1997,65(12):5216-5221.
[12]Li J,Kasper D L,Ausubel F M,et al.Inactivation of the a C protein antigen gene,bca,by a novel shuttle/suicide vector results in attenuation of virulence and immunity in group B Streptococcus [J].Proc Natl Acad Sci,1997,94(24):13251-13256.

