检测犬源狂犬病毒中和抗体ELISA方法的建立
傅秋玲,郑佳琳,林颖仪,张 莹,阳佑天,潘姣姣,吴晓薇,郭霄峰
(华南农业大学兽医学院,广东广州510642)
狂犬病(Rabies)是由狂犬病病毒(Rabies virus,RV)引起的一种烈性人畜共患传染病,病死率几乎高达100%[1].犬和猫是我国人狂犬病的主要传染源,近年来,居民养犬数量不断增多,为了有效地预防和控制狂犬病,研发一种适合我国国情且又能准确快速地检测出狂犬病毒中和抗体的检测方法具有重要的意义[2].
目前,检测狂犬病免疫效果的国际通用方法主要包括 WHO推荐方法——快速荧光灶抑制试验(RFFIT)[3]和 OIE 推荐方法——荧光抗体病毒中和试验(FAVN)[4],这2种方法都具有特异性强、敏感性高且测出抗体效价即为中和抗体效价的优点.但这2种方法都需要活病毒和培养细胞,均存在检测时间长、对实验室条件要求高、操作技能要求高、操作繁琐及需要单份样品量多等缺点,鉴于此,ELISA检测法具有特异性好、敏感性高、快速便捷、廉价、可高通量检测等优点.因此构建不同的ELISA法倍受学者的亲睐.1978年,Atanasiu等[5]首次利用ELISA方法检测了狂犬病毒抗体,20世纪80年代,国外有许多学者成功建立了多种间接ELISA法检测人的狂犬病毒抗体水平[6-7].1988 年,Barton 等[8]首次利用间接ELISA方法检测犬源狂犬病毒血清.在此基础上,Mebastsion 等[9]和 Cliquet等[10]建立以酶标 SPA作为二抗的间接ELISA方法,这样就可以检测人和各种动物的 RV抗体水平.且周志军等[11]建立的ELISA法已成为检测不同种属RV抗体水平的商品化试剂盒,但其价格昂贵.国内目前广泛使用的ELISA法是以纯化的狂犬病毒、P蛋白或N蛋白作为检测抗原,其所测定的抗体效价并不代表具有保护效力的中和抗体水平[12-14].为了解决国内缺少一种简捷快速检测狂犬病毒中和抗体的问题,本试验以原核表达的狂犬病毒糖蛋白抗原优势表位区G3蛋白作为包被抗原建立了一种快速检测狂犬病毒中和抗体的ELISA方法,以期达到安全、有效地检测样品中的RV中和抗体效价.
1 材料与方法
1.1 材料
犬RV标准阳性血清和阴性血清由华南农业大学兽医学院微生物与免疫学教研室制备保存,重组质粒pET32a-RVG3、BL21菌株由华南农业大学兽医学院微生物与免疫学教研室保存,HRP标记的羊抗犬IgG为Santa Cruz公司产品,蛋白纯化HisTrap FF柱子为GE公司产品,可拆或不可拆酶标板为Castar公司产品,多功能酶标仪为Bio-Tec公司产品.其他试剂均为分析纯.
1.2 重组蛋白的表达及纯化
重组质粒pET32a-RVG3转化BL21感受态细胞16 h后,挑取多个单菌落于含Amp+(100 μg/mL)LB液体培养基中,37℃条件过夜培养.取上述培养菌按体积比1∶100比例接种于新鲜的含Amp+(100 μg/mL)2×YT培养液,优化的诱导条件按文献[15],SDS-PAGE检测重组蛋白表达情况.将表达量最高的重组BL21菌转接于400 mL三角锥瓶中,进行大量诱导表达.收集菌体,超声破碎后,经HisTrap FF纯化,重组蛋白于-80℃条件保存备用.SDSPAGE检测及Western-blot鉴定,紫外分光光度计测定蛋白浓度.
1.3 以G蛋白作为包被抗原建立检测RV中和抗体的间接ELISA方法
1.3.1 抗原包被质量浓度与血清稀释度的摸索
将纯化的RV G3重组蛋白作为包被抗原,用包被液(0.05 mol/L碳酸盐缓冲液,pH 9.6)将诊断抗原稀释成 16.0、10.0、8.0、6.0、4.0、2.0、1.0、0.5 mg/L,每孔加入100 μL,血清从1∶50、1∶100 稀释到 1∶200,组成方阵,进行间接ELISA,分光光度计测定D450nm值,阳性血清的 D450nm/阴性血清的 D450nm(记为DP/DN)最大时的抗原包被质量浓度和抗体稀释度为最佳的工作浓度.
1.3.2 酶标二抗工作浓度的优化 采用直接ELISA法,血清按最佳稀释度包被酶标板,4℃条件过夜,每孔100 μL;将 HRP标记的羊抗犬 IgG稀释成1∶1 000、1∶2 000、1∶3 000、1∶4 000、1∶6 000、1∶8 000后,每孔100 μL,37 ℃孵育1.5 h.
1.3.3 酶标二抗最佳作用时间的确定 在优化酶标二抗稀释度后,于37℃条件下分别作用30、40、60、90、120 min,用 RV 阳性血清、阴性血清进行检测,测定D450nm值,并分析DP/DN变化情况.
1.3.4 最佳封闭剂的确定 分别选用体积分数为10%的胎牛血清、1 kg/L的BSA、10 kg/L的脱脂奶粉、1 kg/L的明胶作为封闭剂,每孔250 μL,37℃条件封闭1.5 h.每份血清重复2孔,且将不加封闭剂作为对照孔.测定D450nm值,并分析DP/DN变化情况.
1.3.5 血清最佳孵育时间的确定 每孔加入100 μL最佳稀释度的血清,37℃条件分别孵育30、60、90、120 min,其他条件按以上确定的最优条件进行ELISA检测,根据结果确定最佳条件.
1.3.6 最佳显色时间的确定 按上述已确定的最优条件进行ELISA检测,每孔加入100 μL TMB单组分显色液,在室温黑暗条件下显色 5、10、15、20、25 min,其他条件按上述已优化的最佳条件,根据结果确定最佳时间.
1.3.7 批内重复性试验 用同一批制备的重组抗原包被的酶标板,随机取5份血清,每份血清做6孔重复,在同一时间同一条件下按照间接ELISA的程序进行检测,结果用统计学方法分析.
1.3.8 批间重复性试验 用同一批制备的重组蛋白包被酶标板,取5份抗体水平不同的RV血清,在4个不同时间按间接ELISA程序测定,每份血清做2个重复,结果进行统计学分析.
1.3.9 临界值及阴阳性标准的确定 取30份犬RV阴性血清按照已建立的间接ELISA方法进行检测,计算出阴性D450nm值的算术平均值(和标准差(S),从而确定临界值上限值(+3 S)和临界值下限值2 S).
1.3.10 敏感性试验 将RV血清作梯度稀释,ELISA方法进行检测,测定阳性检出的最大血清稀释度即为该检测方法的敏感性.
1.3.11 特异性试验 以犬RV阳性血清和阴性血清为对照,用已建立的间接ELISA检测犬细小病毒、犬瘟热病毒、犬腺病毒-1型的阳性血清,分析此方法的特异性.
1.3.12 临床样本检测 用已构建的ELISA方法与美国SYNBIOTICS狂犬病抗体检测试剂盒检测狂犬病疫苗免疫后不同时期的农村家犬血清样品134份进行比较,比较2次检测结果,以验证该方法的可靠性.
2 结果与分析
2.1 重组蛋白的表达及纯化
重组蛋白包涵体用8 mol/L尿素溶解和超声破碎,经HisTrap FF纯化后,进行SDS-PAGE电泳(图1)和Western-blot鉴定(图2).免疫印迹检测结果表明,重组蛋白能与OIE标准阳性血清发生特异性反应,说明重组蛋白有特异性反应,且成功地在原核系统里获得了正确的表达,具有良好的血清学反应活性.
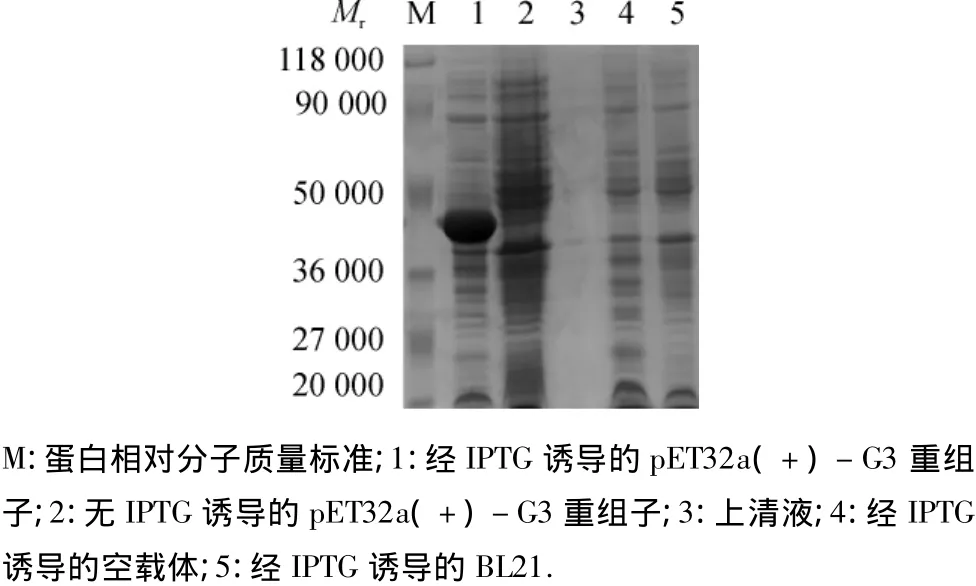
图1 重组蛋白表达的SDS-PAGE分析Fig.1 Analysis of the recombinant expression by SDS-PAGE

图2 重组蛋白的Western-blot结果Fig.2 The result of Western-blot
2.2 间接ELISA方法的建立
2.2.1 最佳抗原包被质量浓度和最佳血清稀释度的确定 通过棋盘法确定了最佳抗原包被质量浓度和最佳血清稀释度,结果见表1.由表1可知,抗原的最佳包被质量浓度为8.0 mg/L,血清的最佳稀释度为1∶100,此时的 D450nm接近1.0,且 DP/DN最大.
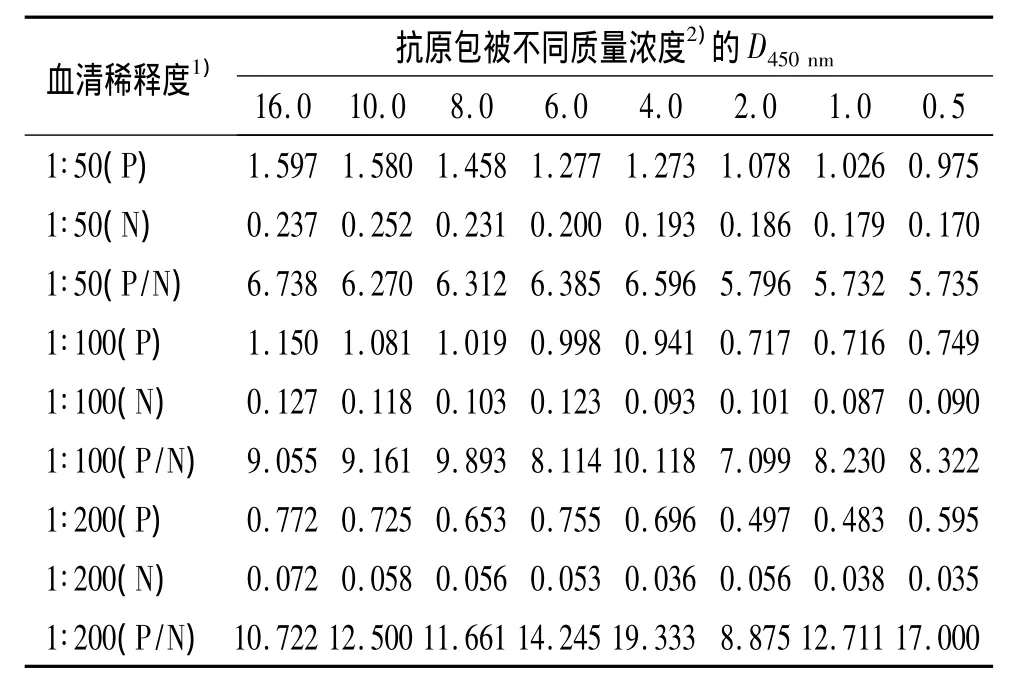
表1 最佳抗原包被质量浓度和最佳血清稀释度的检测结果Tab.1 Optimization for concentration of antigen and dilution of serum with indirect ELISA
2.2.2 酶标二抗工作浓度的优化 在最佳抗原和血清稀释度反应条件下,当酶标二抗的稀释度为1∶3 000时,D450nm接近1.0,且 DP/DN相对最大,故确定酶标二抗的工作浓度为1∶3 000(表2).

表2 酶标抗体最佳工作浓度的优化Tab.2 Optimization of optimal dilutions of enzyme labeled antibody
2.2.3 酶标二抗作用时间的摸索 由表3结果可知,当酶标二抗在37℃条件孵育60 min时,其DP/DN最大,故酶标二抗最佳作用时间为60 min.
2.2.4 最佳封闭剂的确定 体积分数为10%的胎牛血清、1 kg/L的BSA、10 kg/L的脱脂奶粉、1 kg/L的明胶作为封闭剂时的试验,结果(表4)显示,体积分数为10%的胎牛血清作为封闭剂时DP/DN最大,阳性血清D450nm在1.0左右.

表3 酶标抗体孵育时间的确定Tab.3 Determination of optimal incubation time of enzyme labeled antibody
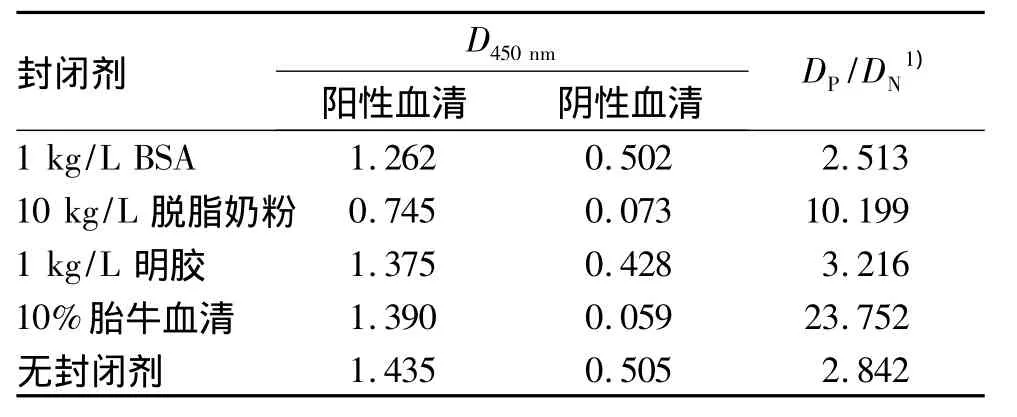
表4 不同封闭剂的筛选Tab.4 Optimization of blocking solutions
2.2.5 血清孵育时间的确定 由表5中数据可知,随着孵育时间的延长,阳性血清D450nm会增大,但其阴性的D450nm增加更快,故DP/DN反而降低,当37℃条件孵育30 min时,DP/DN最大(表5).

表5 血清最佳孵育时间的优化Tab.5 Determination of optimal incubation time of serum
2.2.6 最佳显色时间的确定 由表6可知,底物最佳作用条件为室温避光条件下作用20 min后,用2 mol/L H2SO4终止反应,即刻读数.
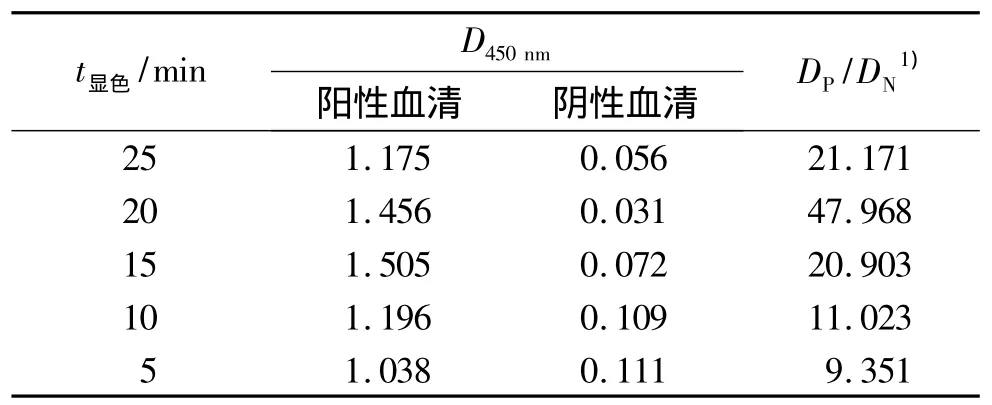
表6 底物最佳显色时间的确定Tab.6 Determination of reaction time of substrate
2.2.7 批内、批间重复性的评价 批内重复试验结果见表7.结果显示变异系数2.30% ~9.89%,小于10%,表明同一批抗原具有良好的稳定性,此方法批内重复性良好.批间重复试验结果(表7)表明,取5份血清在4个日期重复性试验结果统计学分析,其变异系数在5.40% ~8.22%,小于10%,说明此方法具有较好的重复性和稳定性.
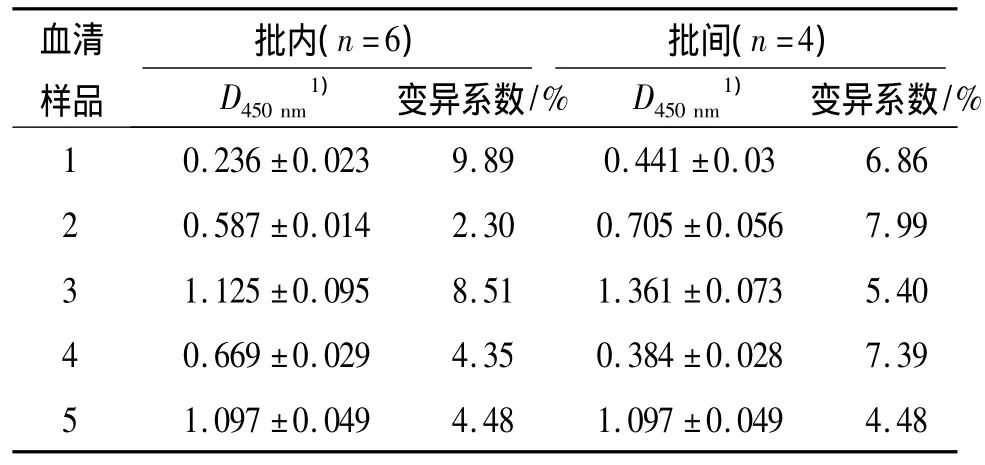
表7 批内误差和批间误差试验Tab.7 Intro-assay error and inter-assay test
2.2.8 临界值及阴阳性标准的确定 将由华南农业大学兽医学院微生物与免疫学教研室制备的经FAVN试验确定为狂犬病毒阴性血清的30份犬血清样品按照已建立的间接ELISA方法进行检测,计算出阴性D450nm的平均值 =0.097 4,S=0.059 5,置信区间0.216~0.276,根据间接 ELISA临界值判定标准,D450nm≥0.276时判断为阳性样本,D450nm≤0.216时判断为阴性样本,介于两者之间判定为可疑样本,进行重新检测.
2.2.9 特异性试验 犬细小病毒阳性血清、犬瘟热阳性血清和犬腺病毒-1型阳性血清检测均为阴性,表明此方法具有良好的特异性.
2.2.10 敏感性试验 对不同稀释度的RV阳性血清进行ELISA检测,稀释度为1∶2 560时,其DP/DN<2.1,其他的稀释度的DP/DN>2.1,因此其灵敏度为1∶1 280(表8).

表8 敏感性试验Tab.8 The sensitivity of indirect ELISA
2.2.11 临床样品的检测 用建立的间接ELISA方法检测136份血清样品,检测结果显示,有102份样品为阳性,34份为阴性.而用SYNBIOTICS试剂盒检测105份为阳性,31份为阴性,因此两者的阳性符合率为97.1%,阴性符合率为91.2%,总符合率为95.6%.说明2种方法具有良好的相关性.
3 讨论
狂犬病毒糖蛋白构成病毒粒子表面的棘状突起,是唯一诱导产生中和抗体的蛋白,其免疫作用与全病毒疫苗相当.膜外区决定狂犬病糖蛋白的抗原性、毒力及组织亲嗜性[15].因此本试验所用的检测抗原即是原核表达系统表达的糖蛋白100~300AA区段抗原表位区(G3),SDS-PAGE和免疫印迹试验验证了RV G3具有良好的免疫原性,可用于狂犬病的临床诊断和基础研究.
狂犬病是由狂犬病病毒引起的一种人兽共患的急性致死性中枢系统感染的传染病,感染后潜伏期一般较长,简单快速地检测免疫动物的中和抗体水平显得至关重要.中和抗体是判定免疫动物是否获得抵抗野毒攻击的重要标志[16].因此检测狂犬病毒抗体水平实质是检测出中和抗体效力.尽管目前国内已建立了多种检测狂犬病毒抗体的ELISA方法,而建立一种检测中和抗体的ELISA方法还处于摸索阶段.为了解决这个问题,本试验以重组G蛋白为检测抗原成功地建立了一种检测犬狂犬病毒抗体的ELISA法.此重组糖蛋白利用原核表达系统诱导表达,并通过优化密码子大大提高了其原核表达的蛋白量[15],这为构建ELISA法提供了足量的抗原物质.试验结果表明:此ELISA法批内、批间的变异系数都小于10%,说明其稳定性和重复性好,且敏感性高和特异性强(不与其他的犬源病毒血清反应).通过大量的临床样品检测验证了此ELISA法检测结果与SYNBIOTICS试剂盒的结果具有一致的相关性(r=95.6%).本试验建立的ELISA方法耗时短、操作简便、廉价,特别适合大批量血清样品的检测,克服了传统的中和试验存在耗时长、易散毒、操作繁琐和需要标准实验等不足,将为犬源狂犬病毒中和抗体检测提供简便快捷的检测方法.
[1]涂长春.我国狂犬病流行现状及原因[J].动物保健,2006(8):11-12.
[2]唐婕,李六金,陈铁桥.狂犬病研究动态[J].动物医学进展,2006,27(7):100-104.
[3]SMITH J S,YAGER P A,BAER G M.A rapid reproducible test for determining rabies neutralizing antibody[J].Bull World Health Organi,1973,48(5):535-541.
[4]CLIQUET F,AUBERT M,SAGNÉ L.Development of a fluorescent antibody virus neutralisation test(FAVN test)for the quantitation of rabies-neutralising antibody[J].J Immunol Methods,1998,212(1):79-87.
[5]ATANASIU P,PERRIN P.Micromethod for rabies antibody detection by immunoenzymatic assay with staphylococcus protein A(author’s transl)[J].Ann Microbiol,1979,130(2):257-268.
[6]NICHOLSON K G,PRESTAGE H.Enzyme-linked immunosorbent assay:a rapid reproducible test for the measurement of rabies antibody[J].J Med Virol,1982,9(1):43-49.
[7]GRASSI M,WANDELER A I,PETERHANS E.Enzymelinked immunosorbent assay for determination of antibodies to the envelope glycoprotein of rabies virus[J].J Clini Microbiol,1989,27(5):899-902.
[8]BARTON L D,CAMPBELL J B.Measurement of rabiesspecific antibodies in carnivores by an enzyme-linked immunosorbent assay[J].J Wildl Dis,1988,24(2):246-258.
[9]MEBATSION T,FROST J W,KRAUSS H.Enzyme-linked immunosorbent assay(ELISA)using staphylococcal protein A for the measurement of rabies antibody in various species[J].J Vet Medi:Series B,1989,36(7):532-536.
[10]CLIQUET F,SAGNé L,SCHEREFFER J L,et al.ELISA test for rabies antibody titration in orally vaccinated foxes sampled in the fields[J].Vaccine,2000,18(28):3272-3279.
[11]周志军,尹斌,朱华松,等.ELISA抗体检测试剂盒在狂犬病毒特免血浆筛选中的初步应用[J].微生物学免疫学进展,2005,33(2):45-48.
[12]杨文祥,徐国景,唐利军,等.犬狂犬病毒抗体ELISA检测方法的建立[J].公共卫生与预防医学,2007,18(2):5-8.
[13]高明华,夏咸柱,薛琳.狂犬病毒N基因的原核表达及间接ELISA方法的建立[J].中国人兽共患病学报,2007,23(1):31-34.
[14]赵刚,李刚,陈铁桥,等.狂犬病病毒P基因的原核表达及间接ELISA方法的应用[J].中国人兽共患病学报,2010,26(2):163-167.
[15]郑佳琳,江飙,郭霄峰.优化密码子以提高狂犬病病毒糖蛋白基因在原核细胞的表达[J].中国人兽共患病学报,2010,26(5):403-407.
[16]梁红茹,刘晓慧,陈晶,等.狂犬病毒新型快速荧光斑点抑制实验方法的建立[J].中国人兽共患病学报,2009,25(7):619-622.

