853例药品不良反应报告分析
张洁 赖剑锋 黄冰兰
(福建医科大学附属龙岩市第一医院药剂科,福建龙岩364000)
853例药品不良反应报告分析
张洁 赖剑锋 黄冰兰
(福建医科大学附属龙岩市第一医院药剂科,福建龙岩364000)
目的:总结我院2010年药品不良反应(ADR)监测情况,为安全用药提供参考。方法:对2010年经审核合格评价上报的853例ADR报告中涉及的药品种类进行分类、统计排名,重点分析新的、严重的ADR的发生情况及相关因素。结果:抗菌药物排名前3位的是阿奇霉素、左氧氟沙星、依诺沙星;中药制剂排名前3位是鹿瓜多肽注射液、舒血宁注射液、尿石通丸;营养药及生化制剂排名前3位的是复方氨基酸注射液(18F)、三磷酸腺苷二钠氯化镁注射液、水解蛋白。其中新的ADR 125例,严重ADR 27例。结论:应重视ADR的监测和上报工作,把安全用药放在合理用药第一位,减少新的、严重的ADR发生。
药品不良反应;监测;报告
近年来,药品安全问题越来越成为社会关注的焦点。 2011年7月新修订的《药品不良反应报告和监测管理办法》实施后,药品不良反应(ADR)监测工作无论从认知水平、接受程度、监管质量上都有了不同程度的提升。为促进临床安全用药,将我院2010年收集的报表,经审核评价上报的853例ADR报告进行分类排名,对存在的问题进行总结,重点分析新的、严重的ADR报告的发生情况及相关因素,为临床合理用药提供参考。
1 资料与方法
收集2010年我院临床各科室报送的ADR报表,由我院ADR监测室审核评价后上报国家ADR监测中心,依据《WHO药品不良反应术语集》[1]对ADR名称进行规范完善,涉及的药品均以通用名进行统计,并采用Excel软件对审核后评价上报的835例的ADR报告进行分类统计、排名及分析。
2 结果
2.1 ADR报表类型
见表1。
2.2 引发ADR排位前20位的药品 (未标明剂型的药品为注射剂型,下同)

表1 ADR报表类型构成
见表2。
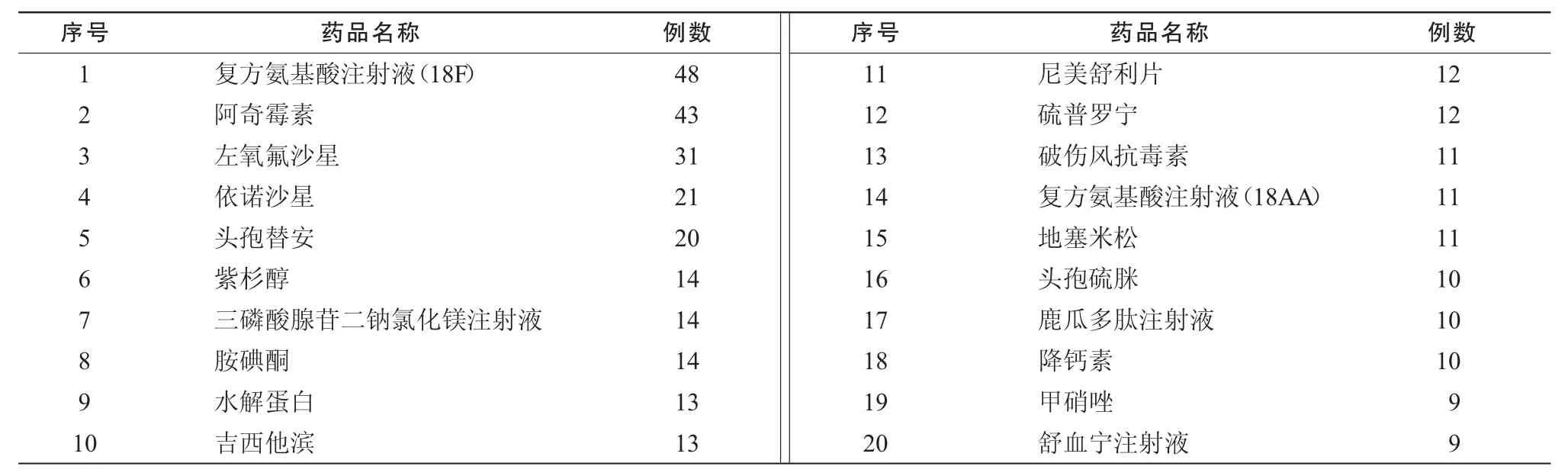
表2 ADR排位前20位的药品
2.3 引发ADR排位前10位的抗菌药物见表3。

表3 ADR排位前10位的抗菌药物及临床表现
2.4 引发ADR排位前10位中药制剂见表4。

表4 ADR排位前10位中药制剂及临床表现
2.5 引发 ADR排位前 10位营养药及生物、生化制剂
见表5。

表5 ADR排位前10位营养药、生物、生化制剂及临床表现
2.6 引发新的ADR排位前10位的药品见表6。

表6 引发新的ADR排位前10位的药品及临床表现
2.7 严重ADR临床表现及转归情况
2.7.1 香菇多糖致过敏性休克(1例) 1例慢性阻塞性肺疾病(COPD)患者,使用香菇多糖1mg+5%葡萄糖注射液100 mL,30滴/min滴速静滴,60 min后出现寒战、畏冷、发热、憋气、呼吸困难、面色苍白、紫绀、肌肉痉挛、全身乏力、焦急不安、心律紊乱、血压升高,经停药、吸氧,予以激素及抗过敏药对症处理后症状消失。探其病因得知:患者有青霉素、司帕沙星过敏史,ADR为第2次使用时发生。2.7.2胺碘酮致重度静脉炎(14例) 2010年9月上旬,临床科室反映使用胺碘酮ADR发生率为100%。经调查了解ADR为静脉炎,严重程度达Ⅲ级 (采用美国静脉输液护理会静脉炎程度判断标准)。主要症状:形状鼓起有大有小,大的像鸭蛋;部位上下肢均有;局部红肿热痛,肿胀范围长达30 cm,皮肤紧绷,静脉有条索状改变,可触及硬结,重度疼痛。发生时间多在维持量静滴时或静滴完 30 min内,多数集中在 2个批次(100401、100603)上。大部分患者应用片仔癀及硫酸镁湿敷药处理后得到缓解或症状消失。
2.7.3 硫普罗宁致过敏性休克(12例) 监测到12例硫普罗宁不良反应报告中,ADR发生时间,1 min内发生的有2例;1~10 min内6例;15~30 min内4例。临床症状主要有:皮疹、瘙痒、恶心、呕吐、畏冷、发热、头晕、头痛、焦急不安、憋气、呼吸困难、面色苍白、紫绀、视物模糊、潮红、喉头水肿等过敏样反应。经停药,予以吸氧、抗休克、抗过敏处理后,皮疹消退,症状逐渐消失。
3 结论与分析
3.1 ADR报告存在的主要问题
①字体过于潦草难以辨认;②表格填写不完整。如住院病历号、体重、联系电话、引发ADR药品的生产厂家、批号、用法用量、处置结果、用药目的、ADR发生时间等项目常见空缺。③概念不清。如药品通用名填写成商品名,药品批号填写成药品品种、生产日期或批准文号,生产厂家填写为药品配送企业。④不规范的ADR名称。如胃肠道反应、氨基酸反应。⑤ADR体征描述过于简单。如皮疹,未描述皮疹的类型、性质、部位、面积大小。肝功能、白细胞、血小板异常者,未写明用药前后的变化情况。⑥医疗处置描述过于笼统。如仅用停药或对症治疗概括,报表中没有记录其他治疗措施。⑦中成药用药原因填写混乱等等。
广大医务人员应予以充分重视,深层次地去观察和发现新的和严重的ADR,从质量上做好ADR监测工作,促进合理用药,保障人民群众用药安全。
3.2 严重ADR分析
3.2.1 香菇多糖 原因分析:①香菇多糖可能存在迟发性过敏反应。患者有青霉素和司帕沙星过敏史,其过敏体质能促使对药物反应的敏感性。②不能排除该批次香菇多糖成分纯度问题。中药注射剂受提纯工艺影响,所含成分比较复杂,内含的大分子有机物可刺激机体产生免疫应答或产生抗体导致发生过敏反应[2]。③原患疾病(COPD)的本身促使患者对药物反应敏感。该药物产生的过敏反应进一步加重了患者原有疾病的进展。
中药注射剂除了患者本身体质外,有效成分、辅料(如添加剂、增溶剂)、包括含其他物质(如动物蛋白质、鞣质)及药物本身的氧化、还原、分解、集合等所形成的杂质[3]是引发ADR因素外,临床中药注射剂联合用药现象,药物之间的相互作用也是导致ADR发生的重要原因[4]。另外,临床使用药证不符现象与目前药品标准中缺乏明确的中医辩证表述有关。中药注射剂应在中医理论的指导下,辩证施治,对症用药是关键。
3.2.2 胺碘酮
3.2.2.1 原因分析 ①用法用量因素:在5%葡萄糖溶液中,静脉滴注胺碘酮浓度>3 g/L时,增加外周静脉炎发生率[5]。②输注的浓度、给药的持续时间、pH值因素:静脉滴注时间超过1 h,浓度超过2 g/L,会引发静脉炎,高浓度胺碘酮外周静脉泵入20~ 30 h,静脉炎发生率最高[6]。超出血液正常 pH值(±7.4),无论过酸过碱,都可干扰血管内膜正常代谢和机能[7],引发静脉炎。③给药部位选择因素:下肢静脉给药,因静脉瓣多,血流缓慢(特别是老年患者静脉瓣功能减退),药液在血管内停留时间长,易形成静脉炎[8]。
3.2.2.2 使用时应注意 稀释液只能用5%的葡萄糖溶液,禁止采用生理盐水;首选中心静脉给药;负荷量泵推胺碘酮浓度不得>3 mg/mL,不得在同一注射器内与其他制剂混合,如需持续治疗,采用静脉滴注。
3.2.3 硫普罗宁 硫普罗宁不良反应发生相关因素较复杂,临床表现呈多样性,主要表现为过敏性休克。
3.2.3.1 原因分析 ①患者的性别及发生时间的关系:12例不良反应报告中,男性8例,女性4例,发生率男性明显高于女性,原因待于进一步考察。提示男性患者用药应慎重。12例不良反应均为静脉给药过程中发生。具体分布:用药后≤1min,2例;1~10 min,6例;15~30 min,4例。说明静脉给药时,在控制静脉滴注速度同时,应注意观察患者用药过程中的临床表现,尤其是初次使用前0.5 h内。②患者的体质与过敏史的关系:12例ADR报告中,多数无记载药物过敏史,这反映了临床应用时,对ADR史未给予重视。硫普罗宁是一种与青霉胺结构相似的含游离巯基甘氨酸衍生物,过敏反应多发生快,过敏机制为硫普罗宁抗原刺激免疫系统产生抗体,抗体附着在肥大细胞上,导致肥大细胞释放颗粒和介质,而发生各种过敏性休克症状[9]。③储存与保管因素:硫普罗宁的结构中含巯基,具强还原性,在室温及遇光、遇热情况下容易发生氧化反应,结构中的酰胺键容易水解[10]。
3.2.3.2 注意事项 尽量采用口服给药;年老、体弱患者慎用,有过敏史患者禁用;首次用药时,最好先皮试;严格掌握输液浓度(250~500 mL输液加硫普罗宁0.2 g为宜),缓慢滴速(20滴/min),静滴结束后观察 30 min[11];药房和病区对拆零药品妥善保管,注意遮光、密封、阴凉(不超过20℃)处保存。
从853例ADR报告统计数据上看,临床上易于观察的ADR上报数量较多,不易观察的及慢性的ADR上报率较少。ADR发生程度以一般为主,新的与严重的ADR合并构成比为17.8%,多数病例停药后或可用药物治愈或好转。药品安全风险仍主要集中在抗菌药物和中药注射剂上。因此,抗菌药物和中药注射剂是ADR监测的重点,也是临床合理用药应关注的重点。应重视ADR的监测和上报工作,加强医师、药师、护理人员之间的合作,不断提高ADR报告质量的可靠性、准确性和有效性[12],把安全用药放在合理用药首位,减少新的、严重的ADR发生。
[1]国家药品不良反应监测中心,国家食品药品监督管理局药品评价中心.WHO药品不良反应术语集[M].北京:中国医药科技出版社,2003:103-172.
[2]赖剑锋,张洁.我院221例中成药不良反应报告分析[J].中国药房,2011,22(43):4109-4111.
[3]吴世启,陶阳.我院419例药品不良反应/事件报告分析[J].中国执业药师,2011,8(3):3-6.
[4]邓增潮,梁增杰.72例中药注射剂的不良反应分析[J].中国药物应用与监测,2005,2(1):30-31.
[5]田金萍.静脉注射可达龙治疗顽固性室性心动过速和心室颤动的护理[J].南京医科大学学报(自然科学版),2002,22(6):540.
[6]李纬,张俊,乔燕舞,等.高浓度胺碘酮静脉泵入与静脉炎关系的临床研究[J].心血管康复医学杂志,2004,13(6):594-595.
[7]陈连剑,郭华.输液pH值对与其配伍的注射药物的影响[J].广东药学,1999,9(1):39-40.
[8]梁晶.外周静脉泵入胺碘酮不同给药方式对静脉炎发生不同影响的观察[J].中国现代医药杂志,2007,9(12):110-111.
[9]丁小丽,雷招宝.硫普罗宁致过敏性休克38例文献分析[J].药物不良反应杂志,2005,(5):336-339.
[10]曹永红.硫普罗宁不良反应分析 [J].中国医院药学杂,2006,26(8):1047-1049.
[11]范敏勇,雷招宝.硫普罗宁的不良反应[J].中国药师,2005,8(9):786-787.
[12]郑红毅,周霞,易太友.我院药品不良反应/事件报告质量分析[J].中国执业药师,2011,8(5):10-12.
The Analysis of 853 Cases of Adverse Drug Reaction Reports
Zhang Jie,Lai Jianfeng,Huang Binglan(Pharmacy Department of the First Hospital of Longyan Affiliated to Fujian Medical University,Fujian Longyan 364000,China)
Objective:To review the situation of adverse drug reaction(ADR)monitoring in our hospital in 2010 so as to provide a reference for clinical safe medication.Methods:The categories of the drugs involved in 853 ADR cases were classified,counted and ranked.Emphasis was placed on the occurrence and relevant factors of new and severe ADRs. Results:The top three antimicrobial drugs were azithromycin,levofloxacin and enoxacin.The top three Chinese herbal preparations were cervus and cucumis polypeptide injection,ginkgo biloba extract injection and virustatic pills.The top three nutrition medicines and biochemical preparations were compound amino acid injection(18F),adenosine disodium triphosphate and magnesium chloride for injection and proteine hydrolysate.Among them,there were 125 new ADR cases and 27 severe ADR cases in total.Conclusion:ADR monitoring and reporting should be strengthened and safe medication should be put in the first place in rational drug use so as to reduce the incidence of new and serious ADRs.
Adverse Drug Reactions;Monitoring;Report
10.3969/j.issn.1672-5433.2012.10.003
2012-04-10)
张洁,女,副主任药师。研究方向,中药学。通讯作者E-mail:rujie88@163.com赖剑锋,男,主管中药师。研究方向:医院药学。

