P物质和降钙素基因相关肽在骨癌痛-吗啡耐受模型中的表达
司马蕾 厉建春 蔡淑呈 刘波涛 樊碧发
卫生部中日友好医院全国疼痛诊疗研究中心,北京 100029
P物质和降钙素基因相关肽在骨癌痛-吗啡耐受模型中的表达
司马蕾 厉建春 蔡淑呈 刘波涛 樊碧发
卫生部中日友好医院全国疼痛诊疗研究中心,北京 100029
背景与目的:多数晚期癌症患者会经历中重度癌痛折磨。阿片药物是癌痛治疗最常用和最有效的药物,但长时间使用容易造成耐受甚至痛觉过敏。P物质(substance P,SP)和降钙素基因相关肽(calcitonin gene-related peptide,CGRP)是疼痛信号传递中最重要的神经递质,但在癌痛-阿片耐受中的表达尚不清楚。本研究拟在骨癌痛-吗啡耐受大鼠模型上,探讨SP和CGRP在背根神经节(dorsal root ganglion,DRG)水平的表达特点。方法:60只Wistar大鼠鞘内置管成功后,随机分为3组:假手术组、吗啡耐受组和骨癌痛-吗啡耐受组。吗啡耐受组和骨癌痛-吗啡耐受组分别以热灭活Walker256乳腺癌细胞和Walker256乳腺癌细胞制备胫骨癌痛模型,接种后10 d时鞘内注射吗啡20 μg/kg。动物行为学测试使用Von Frey纤维丝,于不同时间点测定机械刺激引起的机械缩足阈值。研究结束时,免疫组织化学分析DGR中SP和CGRP的表达,测定积分光密度IOD值。结果:行为学证实,吗啡耐受组和骨癌痛-吗啡耐受组在吗啡治疗第5天时出现耐受,骨癌痛-吗啡耐受组缩足阈值较吗啡耐受组和对照组明显降低(P<0.001)。骨癌痛-吗啡耐受组SP和CGRP积分光密度值IOD(9 917.9±2 246.1和15 021.5±2 989.7)较吗啡耐受组(5 191.7±1 052.6和9 737.1±2 239.8)和对照组(4 821.6±843.1和8 180.3±1 242.2)明显增加(P<0.001)。结论:SP和CGRP在癌痛-吗啡耐受大鼠模型DRG中表达增强,提示这两种神经递质参与了耐受产生,这将为新药治疗癌痛-吗啡耐受提供更符合临床的科学依据。
P物质;降钙素基因相关肽;吗啡耐受;骨癌痛
最新统计表明,目前全球每年新增癌症患者1 270万,每年癌症死亡人数760万[1],56%晚期患者经历至少1个月的中重度癌痛折磨[2]。阿片药物是癌痛治疗最常用和最有效的药物,但长时间或大剂量使用容易造成耐受甚至痛觉过敏[3-4]。由于目前尚没有比阿片更有效的镇痛药物,阿片耐受成为癌痛治疗中最亟待解决的问题。
背根神经节(dorsal root ganglion,DRG)是感觉神经传入的第一级神经元,其中的中等细胞和小细胞分别发出Aδ和C神经纤维,介导疼痛传导。P物质(substance P,SP)和降钙素基因相关肽(calcitonin-gene related peptide,CGRP)是疼痛传导过程中最重要的神经递质。阿片药物发挥镇痛作用的机制是减少SP和CGRP等神经递质自Aδ和C神经纤维末梢的突触前膜向突触间隙的释放[5]。疼痛神经递质在阿片耐受中的表达变化尚不十分清楚,直接影响了耐受的治疗。
药理学定义耐受是指连续用药产生的药物反应性降低。本研究拟在高度模拟临床病理的骨癌痛大鼠模型上,以最常使用的吗啡为阿片药物代表,探讨神经递质SP和CGRP在癌痛-吗啡耐受模型中的表达变化。
1 材料和方法
1.1 实验动物与分组
Wistar大鼠雌性60只(北京维通利华动物实验中心提供),SPF(specific pathogen free condition)级,合格证号SCXK9(京)2007-0001,体质量约(210±20) g。参照张亚军等[6]介绍的方法进行动物造模。腰3~腰4间隙穿刺,鞘内置入PE-10导管,置管后24 h无运动障碍的大鼠,经导管注射2%利多卡因10 mL,30 s内大鼠发生双后肢麻痹,表明鞘内置管成功。置管后5 d进行分组处理。分组采用随机数字表法,将鞘内置管成功的60只大鼠随机分为3组:假手术组、吗啡耐受组和骨癌痛-吗啡耐受组,每组20只。
1.2 骨癌痛模型的制备及吗啡给药
Walker256乳腺癌细胞购自协和医科大学肿瘤研究所。取雌性幼鼠2只,体质量60~80 g,日龄21 d,腹腔注射癌细胞0.5 mL(细胞浓度为4×104/μL),7 d时收集腹水,以无菌0.01 mol/L PBS漂洗细胞3次,细胞浓度调整至4×102/μL的浓度备用。在水中煮沸10 min制备热灭活的癌细胞备用。吗啡耐受组和骨癌痛-吗啡耐受组参照文献[7]介绍的方法制备胫骨癌痛模型,骨癌痛-吗啡耐受组右侧胫骨上段骨髓腔注入Walker256乳腺癌细胞10 μL,吗啡耐受组注射热灭活的Walker256癌细胞10 μL,假手术组仅暴露右侧胫骨上段。接种后10 d时吗啡耐受组和骨癌痛-吗啡耐受组鞘内注射吗啡2 0 μ g/k g(购自沈阳第一制药厂,批号H21022436),吗啡用0.9%NaCl溶液稀释至100 μL,假手术组给予等容量0.9%NaCl溶液,每天2次(8:00 A.m.和6:00 P.m.),连续9 d。
1.3 机械痛阈测定
吗啡耐受与神经病理性疼痛的痛行为学表现相似,其机制均与中枢敏化有关,痛觉过敏是慢性神经病理性疼痛的主要行为学特征,痛阈较基础值明显降低提示出现痛觉过敏[8]。本研究采用up and down方法[9]连续测定机械痛阈,将大鼠置于金属网上,盖以透明的有机玻璃罩,先让大鼠适应环境15 min,待梳理探究活动基本消失后,用一系列标准化的Von Frey纤维丝(购自美国North Coast Medical公司)刺激右后肢足底中心部位。刺激从2 g开始,最大力度15 g,根据公式推算出50%缩足阈值(50% paw withdrawal threshold,50%PWT)。测定时间分别是接种癌细胞前(T0),癌细胞接种第l、3、6、9天(T1、T3、T6、T9)、给予吗啡第1、3、5、7、9天(M1、M3、M5、M7、M9),每次于16时左右进行测定,共10次。
1.4 骨质破坏检查
接种后分别于第1 、9 、15 天(T1、T9、T15)行为学测定后,采用500 mA X线机(购自德国Simens公司)行右后肢放射学检查,进行骨质破坏检查。
1.5 免疫组织化学检测DGR中SP和CGRP积分光密度(integral optical density,IOD)
选择M9时行为学测试完毕后,将大鼠在深麻醉下快速断头取一侧L4-L5 DRG,置于4%浓度的多聚甲醛磷酸盐缓冲液固定,脱水,石蜡包埋,沿纵轴取最大纵切面连续切片20张,片厚约6 μm。多克隆兔抗CGRP抗体(1∶500,DAKO)4 ℃温育24 h,滴加二抗室温温育4 h,DAB显色20 min。多克隆兔抗体SP一抗(1∶5 000,DAKO)温育24 h,通用型二抗(DAKO)室温温育2.5 h,DAB显色2 min。BX51正置光学显微镜(Olympus)下每张切片随机取5个视野,采用Image Pro-Plus 5.0图像分析软件半定量测定SP和CGRP的IOD。
1.6 统计学处理
数据的处理、作图、统计学分析等运用Microsoft Exce1 2000、SPSS 10.0软件进行。数据以表示,两组间差异应用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 骨癌痛-吗啡耐受模型机械痛阈变化
动物行为学证实,骨癌痛-吗啡耐受组接种癌细胞第6天出现明显痛阈降低(与假手术组和吗啡耐受组比较,P<0.001),给予吗啡治疗后疼痛立即缓解,50%PWT增高。吗啡耐受组和骨癌痛-吗啡耐受组在吗啡治疗第5天时出现耐受,骨癌痛-吗啡耐受组较吗啡耐受组50%PWT下降更显著(P<0.001,图1)。
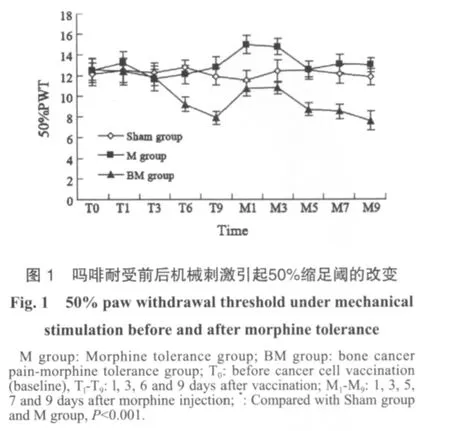
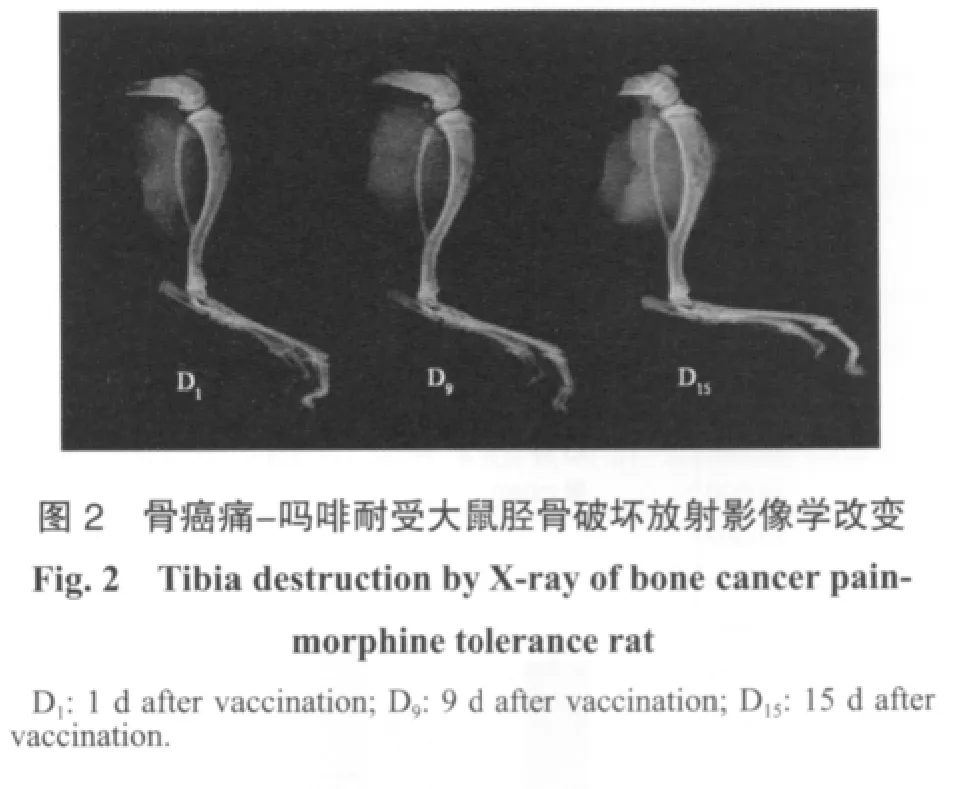
2.2 骨癌痛-吗啡耐受模型骨质破坏
放射影像学结果显示:癌痛-吗啡耐受组大鼠胫骨破坏存在,且呈动态进展。癌细胞接种9 d后出现骨皮质与骨小梁分离,15 d后肿胀破坏更为明显(图2)。
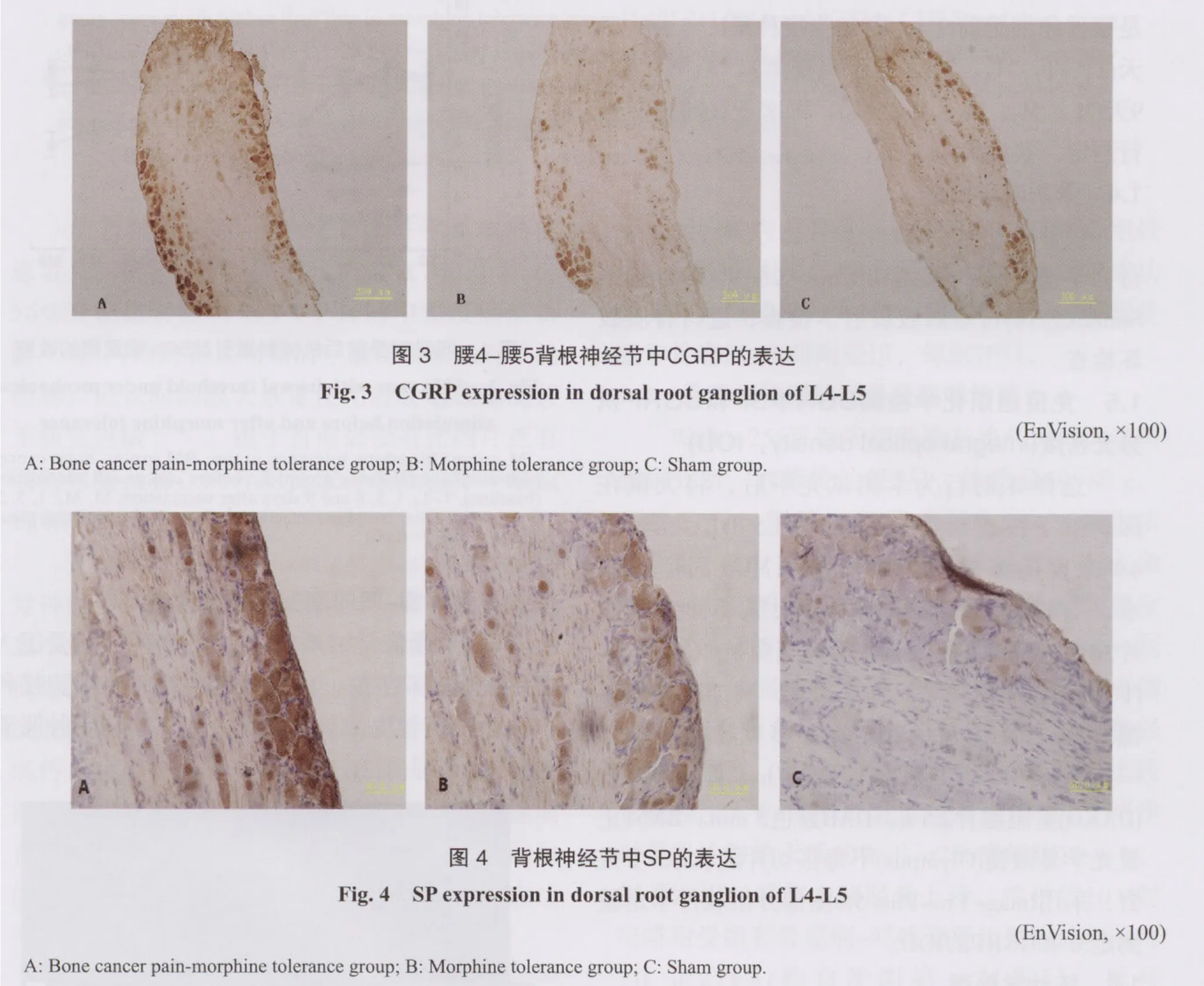
2.3 骨癌痛-吗啡耐受模型CGRP和SP表达变化
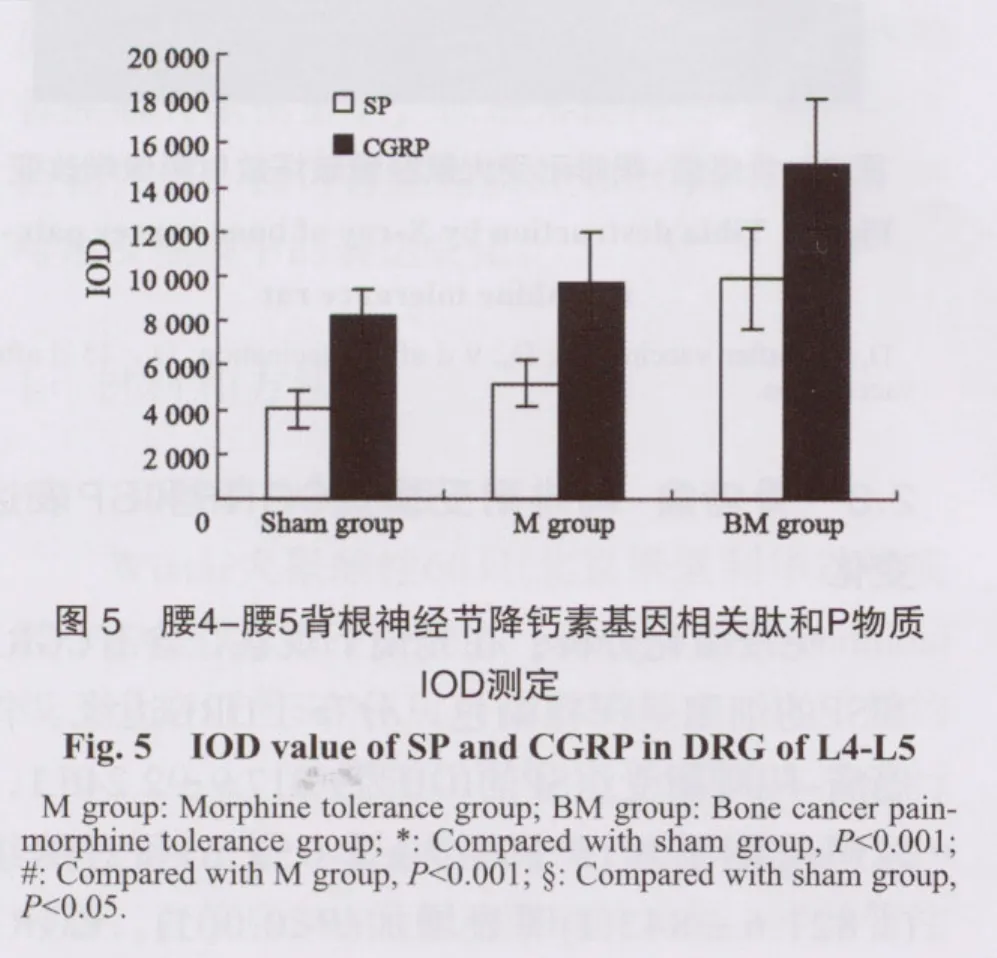
免疫组化分析:在光镜下观察,含有CGRP和SP的细胞呈深棕染色,分布于DRG边缘。骨癌痛-吗啡耐受组SP的IOD为9 917.9±2 246.1,较吗啡耐受组(5 191.7±1 052.6)和对照组(4 821.6±843.1)明显增加(P<0.001)。CGRP的IOD为15 021.5±2 989.7,较吗啡耐受组(9 737.1±2 239.8)和对照组(8 180.3±1 242.2)明显增加(P<0.001)。吗啡耐受组SP和CGRP与对照组相比也分别有所增加(P<0.05,图3、4、5)。
3 讨 论
目前国内外关于阿片耐受的研究几乎全部基于单纯吗啡耐受动物模型,并非以癌痛病理状态为基础,与临床状况并不相符。研究证明,炎性痛模型并不易产生吗啡耐受[10]。骨癌痛是临床最常见和最顽固的癌痛类型,骨癌痛的大鼠模型能够高度模拟临床病理,是癌痛研究的理想模型。吗啡是最常使用的阿片药物,对阿片耐受的研究多以吗啡耐受为代表。
本研究在骨癌痛-吗啡耐受大鼠模型上证实,鞘内连续用吗啡5 d后大鼠出现机械痛阈增高,痛觉过敏,说明癌痛容易产生吗啡耐受,这与临床的现状是一致的[4]。癌痛-吗啡耐受发生的时间点与单纯吗啡耐受相似,同时由于骨癌痛本身剧烈疼痛特征,其机械刺激痛阈较单纯吗啡耐受组更低。
本研究免疫组化结果显示,吗啡耐受和骨癌痛-吗啡耐受大鼠DRG中SP和CGRP阳性胞体数目增多和染色加深,IOD值明显升高,说明SP和CGRP参与了吗啡耐受的产生。而Thomson等[11]指出吗啡耐受大鼠脊髓背角SP免疫活性降低,可能疼痛递质在脊髓背角(中枢神经)和DRG(周围神经)变化不尽相同。当疼痛刺激或长时间的吗啡处理,SP和CGRP在DRG水平释放发生适应性增加,可能与delta阿片受体激活后插入细胞表面引发疼痛介质大量合成释放有关[12-13],与本研究结论一致。随着致痛物质神经递质从突触前膜向突出间隙的释放增多,吗啡的镇痛效果被减弱,出现痛觉过敏等动物行为学改变。本研究不但证实吗啡耐受较对照组大鼠疼痛递质DRG表达增加,还证实骨癌痛-吗啡耐受较吗啡耐受大鼠增加更为明显,说明骨癌痛本身可能也会增加疼痛递质的释放,当吗啡形成耐受后,不足以抑制疼痛递质的过度释放,因而难以发挥有效镇痛作用。
在体外细胞实验中发现,慢性吗啡处理引起CGRP免疫反应性增加,应用CGRP受体拮抗剂CGRP8-37可以阻止这种现象的出现[14]。对已经发生耐受的动物,CGRP受体拮抗剂也可以部分恢复脊髓吗啡的镇痛作用。SP以相似的方式调节脊髓的吗啡耐受[15]:慢性吗啡处理造成背角SP免疫反应性增加,NKl受体拮抗剂SRl40333可以抑制并逆转吗啡耐受。这些研究提示可以在癌痛-吗啡耐受大鼠体内进行CGRP或SP受体拮抗剂的相关研究。
需要注意的是,由于骨癌痛本身病程进展,因此骨癌痛-吗啡耐受模型中,机械痛阈的下降或是疼痛神经递质的过度表达,不但与吗啡耐受相关,还可能与疾病本身进展相关。如何将混杂的两个影响因素加以区别是一个难题,也是我们下一步研究的方向。
[1]JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]BREIVIK H, CHEMY N, COLLETT B, et al. Cancer-related pain: a pan-European survey of prevalence, treatment, and patient attitudes [J]. Ann Oncol, 2009, 20(8): 1420-1433.
[3]MARTIN S, ANGST J, CLARK D. Opioid-induced hyperalgesia [J]. Anesthesiology, 2006, 104(3): 570-587.
[4]MERCADANTE S, PORTENOY R K. Opioid poorlyresponsive cancer pain. Part 1: clinical considerations [J].J Pain Symptom Manage, 2001, 21(2): 144-150.
[5]韩济生. 神经科学[M]. 第3版. 北京: 北京大学医学出版社, 2009: 637-638.
[6]张亚军, 田玉科, 杨承祥, 等. 大鼠骨癌痛-慢性吗啡耐受模型的建立 [J]. 中华麻醉学杂志, 2011, 31(1): 63-66.
[7]李晓青, 孙玉明, 黄章翔, 等. Walker256乳腺癌细胞构建大鼠胫骨癌痛模型 [J]. 中国肿瘸生物治疗杂志, 2008,15(1): 41-45.
[8]DECOSTERD I, WOOLF C J. Spared nerve injury: an animal model of persistent peripheral neuropathic pain [J]. Pain,2000, 87(2): 149-158.
[9]CHAPLAN S R, BACH F W, POGREL J W, et a1.Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994, 53(1): 55-63.
[10]ZOLLNER C, MOUSA S A, FISCHER O, et al. Chronic morphine use does not induce peripheral tolerance in a rat model of inflammatory pain [J]. J Clin Invest, 2008, 118(3):1065-1073.
[11]THOMSON L M, TERMAN G W, ZENG J, et al. Decreased substance P and NK1 receptor immunoreactivity and function in the spinal cord dorsal horn of morphine-treated neonatal rats [J]. J Pain, 2008, 9(1): 11-19.
[12]BAO L, JIN S X, ZHANG C, et al. Activation of delta opioid receptors induces receptor insertion and neuropeptides secretion [J]. Neuron, 2003, 37(l): 121-133.
[13]MA W, ZHENG W H, KAR S, et a1. Morphine treatment induced calcitonin gene-related peptide and substance P increases in cultured dorsal root ganglion neurons [J].Neuroscience, 2000, 99(3): 529-539.
[14]POWELL K J, MA W, SUTAK M, et a1. Blockade and reversal of spinal morphine tolerance by peptide and non-peptide calcitonin gene-related peptide receptor antagonists [J]. Br J Phamacol, 2000, 131(5): 875-884.
[15]POWELL K J, QUIRION R, JHAMANDAS K. Inhibition of neurokinin-1-substance P receptor and prostanoid activity prevents and reverses the development of morphine tolerance in vivo and the morphine-induced increase in CGRP expression in cultured dorsal root ganglion neurons [J]. Eur J Neurosci, 2003, 18(6): 1572-1583.
Expression of substance P and calcitonin gene-related peptide in bone cancer pain-morphine tolerance rat model
SI-MA Lei, LI Jian-chun, CAI Shu-cheng, LIU Bo-tao, FAN Bi-fa(National Pain Management and Research Center, China-Japan Friendship Hospital, Beijing 100029,China)
SI-MA Lei E-mail:simalei@yahoo.cn
Background and purpose:More than half of the advanced cancer patients suffer from severe pain. Opioid is the overwhelming drug in cancer pain management. But repeated exposure to opioids can lead to tolerance and hyperalgesia. Substance P (SP) and calcitonin gene-related peptide (CGRP) are the key neurotransmitters in pain signaling pathway. The expression of neurotransmitter has been widely investigated in many pain models but poorly explored in cancer pain-opioid tolerance model. This research is to investigate SP and CGRP expression characteristics at dorsal root ganglion (DRG) level in the development of bone cancer pain-morphine tolerance of rat model.Methods:Sixty Wistar rats with successful intrathecal lidocaine were randomly divided into 3 groups (n=20 each): sham group, morphine tolerance group and bone cancer pain-morphine tolerance group. Bone cancer pain were induced by intra-tibia inoculation of Walker256 mammary gland carcinoma cells in bone cancer pain-morphine tolerance group, while in morphine tolerance group heat-inactivated Walkore256 mammary gland carcinoma cells were given instead. Morphine 20 μg/kg was administered intrathecally twice a day for 9 consecutive days 10 days later. The mechanical paw withdrawal threshold (PWT) was measured before inoculation, at day 1, 3, 6 and 9 after inoculation,and at day l, 3, 5, 7 and 9 of morphine administration. The rats were sacrificed after stopping the last stimulus. DRG of L4-L5 segment was isolated to determine the SP-immunoreactivity and CGRP-immunoreactivity expression.Results:PWT was significantly decreased in bone cancer pain-morphine tolerance group 5 days after morphine intrathecal compared with sham group and morphine tolerance group (P<0.001). The IOD values of SP and CGRP(9 917.9±2 246.1 and 15 021.5±2 989.7) by immunohistochemical methods in bone cancer pain-morphine tolerance group were much higher than that in morphine tolerance group (5 191.7±1 052.6 and 9 737.1±2 239.8) and sham group(4 821.6±843.1 and 8 180.3±1 242.2,P<0.001, respectively).Conclusion:It suggests that SP and CGRP may play an important role in morphine antinociceptive tolerance by up-regulation in DRG. This research would provide more scientific evidence of new strategy for inhibiting morphine tolerance in cancer pain.
Substance P; Calcitonin gene-related peptide; Morphine tolerance; Bone cancer pain
10.3969/j.issn.1007-3969.2012.08.001
R738.1
A
1007-3639(2012)08-0561-05
司马蕾 E-mail:simalei@yahoo.cn
2012-03-05
2012-05-16)
