水泡性口炎病毒双抗体夹心ELISA检测方法的建立
孙秀萍,宋晗星,苏高莉,周 平,何 叶,王 丽,潘 伟,丁 宁,包英夫,孙 晨,宋德光
(1.吉林大学畜牧兽医学院,吉林 长春 130062;2.吉林大学白求恩医学院,吉林 长春 130021)
水泡性口炎病毒(Vesicular stomatitis virus,VSV)属于弹状病毒科水泡病毒属的成员,为具有囊膜的单股负链RNA病毒。水泡性口炎是由VSV引起的一种高度接触性传染病,主要以在感染动物的口腔、舌、唇、乳头和蹄冠部上皮等部位皮肤/黏膜发生水泡为特征[1]。VSV以节肢动物为传播媒介,可以感染啮齿类动物及牛、猪、马等多种动物[2]。人也可以偶尔感染VSV,引起类似急性流感样的症状[3]。其临床症状与口蹄疫(FMD)、猪水泡病(SVD)等极为相似,在兽医临床上容易被误诊。近年来,该病也有在我国自然发生的报道[4],给畜牧业造成严重的经济损失。
目前,常见的VSV检测方法主要有病毒分离鉴定、血清中和试验[5]、补体结合试验和RT-PCR[6-7]等方法,但这些检测方法大多成本较高,并且需要一些特殊仪器设备,不适合基层现场检验工作的需要。因此,研制一种操作简单、使用方便快捷的VSV检测方法对于现地应用十分必要。本研究在前期VSV单克隆抗体(MAb)制备的基础上,采用纯化的抗原制备了兔抗VSV多克隆抗体,通过对捕获抗体和检测抗体的筛选,建立了一种简便、快速、特异的VSV双抗体夹心ELISA检测方法,为VSV的血清学快速检测和流行病学调查提供技术保障。
1 材料和方法
1.1 病毒与细胞株 水泡性口炎病毒(VSV-IND)、猪水泡病病毒(SVDV)、猪水疱疹病毒(VESV)、羊传染性脓疱病毒(ORFV/JL/08/CC)、BHK-21细胞、VSV MAb杂交瘤细胞株1A2(识别VSV结构蛋白的G蛋白)由吉林大学畜牧兽医学院病理实验室保存。
1.2 主要试剂 HRP标记的羊抗小鼠IgG(HRP-IgG)和羊抗兔HRP-IgG购自北京博奥森生物技术有限公司;TMB显色液购自天根生化科技(北京)有限公司;牛血清白蛋白(BSA)购自美国Sigma公司。
1.3 病毒的纯化 将VSV接种于BHK-21单层细胞,细胞病变(CPE)达80%以上时收获病毒,反复冻融3次后,3000 r/min离心30 min,除去细胞碎片;再经5000 r/min离心30 min,取上清以30000 r/min 4℃离心3 h,弃上清,将沉淀用少量PBS充分悬浮,获得粗提病毒,测其浓度及毒力并分装保存于-80℃备用。
1.4 MAb的制备及纯化 将本实验室保存的VSV MAb杂交瘤细胞株1A2按常规方法复苏后制备小鼠腹水;采用辛酸-饱和硫酸铵法对制备的腹水进行纯化;并用已建立的间接ELISA方法对其进行抗体效价检测;用紫外分光光度计测量蛋白浓度。
1.5 兔抗VSV多克隆抗体的制备及纯化 将纯化的病毒稀释至1.5 mg/mL,58℃30 min灭活后与等量的弗氏完全佐剂乳化,背部皮下多点注射清洁级大耳白兔,每只注射1 mL;两周后用VSV加弗氏不完全佐剂皮下多点注射加强免疫两次,剂量与初次免疫相同,每次间隔两周;最后一次免疫后第15 d,兔颈动脉放血分离血清,采用辛酸-饱和硫酸铵法对其纯化,用间接ELISA方法检测其抗体效价,同时用紫外分光光度计测其浓度。
1.6 双抗体夹心ELISA检测方法的建立
1.6.1 双抗体夹心ELISA基本试验步骤 以纯化的MAb包被酶标板,4℃过夜,PBST洗板3次,每次5 min;37℃封闭90 min,洗板;加入待检样品,37℃反应1 h,洗板;加入第二抗体,37℃反应1 h,洗板;加羊抗兔HRP-IgG,37℃反应45 min,洗板;加入TMB显色液,37℃避光显色;加入终止液,终止反应;测定OD450nm值并观察和判读结果。
1.6.2 捕获抗体和检测抗体的确定 分别以MAb 1A2为捕获抗体包被酶标板,以兔抗VSV的多克隆抗体为检测抗体建立双抗体夹心ELISA方法;以兔抗VSV多克隆抗体为捕获抗体包被酶标板,以MAb 1A2为检测抗体建立双抗体夹心ELISA方法。
1.6.3 捕获抗体和检测抗体最佳工作浓度的确定采用方阵滴定法确定捕获抗体和检测抗体的最佳工作浓度。将捕获抗体做1∶100倍比稀释后包被96孔酶标板,检测VSV标准株;将检测抗体做1∶100倍比稀释后加到酶标板中进行检测。
1.6.4 双抗体夹心ELISA检测条件的优化
1.6.4.1 最佳包被条件的确定:用0.05 mol/L碳酸盐稀释包被抗体,包被时间分别为37℃2 h、4℃12 h、4℃12 h并37℃ 2 h,在相同条件下,进行双抗体夹心ELISA试验,确定最佳包被条件。
1.6.4.2 抗原最佳作用时间的确定:在鼠MAb和兔多抗最佳稀释倍数及最佳包被时间的条件下,加入VSV,于37℃分别反应30 min、60 min和90 min进行ELISA试验,确定抗原的最佳作用时间。
1.6.4.3 封闭液及封闭时间的确定:在相同的试验条件下,分别用2%BSA、3%BSA、5%BSA、5%脱脂奶粉、5%山羊血清作封闭液进行上述ELISA试验,确定最佳封闭液;之后在确定的最佳封闭液的条件下,分别37℃封闭1 h、1.5 h、2 h及4℃封闭12 h进行ELISA试验,确定最佳封闭时间。
1.6.4.4 酶标抗体工作浓度及反应时间的确定:在上述确定的最佳试验条件下,酶标抗体按1∶1000~1∶6000稀释进行ELISA试验,确定酶标抗体的最佳工作浓度,在确定的最佳酶标抗体浓度的基础上,酶标抗体分别反应30 min~120 min进行ELISA试验,确定酶标抗体的最佳作用时间。
1.6.5 ELISA结果判定标准的确定 采用建立的ELISA方法检测30份VSV阴性样品,测定OD450nm值,计算OD450nm的平均值(X)和标准差(SD)。以样品的OD450nm值X+3SD和X+2SD作为阳性与阴性的临界值。
1.7 双抗体夹心ELISA的性能评价
1.7.1 特异性试验 采用建立的夹心ELISA方法对VSV、SVDV、VESV和ORFV进行检测,评价该方法的特异性;将VSV细胞培养物分别与兔抗VSV阳性血清和阴性血清混合,37℃孵育1 h后,用建立的夹心ELISA方法对其进行检测,重复5次,根据阻断前后样品测得的OD450nm值评价该方法的阻断效果。
1.7.2 灵敏性试验 将纯化的VSV用PBS稀释至400 μg/mL、200 μg/mL、100 μg/mL、50 μg/mL、25 μg/mL、12.5 μg/mL、6.25 μg/mL、3.125 μg/mL和1.5625 μg/mL,用建立的夹心ELISA方法对其检测,以抗原稀释浓度做横坐标,读取的OD450nm值做纵坐标,绘制标准曲线,确定该方法的灵敏度。
1.7.3 重复性试验 采取同一批次(n=5)和不同批次(n=5)酶标板,分别检测5份阳性样品和5份阴性样品,计算批内、批间变异系数,以评估该夹心ELISA方法的重复性。
1.8 临床样品的检测 从吉林省及辽宁省部分地区采集187份疑似水VSV感染的临床病料的水泡液,分别用无菌PBS按1∶10稀释,用本实验建立的夹心ELISA和RT-PCR[7]进行平行检测,评价ELISA相对RT-PCR的特异性、敏感性及符合率。
2 结果
2.1 病毒的纯化 将细胞培养的VSV用差速离心及超速离心纯化后,紫外分光光度计测其蛋白浓度为3.08 mg/mL。VSV接种MDBK细胞的感染滴度为10-5/0.1 mL。
2.2 MAb和多抗的制备及纯化 用已建立的间接ELISA方法对纯化的MAb及多抗进行抗体效价检测,其效价分别为2.56×104和1.28×104;用紫外分光光度计测得纯化后的MAb及兔抗VSV多抗的浓度分别为4.938 mg/mL和4.125 mg/mL。
2.3 双抗体夹心ELISA检测方法的反应条件优化结果 在建立VSV双抗体夹心ELISA检测方法时,本实验对捕获抗体和检测抗体的选择及其最佳工作浓度、最佳包被条件、抗原最佳作用时间、最佳封闭液及封闭时间、酶标抗体工作浓度及反应时间等各项反应条件进行了优化,结果如表1所示,以MAb 1A2为捕获抗体包被酶标板,以兔抗VSV的多克隆抗体为检测抗体;通过方阵滴定法确定MAb 1A2 的最佳包被浓度为 1∶1600(3.09 μg/mL),兔抗VSV 的最佳工作浓度为 1∶800(5.16 μg/mL);最佳包被时间确定4℃12 h;37℃60 min为抗原最佳作用条件;用5%BSA作为封闭液,其P/N值较高,封闭效果比较理想;37℃1.5 h封闭时间最优;酶标二抗的最佳稀释度为1∶5000,其最佳反应时间为45 min。

表1 双抗体夹心ELISA检测方法的反应条件优化结果Table 1 The optimized conditions of the sandwich ELISA
2.4 ELISA结果判定标准的确定 用建立的双抗体夹心ELISA法检测30份VSV阴性样品,以测定OD450nm值为横坐标,以各组(分7组)频数为纵坐标,得到阴性样品的分布直方图(图1)。经统计学处理,样品的()和SD分别为0.135和0.032,根据公式+3SD计算,阳性结果判定标准的临界值为0.231,即OD450nm值>0.231判为阳性;根据公式+2SD计算,阴性结果判定标准的临界值为0.199,即OD450nm值<0.199判为阴性;OD450nm值在0.199~0.231之间的判为可疑样品。

图1 阴性样品分布图Fig.1 Distribution of negative sample
2.5 特异性试验 用建立的ELISA方法分别检测VSV、SVDV、VESV和ORFV,该方法仅在检测VSV时OD450nm值>0.231(图2),表明该方法在检测其它相关病毒时不发生交叉反应,特异性良好;VSV阳性样品能够被兔抗VSV阳性血清阻断,而不被兔抗VSV阴性血清阻断(表2)。

图2 双抗体夹心ELISA交叉反应结果Fig.2 Cross-reaction tests of DAS-ELISA
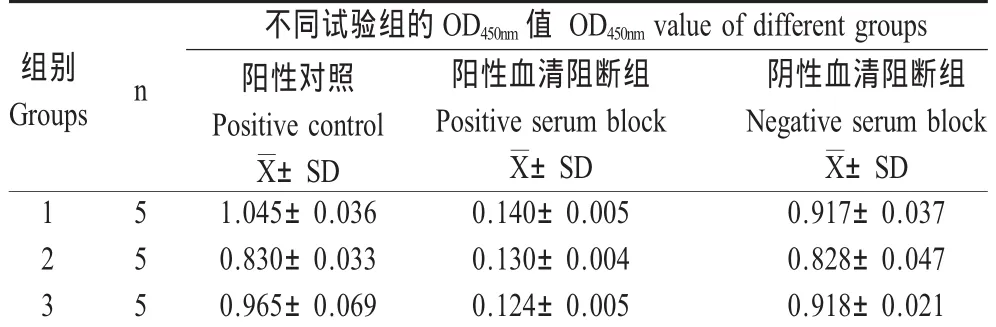
表2 双抗体夹心ELISA阻断试验结果Table 2 The block assay of DAS-ELISA
2.6 灵敏性试验 用该方法对不同浓度的VSV进行检测,以抗原稀释浓度做横坐标,读取的OD450nm值做纵坐标,绘制标准曲线(图3),其线性良好,线性回归方程为Y=4.9273X+0.1962,线性回归常数R2为 0.9965,检测范围为 3.125 μg/mL~400 μg/mL,该方法最低可以检测3.125 μg/mL(101TCID50)的病毒。
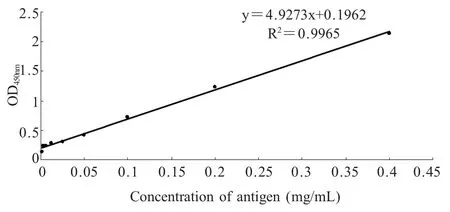
图3 双抗体夹心ELISA灵敏性试验Fig.3 Sensitivity tests of DAS-ELISA
2.7 重复性试验 批内及批间检测样品的重复性结果显示,批内变异系数为2.04%~8.17%,批间变异系数为3.26%~9.21%,批内、批间变异系数匀小于10%,表明此方法具有较好的重复性(表3)。
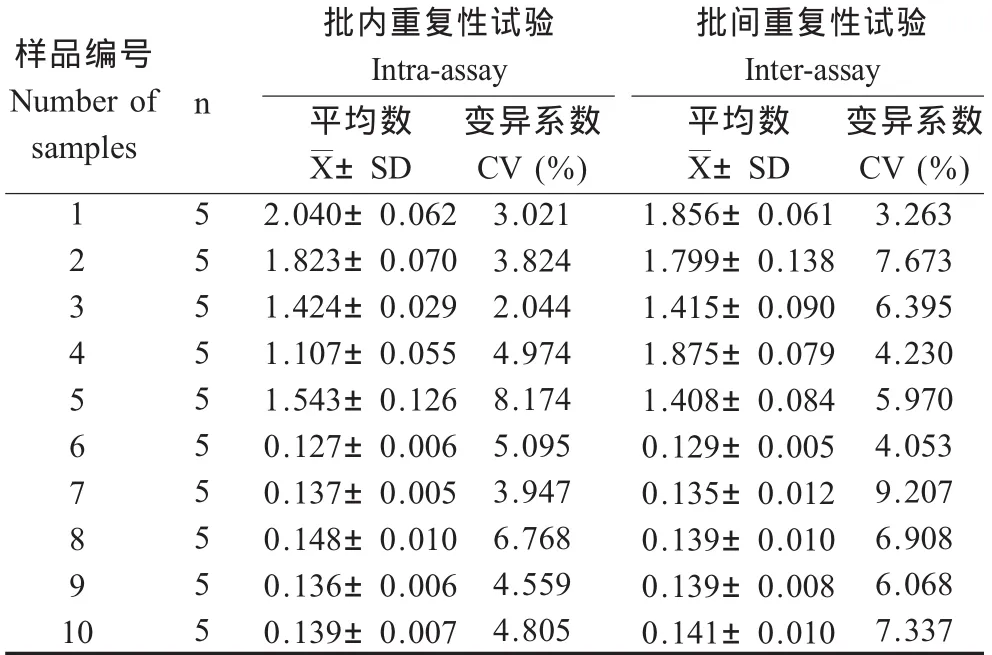
表3 批内和批间重复性试验结果Table 3 Results of intra-batch and inter-batch reproducibility tests
2.8 临床样品的检测 采用建立的夹心ELISA方法和RT-PCR同时检测187份临床样品(表4),ELISA检测16份阳性,171份阴性;RT-PCR检测18份阳性,169份阴性。两种方法检测均为阳性的为15份,均为阴性的为168份。经计算得出夹心ELISA较PCR的特异性和敏感性分别为99.4%(168/169)和83.3%(15/18),两者的符合率为97.9%[(15+168)/187],提示该方法可以代替RT-PCR用于VSV临床样本检测。
3 讨论
双抗体夹心ELISA方法已被大量用于动物疫病的临床诊断,该方法中捕获抗体和检测抗体的选择是影响其特异性的关键因素[8-9]。本实验在选择时,以抗VSV-G MAb 1A2作为捕获抗体,兔多抗作为检测抗体建立双抗体夹心ELISA,这可能与MAb的特异性强有关,其加强了抗原抗体反应的特异性,使检测反应具有较高的灵敏度和特异性。而用兔抗VSV包被酶标板,以抗VSV-G MAb作为检测抗体建立的双抗体夹心ELISA,测得的OD450nm值始终偏低(小于0.25),原因可能是多抗作为捕获抗体结合了大部分的抗原决定簇,从而减少了抗原与MAb结合的表位,导致抗原与检测抗体结合的效率降低,在一定程度上降低了检测方法的敏感性[10]。

表4 ELISA和RT-PCR对临床样品检测结果的比较Table 4 Comparison of detection results of clinical samples between ELISA and RT-PCR
抗体的效价和纯度是影响双抗体夹心ELISA敏感性的关键因素,因此本实验采用纯化的全病毒免疫动物,以获得抗VSV所有结构蛋白的特异性抗体,并且对抗VSV MAb和兔源的多抗采用辛酸-饱和硫酸铵法进行了纯化,同时进行了抗体间的交叉反应试验,结果表明背景值低,以最大可能降低了非特异性反应,从而提高了敏感性。
本实验通过方阵滴定法确定了抗VSV MAb、兔抗VSV高免血清的最佳工作浓度并对该方法中孵育温度、反应时间、封闭液、酶标抗体的浓度等进行了优化,用于检测VSV抗原,灵敏度达3.125 μg/mL(101TCID50);与SVDV、VESV和ORFV不发生交叉反应,并结合阻断试验,特异性良好。此外,本研究通过临床样本的检测及与RT-PCR的试验比较,两者的符合率为97.9%,表明在临床应用方面该方法可以代替RT-PCR用于VSV的快速检测。
综上所述,本实验建立的检测VSV的双抗体夹心ELISA方法较常见的VSV检测方法,如病毒分离鉴定、RT-PCR,成本低廉、操作简便、设备简单、快速稳定等优点,适合基层现场检验工作的需要,可以为VSV的临床快速检测及流行病学调查提供有效的工具,也为动物性食品检疫等公共卫生安全提供了有力的保障。
[1]Comer J A,Tesh R B,Govine B M,et al.Vesicular stomatitis virus,New Jersey serotype:replication in and transmission by Lutzomyia shannoi[J].Am J Trop Med Hyg,1990,42(5):483-490.
[2]Mead D G,Ramberg F B,Besselsen D G,et al.Transmission of vesicular stomatitis virus from infected to noninfected black flies co-feeding on nonviremic deer mice[J].Science,2000,287:485-487.
[3]Schmitt B.Vesicular stomatitis[J].Vet Clin North Am Food Anim Pract,2002,18(3):453-459.
[4]马俊儒,马相斋.牛暴发水泡性口炎[J].畜牧与兽医,2003,35(1):44.
[5]Alvarado J F,Dolz G,Herrero M V.Comparison of the serum neutralization test and a competitive ELISA assay for the detection of antibodies to VSV-NJ and VSV-IN[J].J Vet Diagn Invest,2002,14:240-242.
[6]Rodriquez L L,Letchworth G J,Spiropoulou C F,et al.Rapid detection of vesicular stomatitis virus New Jersey serotype in clinical samples by using polymerase chain reaction[J].J Clin Microbiol,1993,31:2016-2020.
[7]杨桂梅,徐自忠.VSV的RT-PCR快速检测方法的建立[J].动物科学与动物医学,2003,20(2):23-27.
[8]Hut chings G H,Ferris N P.Indirect sandwich ELISA for antigen detection of African swine fever virus:comparison of polyclonal and monoclonal antibodies[J].J Virol Methods,2006,131(2):213-217.
[9]Panadero R,Vazquez L,Colwell D D,et al.Evaluation of an antigen capture ELISA for the early diagnosis of H ypodermalineatum in cattle under field conditions[J].Vet Parasitol,2007,147(3/4):297-302.
[10]杨俊兴,花群义,陈焕春,等.检测蓝舌病病毒双抗夹心ELISA方法的建立[J].中国兽医科学,2009,39(1):50-53.

