运动预处理对力竭运动诱导的大鼠大脑皮质细胞凋亡的影响
王璐 邓文骞 袁琼嘉
成都体育学院(成都 610041)
缺血预处理(ischemic preconditioning,IP)是通过反复短暂缺血来调动机体内源性保护机制从而延缓或减轻组织后续缺血再灌注损伤的现象。缺血预处理调动机体内源性抗损伤能力,保护缺血的组织细胞。缺血预处理概念的提出,为防治缺血/再灌注损伤开拓了新的研究领域。脑缺血预处理(neuronal ischemic preconditioning,NIPC)是由一种或多种低于永久性损害刺激引起的机体内在的神经保护措施,能使神经系统增强抵抗致死性缺血性损害的能力,不易形成永久性缺血损害[1]。缺血预处理对脑保护作用的发现,为内源性神经保护机制和神经保护治疗方法提供了新的启示和研究方向。在运动医学领域,利用预处理抗疲劳、提高运动能力的研究较多[2],主要通过针刺[3,4]、药物[5,6]、温度等方式预防运动疲劳;利用运动作为刺激源,引起机体缺血——运动预处理(exercise preconditioning,EP),如此重复数次后,使运动员能持续进行较长时间、更剧烈的运动[7],如利用高住低练、高原训练的方式提高运动成绩,亦属于预处理在运动医学领域的运用。
运动预处理作为一种特殊的缺血缺氧预处理,其作用机制尚不十分明了,其对中枢神经系统的保护作用及机制研究尚属起步阶段,前期研究已经发现运动预处理可以减少大鼠海马细胞的凋亡程度,对大鼠海马细胞产生一定的保护作用[8]。作为对运动性缺血缺氧最为敏感的部位大脑皮质神经元[9],运动预处理是否对其也存在保护作用,保护机制如何?通过建立运动预处理模型,本研究探讨运动预处理对大脑皮质的保护作用。
1 材料与方法
1.1 动物及其分组
4月龄成年雄性SPF级SD大鼠40只,购自四川大学华西医学中心实验动物中心,生产许可证编号:SCXK(川)2009-09;使用许可证编号:SYXK(川)2009-045,动物批号:20100302。大鼠随机分为空白对照组(C 组,n=8),力竭运动组(EE 组,n=16)和运动预处理组(EP 组,n=16)。
1.2 实验造模
C组常规喂养。EE组:前3天进行无负重10 min适应性游泳,随后和C组一样常规喂养,4周后,进行一次性力竭游泳。EP组:前3天进行无负重10 min适应性游泳,从第4天开始进行不负重中等负荷游泳训练,60 min/d,6 d/w,持续4周。末次运动24 h后进行一次性力竭游泳。力竭标准[10]:1)大鼠沉入水下无法返回水面超过10 s;2)大鼠协调运动消失,在水中无方向性地乱窜,虽未达到10 s亦定为力竭。
1.3 取材
根据后期实验方法的不同要求,采用直接取材冷冻保存和灌注取材两种取材方法。
直接取材冷冻保存:EE组和EP组进行一次性力竭游泳,力竭后即刻捞出水面,每组随机取8只大鼠处死,迅速破坏其头盖骨取出大脑组织,剥离大脑皮质部分,随即放入液氮中冷冻保存,用于提取组织总蛋白做免疫蛋白印迹检测。
灌注取材:EE组和EP组剩余各8只大鼠按2.3 ml/kg体重腹腔注射刚配制的2%戊巴比妥钠。将其仰卧,缚住四肢及头部,然后打开大鼠的胸腔,暴露心脏,快速地通过左心室向主动脉插进针头,用止血钳固定心尖部及针头,先后用生理盐水和4%多聚甲醛灌注,直到上肢及头部肌肉痉挛渐硬、变白,待灌注液从鼻中流出,则关闭多聚甲醛开关。用断头铡将头取下,用剪刀自枕骨大孔两侧沿耳朵稍后上方各剪一刀(注意不要破坏脑组织),翻起颅骨,将大脑轻轻取下,置于托盘中,在视交叉后1 mm及4 mm处沿冠状切面切开,取中间块放入装有4%甲醛固定液的小瓶中浸泡固定,室温贮存,以备石蜡包埋做HE染色及免疫组化检测用。
C组大鼠不游泳,按以上方法提前一天取材。所有实验均在成都体育学院国家体育总局运动医学重点实验室完成。
1.4 HE染色和免疫组化染色
取出甲醛固定大脑组织,乙醇脱水,二甲苯透明,包埋于石蜡中,蜡块置4℃冰箱中备用。
从4℃冰箱中取出蜡块,做4 μm额状面切片,连续切片每隔4张取4张切片,每个石蜡标本共取8张切片,均参照包新民等[11]著《大鼠脑立体定位图谱》辨认大脑皮质部位。
每连续4张切片取出其中的第1张切片进行HE染色,观察大脑皮质结构;取出第2、3、4张切片,分别用SP法(Streptavidin-peroxidase,链亲和素法)标记大脑皮质的Bcl-2和Bax表达情况。一抗为小鼠Bcl-2单克隆抗体浓缩液0.1 ml(美国Santa Cruz公司),小鼠Bax单克隆抗体浓缩液0.1 ml(美国Santa Cruz公司)。二抗为山羊抗鼠IgG(Cell Signal)抗体。
将免疫组织化学切片在计算机图像采集分析系统(Nikon&SPOT美国生产,软件为Version3.0)上采集图像(采图位置严格限定在大脑皮质区,每1例采图不少于5幅,且围绕一个中心位点连续采图)。采用Image Pro-Plus(IPP)图像分析软件定量分析Bcl-2和Bax蛋白表达。
1.5 Western-blot检测
从液氮中取出保存的标本,同时进行Bcl-2蛋白和Bax蛋白Western-blot检测。标本放入预冷研钵充分短时研磨,按500 μl/100mg标准加入蛋白裂解液至研钵冲洗研磨好的组织,充分混匀后将悬液放入EP管中,蛋白裂解液购自北京百泰克生物试剂公司,临用前加蛋白酶抑制剂:PMSF[174 mg/10ml(异丙醇)]1%;Leupeptin (1 mg/ml)1/500;Pepstatin A(5 mg/ml)1/1000。将悬液放在冰上冰浴 20 分钟,确保裂解充分,随后14000 r/min 4℃离心20分钟,收集上清,即大鼠大脑皮质总蛋白。采用BCA蛋白定量试剂盒(购自武汉博士德生物工程有限公司)对各标本总蛋白进行定量检测。各标本取20μg总蛋白加入上样缓冲液后于热板上煮10分钟,随后进行SDS-PAGE电泳,电泳后转至PVDF膜,进行免疫印记检测。Western-blot所用抗体同免疫组化实验抗体。
1.6 统计学分析
采用SPSS13.0进行统计。实验结果均以“均数±标准差”表示,组间差异采用t检验两两比较;P<0.05时差异具有统计学意义。
2 结果
2.1 HE染色结果
200倍光镜下(图1),可见C组大鼠大脑皮质神经元排列整齐,细胞间质匀称、致密;EE组大脑皮质神经元排列紊乱,多数细胞固缩且出现染色加深,细胞间质疏松,甚至出现空泡;EP组大脑皮质神经元排列整齐,细胞间质匀称、致密。400倍光镜下(图2),可见C组细胞形态完整,细胞质匀称,细胞核清晰可见;EE组细胞染色加深,无法辨认细胞核,但细胞形态较完整;EP组细胞形态完整,细胞质匀称,细胞核清晰可见,但仍有部分神经元出现染色加深。

图1 各组大鼠大脑皮质HE染色(×200)

图2 各组大鼠大脑皮质HE染色(×400)
2.2 Bcl-2和Bax免疫组化染色结果
由图3可见:EE组和C组Bcl-2阳性表达较弱,EP组Bcl-2蛋白表达强度增加。由图4可见,C组大脑皮质未见明显Bax阳性表达,EE组大脑皮质Bax阳性表达强度较C组升高,EP组大脑皮质Bax阳性表达强度较C组也有所升高。
各组大鼠大脑皮质Bcl-2和Bax免疫组化染色经Image Pro-Plus(IPP)图像自动分析系统分析后结果如表1。EP组大鼠大脑皮质Bcl-2表达较C组和EE组升高,差异具有统计学意义;EE组大鼠大脑皮质Bax表达较C组和EP组升高,差异具有统计学意义。

表1 各组大鼠大脑皮质免疫组化检测Bcl-2和Bax表达结果比较
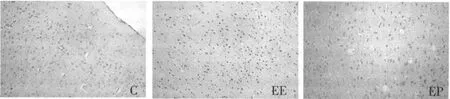
图3 各组大鼠大脑皮质Bcl-2免疫组化染色(×200)

图4 各组大鼠大脑皮质Bax免疫组化染色(×200)
2.3 Western-blot结果
由图5可见:各组Bcl-2蛋白表达存在差异,C组和EE组表达较弱,EP组表达较强。Bax蛋白同样有差异(图6),C组表达较弱,EE组表达增强,EP组表达较C组也明显增强。

图5 各组大鼠大脑皮质Bcl-2蛋白Western-blot检测
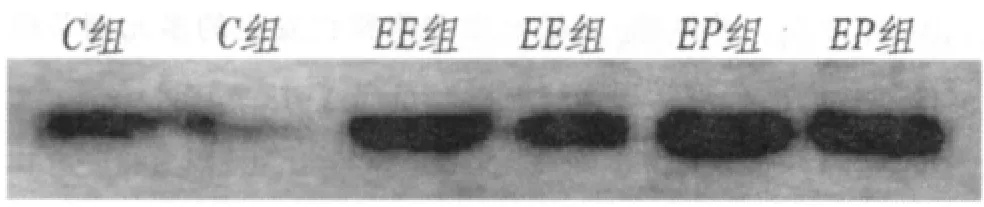
图6 各组大鼠大脑皮质Bax蛋白Western-blot检测
3 讨论
运动作为一种刺激对机体可产生有益或有害的双向影响。剧烈运动导致全身血液的重新分配,使脑相对缺血、缺氧,而脑对缺血、缺氧极为敏感。大脑在力竭运动时处于相对缺血、缺氧状态,脑细胞自由基产生增加,出现神经细胞线粒体钙超载,并发生缺血、缺氧性损伤[12,13],这些都是脑细胞凋亡的诱发因素。所以过度疲劳或一次性力竭运动都会导致中枢神经系统细胞凋亡。本实验前期研究发现,一次性力竭运动后大鼠大脑海马神经元排列紊乱,细胞间质疏松,大量细胞出现空泡,细胞凋亡明显增加,表明一次性力竭运动会引起中枢神经系统的细胞凋亡,对神经系统造成伤害。
大脑皮层作为中枢神经的中枢,是最高级别的运动控制中枢[14],大脑皮质神经元对运动性缺血缺氧最敏感,其疲劳影响整个中枢神经系统。Li等[15]发现,短时间局灶性脑缺血后,凋亡细胞散在出现于视前区和纹状体,然后扩展至大脑皮质,而长时间缺血后,整个病灶中均有散在的凋亡细胞。关于运动是否改变大脑血流状况,袁琼嘉等[16]研究力竭运动对大鼠微循环的影响后发现:力竭运动后即刻,大鼠大脑出现明显的微循环障碍。本研究发现,力竭运动组大鼠大脑皮质神经元排列紊乱,多数细胞固缩,细胞间质疏松,甚至出现空泡,高倍光镜下可见细胞染色加深,无法辨认细胞核,说明力竭运动造成大鼠大脑皮质细胞凋亡增加,其原因可能是剧烈运动时大脑相对缺血。如果通过某种预处理减少缺血对大脑皮质的损伤,将对整个中枢神经系统都起到保护作用。
在运动医学领域,利用中等负荷运动预处理减少大强度运动对脑损伤的研究较少。本实验前期研究已证实,中等运动预处理可减轻一次性力竭运动引起的大鼠海马细胞凋亡程度,对大鼠海马细胞产生一定的保护作用[8]。本实验同样将运动作为一种预防手段,发现预处理组大鼠大脑皮质神经元形态结构完好,细胞凋亡程度较力竭组明显减轻。这说明运动预处理能减少力竭运动诱导的大鼠大脑皮质缺血缺氧引起的细胞凋亡,对大脑皮质有一定的保护作用。
自1990年发现脑缺血预处理诱导脑缺血耐受以来,这种通过激发自身机制对再次严重脑缺血产生保护作用的方法受到广泛关注。脑缺血耐受实际是外界刺激激活机体内在的保护机制,增加了对下一次严重损伤的抵抗。王金春等[17]实验研究表明,脑缺血预处理是通过抗凋亡机制产生缺血耐受作用,即Bcl-2表达增加。赵刚等[18]实验研究表明,20 min局部脑缺血预处理能通过Bcl-2表达增加及Bax表达下降对再次脑缺血神经细胞起保护作用。胡永善等[19]研究表明:预运动训练可减小随后发生的脑缺血损伤的脑梗死体积,对脑缺血损伤具有一定的保护作用。这与本研究结果吻合。通过免疫组化和蛋白免疫印迹法,我们发现常压常氧状态下,运动预处理组Bcl-2表达强度高于对照组和一次性力竭运动组,而运动预处理组Bax表达较一次性力竭运动组也增强,但程度小于Bcl-2蛋白表达,表明中等负荷的运动预处理可以通过调节细胞内凋亡相关蛋白的表达诱导抗凋亡,进而对大脑皮质产生保护作用。
至于运动预处理影响Bcl-2和Bax蛋白表达从而产生保护的机制,推测同低氧预适应的机制相似。Bcl-2和Bax分别是调节细胞凋亡分子家族中的重要成员[20],细胞受到缺血/缺氧损伤时,首先启动Bcl-2基因表达以抑制细胞凋亡。预处理后,调动机体内源性抗缺氧机制,使Bcl-2高表达,通过与Bax竞争结合,形成异源二聚体,封闭Bax形成孔道的活性,阻止cty-c穿过线粒体膜进入细胞质参与形成凋亡启动复合体,激活Caspase的级联反应,最终抵抗细胞凋亡[21,22]。本实验结果从细胞凋亡角度证明,中等负荷运动预处理对一次性力竭运动导致大脑皮质细胞凋亡具有保护作用,其作用机制正在研究中。
4 总结
力竭运动可诱导大鼠大脑皮质细胞凋亡增加。运动预处理能减少力竭运动诱导的大鼠大脑皮质细胞凋亡,对大脑皮质细胞产生保护作用。运动预处理可能通过影响Bcl-2和Bax蛋白表达从而对细胞凋亡起调控作用。
[1]Nandagopal K,Dawson TM,Dawson VL.Critical role for nitric oxide signaling in cardiac and neuronal ischemic preconditioning and tolerance.J PharmacolExp Ther,2001,297(2):474-478.
[2]王岸新,宋吉锐.预处理技术的研究现状及其在运动训练中的应用前景.北京体育大学学报,2007,30 (10):1384-1385.
[3]丁晓蓉,于建春,于涛,等.针刺对快速老化小鼠SAMP10皮质衰老相关基因表达谱的影响.上海针灸杂志,2006,25(1):39.
[4]孙忠人,唐伟,单丽莉.针刺诱导脑缺血耐受的实验研究.中国临床康复,2005(9):122-123.
[5]余谦,李明富,宋开源,等.中医药抗体力性疲劳的整体思辨与应用前景.中国运动医学杂志,2001,20(1):3-4.
[6]文继月,陈志武.药物预处理的脑保护作用.淮南职业技术学院学报,2006(4):119-121.
[7]张梅,何叶.不同强度运动训练对大鼠大脑皮质CA1区神经元凋亡的影响.山东体育学院学报,2006,21(6):151-153.
[8]王璐,袁琼嘉.运动预处理对力竭运动诱导的大鼠海马细胞凋亡的影响.体育科学,2009,3(29):52-57.
[9]袁琼嘉,苏全生,熊若虹,等.不同强度运动对大脑皮质血管内皮细胞生长因子 (VEGF)的影响.成都体育学院学报,2009,12(35):71-73.
[10]Kirino T.Ischemic tolerance.J Cereb Blood Flow Metab,2002,22(11):1283-1296.
[11]包新民,舒斯云.大鼠脑立体定位图谱.北京:人民卫生出版社,1991.28-36.
[12]王来栓,邵肖梅.线粒体与缺氧缺血性脑细胞凋亡.国外医学脑血管疾病分册,2003,11(1):65-67.
[13]印克杰,孙凤艳.脑缺血中细胞凋亡发生的多元调节机制.中国药理学通报,1998,14(l):11-13.
[14]徐科.神经生物学纲要.北京:科学出版社,2000.274-285.
[15]Li Y,Chopp M,Jiang N,et al.Induction of DNA fragmentation after 10 to 120 minutes of focal cerebral ischemia in rats.Stroke,1995,26(7):1252-1257.
[16]袁琼嘉,田佳,毕新奇,等.力竭运动对大鼠微循环的影响.成都体育学院学报,1994,3(20):94-96.
[17]王金春,孙锋,宋利春.大鼠局灶脑缺血预处理的脑保护机制探讨.中国神经免疫学和神经病理杂志,2004,11(4):209-210.
[18]赵刚,邓艳秋,焦卓敏,等.大鼠局灶性脑缺血预处理的抗细胞凋亡作用机制的研究.临床神经病学杂志,2002,15(6):323-325.
[19]胡永善,贾杰,吴毅,等.预运动训练对脑梗死大鼠脑保护作用的兴奋性氨基酸递质效应.中国康复医学杂志,2008,23(7):589-593.
[20]张颜波,吕国蔚,杨明峰,等.低氧预适应小鼠海马Bcl-2表达和Caspase-3活性的变化.中华神经科杂志,2007,40(8):553-555.
[21]刘传军,李跃,高慧英.缺氧缺血性脑病新生大鼠发育期间海马神经元的变化与康复.中国新生儿科杂志,2007,22(3):145-148.
[22]Hua F,Cornejo MG,Cardone MH,et al.Effects of Bcl-2 levels on Fas signaling-induced caspase-3 activation:molecular genetic tests of computational model predictions.Immuno,2005,175(2):985-995.

