低剂量氟化物对新生大鼠成骨细胞增殖的影响
丁文鹏,沈立明,何智慧
低剂量氟化物对新生大鼠成骨细胞增殖的影响
丁文鹏1, 2,沈立明1,何智慧2
(1. 深圳大学 生命科学学院, 广东 深圳, 518000; 2. 深圳市库源生物科技有限公司, 广东 深圳, 518000)
氟是人体内重要的微量元素之一,低剂量的氟化物作用成骨细胞与骨代谢关系密切. 成骨细胞活跃和骨转换加速是氟骨症的重要特征. 研究了氟化物对成骨细胞增殖以及细胞分裂周期的影响, 证实了低剂量的氟化物(2 mg/L)能引起体外培养的成骨细胞的细胞增殖并增加细胞分裂增殖的代数.
氟化物; 大鼠; 成骨细胞; 增殖
氟是人体内重要的微量元素之一. 在自然界的分布主要以萤石(CaF2)、冰晶石(Na3AlF6)和磷灰石(Ca5F(PO4)3)这三种矿物存在. 氟由胃肠道吸收入血液, 以离子形式分布到全身, 在机体内与氢氧根离子或碳酸根离子交换, 形成稳定的氟磷灰石, 沉积在骨和牙齿等组织. 氟与骨代谢关系一直是研究者最关注的领域[1-2], 易与钙磷形成化合物滞留在骨骼内. 正常情况下, 氟在人体所占比例大致是恒定的, 体内氟含量过高, 会导致氟骨症. 它的发病机理还存在争议[3]. 有研究表明氟化物对体外培养的成骨细胞存在低剂量促进生长增殖, 高剂量抑制生长的双向调节作用[4]. 氟对体外培养成骨细胞促进增殖的有限浓度上限在10 mg/L左右[5], 超出这个剂量则超出细胞耐受范围, 引起的细胞凋亡. 成骨细胞功能活跃在氟骨症病变中是一个发生较早并起主导作用的环节. 无论是骨硬化氟骨症还是骨软化氟骨症都是在成骨细胞活动加强、骨转换加速的情况下发生的. 成骨细胞活跃和骨转换加速是氟骨症的重要特征. 本研究采用低剂量的氟化物作用成骨细胞, 模拟氟骨症中成骨细胞激活状态[6], 研究了氟化物对成骨细胞增殖和细胞分裂的影响.
1 材料与方法
1.1 仪器和试剂
高速冷冻离心机(5417R, Eppendorf, 德国); 二氧化碳培养箱(香港力新); 倒置显微镜(CKX41, Olympus, 日本); 细胞流式仪(BC-032贝克曼库尔特, 美国); SPF级SD大鼠(1~4 d, 广东省动物中心提供); 胎牛血清(PAA, 奥地利); 胰蛋白酶(Sigma, 美国); αMEM培养基(Hyclone, 美国); CFSE细胞增殖检测探针(Promega, 美国). PI试剂盒(贝克曼库尔特, 美国); 其他试剂来源于正规公司, 溶液按照相关标准方法配制.
1.2 成骨细胞的分离和鉴定
取1~4 d新生SD乳鼠9只, 酒精浸泡片刻, 用含双抗的D-Hank’s液清洗, 断颈处死. 剥离结缔组织和骨膜, 直到头盖骨呈现白色为止. 将头盖骨剪为1 mm2大小, 经胰酶、Ⅱ型胶原酶等处理, 得到细胞悬液, 转移到细胞培养瓶中. 当细胞长满, 用0.25%胰酶消化, 分离成纤维细胞和成骨细胞, 得到较纯的成骨细胞待用. 成骨细胞用Gomori钙钴改良法染色鉴定[7].
1.3 成骨细胞的增殖观察与检测
纯化的成骨细胞按1×105个/mL接种到六孔板中, 隔天换液. 加入含2 mg/L NaF, 用αMEM培养基(10%血清)稀释. 对照加入αMEM培养基(10%血清)作用48 h, 然后用倒置显微镜拍照观察, 成骨细胞采用CFSE(Carbofluorescein Diacetate Succinimydil Ester)方法标记[8].
1.4 细胞周期的检测
每个培养皿接种1 mL(细胞密度1×105个/mL左右), 待贴壁12 h后加入含2 mg/L NaF的αMEM培养基作用48 h(用不含NaF的一组作为空白对照). 胰酶消化收集细胞, 做成细胞悬液, 使密度在106个/mL左右, D-Hank’s洗一次, 按试剂盒操作. 加入PI工作液, 37℃避光孵育 30 min, 1500转离心3 min, D-Hank’s洗一次, 上细胞流式仪检测. 采用FL1通道, 共收集10 000个细胞, 用FCSExpress3.0软件分析数据.
2 结果与讨论
2.1 成骨细胞的纯化鉴定
酶消化得到成骨细胞为卵圆形, 高亮, 部分附着在骨膜网上. 在培养箱中静置1~2 h后. 部分细胞贴壁. 36 h后换培养液时活细胞完全贴壁, 死细胞悬浮在培养液中. 纯化后3天细胞为梭形、三角形, 或多边形, 如图1A所示. 原代培养第6天时, 镜下观察到细胞贴于瓶壁, 而且细胞变为梭形, 两极有长的突起, 相邻细胞突起交织在一起. 第9天时, 细胞数量明显增多, 细胞相互之间联系密切, 部分出现重叠生长. 在细胞密集区可表现为放射状、旋涡状或栅栏状. 细胞周围开始变得暗淡, 可能是钙沉积, 肉眼可见细胞爬片上有白色点状物, 镜下可见细胞集簇生长形成钙化结节. 如图1(b)所示.

图1 分离纯化后的成骨细胞(×100)
在体外培养的成骨细胞仍保持较高的碱性磷酸酶活性, 经Gomori染液作用后成骨细胞胞内会出现黑色沉淀, 如图2所示. 阴性对照的成纤维细胞少数或完全没有着色, 而实验组成骨细胞则呈阳性, 几乎全部出现黑色沉淀.

图2 细胞Gomori染色照片 (×200)
2.2 氟化物对成骨细胞的增殖影响
CFSE是一种可穿过细胞膜的荧光染料, 具有与细胞结合特异性的琥珀酰亚胺酯基团,与具有非酶促水解作用的羧基荧光素二醋酸盐基团结合在一起,使CFSE 成为一种良好的细胞标记物. 分别将培养48 h后的2组细胞(对照组、实验组含2 mg/L氟化钠)CFSE染色. CFSE属非极化分子, 能自动穿过细胞膜而进入胞内. 在胞内酯酶作用下转变为阴离子化CFSE, 与胞内蛋白赖氨酸侧链及可利用的氨基发生不可逆结合, 在静止细胞内经约24 h平衡后, 能在胞内保留数月, 且随细胞分裂而减半. 由此从细胞发出荧光的强弱可间接反映成骨细胞分裂增殖快慢, 如图3所示. 经CFSE标记后, 空白对照的细胞荧光强, 细胞密度小, 实验组的细胞荧光较弱, 细胞密度大.
当细胞被CFSE标记后, 细胞每分裂一次, 通过流式细胞仪在488 nm处进行荧光强度检测时, 相应产生一个明显可见的波峰. 细胞分裂多少次就有多少波峰, 而且分裂次数越多峰值会减小. 在图形上反映出从左往右峰的数目增加但峰值会下降. 如图4所示. 4(a)有2个波峰且其中一个波峰较大, 4(b)有5个波峰, 表明同样培养48 h后, 无氟作用成骨细胞只有少数细胞分裂一次, 有两代分裂细胞. 在2 mg/L氟化钠作用48 h后, 成骨细胞分裂4次, 有5代分裂细胞. 在同样的条件下染氟细胞分裂次数要多, 说明低剂量氟化钠可促进成骨细胞的分裂增殖能力.

图4 成骨细胞CFSE标记流式分析图
2.3 氟化物成骨细胞周期的变化
细胞周期是指细胞从一次有丝分裂结束到下一次有丝分裂结束的过程. 细胞周期反应了细胞增殖速度, 整个细胞周期经历分裂间期和有丝分裂期(M期). 分裂间期或生长期分为合成前期(G1)、DNA合成期(S)和合成后期(G2)实验采用单PI标记法, 染氟浓度为4.76×10-5mg/L. 作用48 h, 发现氟作用的细胞S期和G2/M期都增加, 但G2/M期与对照组比较有统计学上的差异. 图5为单PI标记的成骨细胞经细胞流式仪检测的细胞周期图. 从图5可以看到, 染氟48 h的细胞与对照组比较G0/G1期细胞减少, S期细胞增多, G2/M期细胞显著增多. 表1显示3次实验统计数据, 只有G2/M期有统计学差异(<0.05). G0/G1期、S期组间没有统计学上的差异.
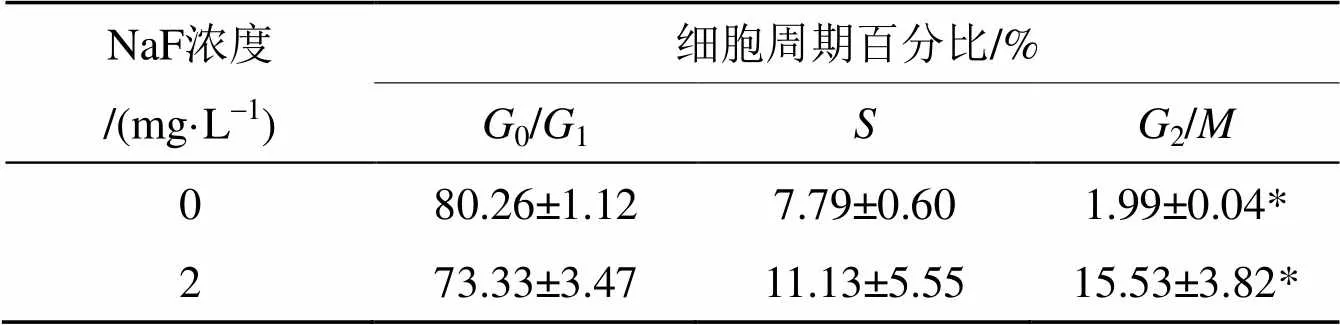
表1 新生SD大鼠成骨细胞染氟48h后各细胞周期的百分比
注:=3 (* 代表<0.05)

图5 染氟48 h后成骨细胞周期变化图
以上研究工作在细胞水平上证实了低剂量的氟化物(2 mg/L)确实能引起体外培养的成骨细胞的细胞增殖. CSFE标记可以直观看到细胞分裂增殖的代数, 细胞周期实验发现氟化物能使成骨细胞的S期和G2/M期增加.
[1] Singh A. Endemic Fluorosis EpidemiologicaI and BlochemicaI Study of Chrouic fluofide Intoxication in Punjab[J]. Medcine, l963, 42: 229- 246.
[2] 万桂敏, 莫志亚, 刘忠杰, 等. 地方性氟中毒患者多项检验指标的测定及分析[J]. 中国地方病防治杂志, 2001, 20(1): 137-139.
[3] 刘开泰. 氟对骨骼损伤的研究进展[J]. 地方病通报,1999, 14(2): 91-95.
[4] Fareley J R,Wergedal J E,Baylink D J. Fluoride directly stimulates p ro liferation and alkaline phosphatase activity of boneforming cells [J]. Science, 1983, 22: 330-332.
[5] 李广生, 张文岚, 华坤, 等. 慢性氟中毒时成骨细胞激活的机制[J]. 中国地方病杂志, 2003, 22(1): 10-13.
[6] 李广生. 地方性氟中毒发病机制[M]. 北京: 科学出版社, 2004: 20-31.
[7] 王洪复. 骨细胞图谱与骨细胞体外培养技术[M]. 上海: 上海科学技术出版社, 2000.
[8] Padureanu1 L, Cozmei C. Flow-cytometric analysis of specific proliferation in tuberculosis using the CFSE dye dilution technique[J]. J Prevent Med, 2003, 11(1): 67-74.
The influence of low dose of fluoride on the proliferation of neonatal rat osteoblasts
DING Wen-peng1, 2, SHEN Li-ming2, HE Zhi-hui2
(1. School of Life Sciences, Shenzhen University, Shenzhen 518000, China; 2. Shenzhen Coolrun Life Science, Shenzhen 518000, China)
Fluorine is one of the important trace elements in the human body, and closely related to bone metabolism. Osteoblast cell activity and bone turnover acceleration is an important characteristic of skeletal fluorosis. In this work, the impact of fluorinecompounds on osteoblast cell proliferation and cell division cycle was studied with low doses of fluoride. It was confirmed that low doses of fluoride (2 mg/L) can cause osteoblast cell proliferation in vitro and accelerate the proliferation of cell division algebra.
Fluoride; Rats; Osteoblasts; Proliferation
10.3969/j.issn.1672-6146.2012.03.013
Q 352
1672-6146(2012)03-0046-04
2012-07-30
丁文鹏(1980-), 男, 硕士, 从事生命科学研究. E-mail:dennishe@sdu.edu.cn
何智慧(1971-), 男, 研究员, 博士, 从事分析化学和生命科学研究工作. E-mail: dennishe1971@163.com
(责任编校:谭长贵)

