禽畜养殖场土壤抗生素抗性基因污染的初步研究*
邹世春,李 青 ,贺竹梅
(1. 中山大学海洋学院水产品安全教育部重点实验室,广东 广州510275;2. 中山大学生命科学学院水产品安全教育部重点实验室,广东 广州510275)
在医疗和养殖等过程中大剂量持续排放的抗生素选择压力下[1-2],生物体不断地接触到低于致死浓度的抗生素[3],这将引起细菌特定的转录响应[4-7],固有抗性菌株和选择性抗性突变株中的抗性基因(Antibiotic Resistance Genes, ARGs)便被选择出来。当这些抗性基因整合到基因移动元件能够转移并能在抗生素选择压力下能富集的时候,便被视为一种新型污染物而存在[8],这将极大地危害人类健康及生态系统的稳定。四环素作为一种广谱抗生素,凭借其杀菌作用显著及较小副作用的特点,被广泛应用于人类及养殖业并进入周边环境,使得存在于环境微生物染色体上的四环素抗生基因tet被选择出来,成为一种新型持久性的环境污染物。此外,大部分tet基因都能与基因移动单元(如能转移的质粒、转座子、整合子等)相连,使tet基因可在种间甚至属间进行转移,造成携带有tet基因的细菌容易在人体、动物、环境中广泛存在,并通过基因水平转移(Horizontal Gene Transfer,HGT)等方式,侵染到其他共生菌甚至病原菌中。而共生菌将作为tet基因以及其他ARGs的大型储库,造成对环境、人体健康的危害。对珠三角一些主要水体(河流、养殖基塘、污水处理厂及海湾等)中抗生素及北江河水中磺胺、四环素抗性基因污染的研究均表明,环境抗生素及其抗性基因污染已十分严重[9-11]。
本文以珠海某养殖场土壤及周边基塘沉积物中的微生物及其ARGs为主要研究对象,使用聚合酶链反应(PCR)及荧光实时定量PCR等技术,着重研究了多种四环素抗性基因的存在和污染水平,以期为我国养殖环境中抗性基因的污染状况提供信息。
1 材料与方法
1.1 样品采集与处理
所研究的养猪场为珠海高新区那州村四大猪场之一,年出栏数3000头多左右,已使用20余年。养猪场周边有人工种植林木和两个养殖基塘,粪便经化粪池简单处理后通过沟渠排出,固体物用于林木施肥和鱼塘。但由于管理问题,猪场对周边河流、土壤及空气造成一定污染,经常受到周边居民投诉。本研究选择该养殖场土壤及周边基塘沉积物,共设置了16个采样点。采集养殖场0~5 cm 表层土壤样品各约100~150 g,用无菌密实袋装好,并记录采样时间、天气、温度等。
1.2 土壤样品细菌耐药性分析
取1 g土壤溶于10 mL无菌水中,移取100 μL均匀涂布在四环素终浓度为20 g/L的抗性LB固体培养基上,37 ℃培养24 h,观察是否有菌落生长。同时,将样品涂布在不含有四环素的LB固体培养基上做阴性对照,初步分析样品中四环素抗性菌群的大致状况。
1.3 四环素类抗生素抗生基因(tet)分析
1.3.1 四环素类抗生素抗生基因的定性分析 采用聚合酶链式反应(Polymerase Chain Reaction,PCR)技术对环境中拷贝数相对较低的ARGs进行指数倍扩增放大。首先采用OMEGA微量土壤DNA提取试剂盒法抽提土壤中总DNA,并采用NanoVue 超微量分光光度计测定其A260/A280及A260/A230比值。通常纯DNA 的A260/A280值介于1.7~1.9之间。当样品中含有大量腐殖酸、蛋白、酚类等物质时,会造成A260/A280值小于1.6;当有RNA污染时,A260/A280值会大于1.9。不纯净的DNA样品对后续的PCR反应中的Taq酶等造成抑制作用,从而影响后续反应进行。
根据设计的引物[12-13](序列如表1所示),对样品中的9种tet基因及16S rDNA进行PCR扩增,相关反应体系和程序如下。
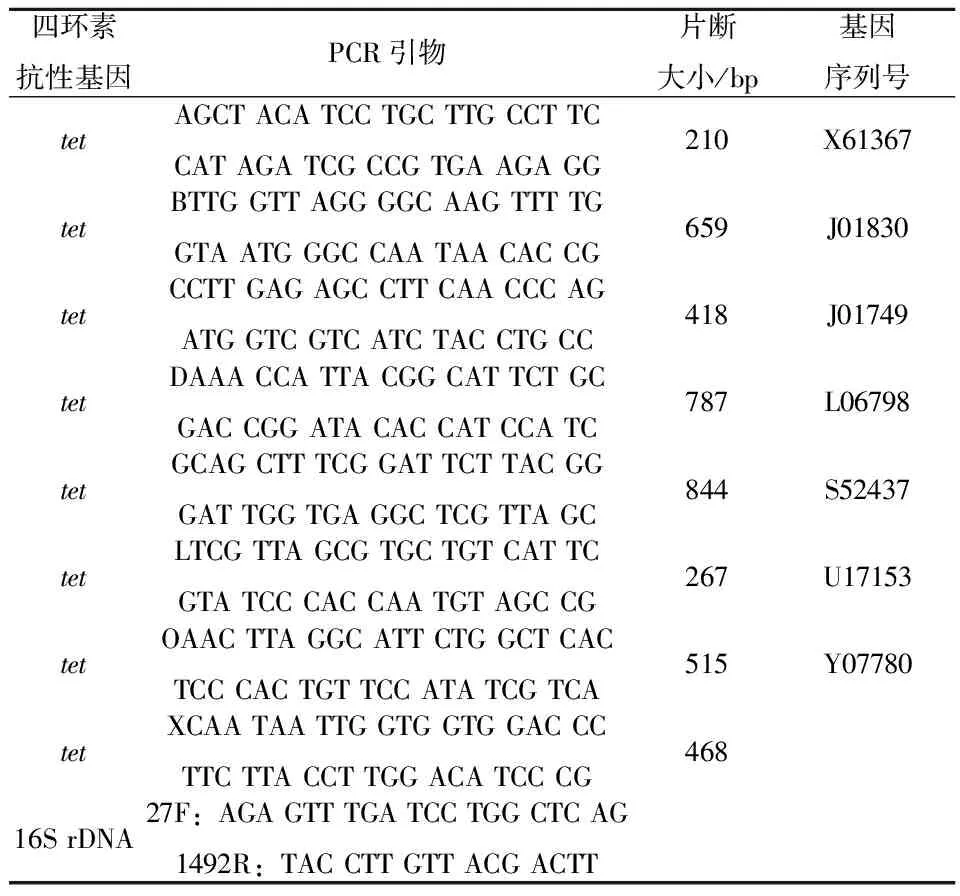
表1 引物序列
PCR反应体系:10×buffer,2.5 μL;引物,每反应需要引物0.2 μmol/L;Taq酶,2.5 U/反应;dNTPs,每种脱氧核苷酸为200 μmol/L;DNA模板,1.5 μL;ddH2O,19.3 μL;总体积为25 μL。
PCR反应程序:95℃预变性5 min;然后95℃,30 s;55 ℃,30 s;72 ℃,1 min,共40个循环;接着72 ℃,10 min;4 ℃保存。PCR产物经琼脂糖凝胶电泳检测后,割胶回收、纯化。将目的DNA(tetA、tetC、tetG和tetX)片段与pGM-T载体连接后,转化进入大肠杆菌DH5α感受态细胞中并提取白斑菌落的重组质粒。经过PCR验证后将质粒上含有目的tet基因进行测序。利用NCBI数据库中BLAST功能对测序结果进行分析,以进一步验证所获得ARGs(tetA、tetC、tetG和tetX)的核苷酸序列与基因库中目的基因序列匹配的一致性,并为后续ARGs的定量分析做准备。
1.3.2 四环素类抗生素抗生基因的定量分析 采用SYBR Green I荧光定量PCR法对样品中tetA、tetC、tetG和tetX等4种四环素抗性基因进行定量分析。qPCR体系为10 μL:2×SYBR supermix,1.5 μL;模板DNA,0.5 μL;引物,0.6 μL;ddH2O,8.8 μL。反应程序为:95 ℃,预变性5 min;然后95 ℃,30 s;55 ℃,30 s;72 ℃,1 min,共40个循环;最后72℃,10 min。将所提取的质粒原液稀释10倍成10个梯度(拷贝数从n×1010系列稀释到n×101),制作标准曲线。根据标准曲线所计算出的目的基因浓度及样品DNA的浓度,从而得出该目的基因在样品DNA中的丰度。
2 结果与讨论
2.1 土壤样品耐药性分析
根据细菌在抗性LB固体培养基生长状况看来,16个采样点土壤及沉积物样品在四环素抗性培养基上都有细菌菌落生长,表明该地区四环素抗性细菌的存在十分普遍。并且,环境中只有5%左右的细菌能在抗性培养基上培养,这意味着可能在环境中存在更多未能被培养的抗性细菌。因此,我们需要通过基因克隆、PCR和qPCR等分子生物学手段在基因水平上对抗性细菌及其抗性基因有更深入的研究。
2.2 四环素抗性基因(tet)存在水平分析
养殖土壤环境中tet基因PCR产物扩增结果如图1所示,其样品检出率统计结果列于表2中。
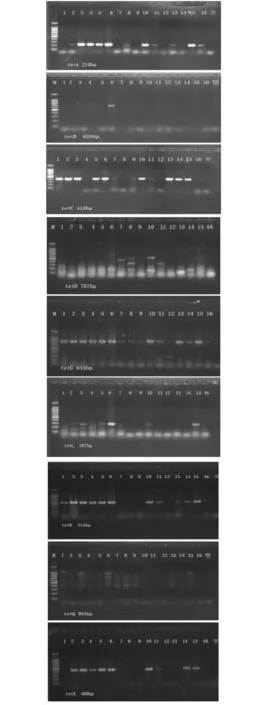
图1 9种四环素抗性基因(tetA、tetB、tetC、tetD、tetG、tetL、tetO、tetQ和tetX)的PCR扩增电泳图
根据图1中9种四环素抗性基因(tetA、tetB、tetC、tetD、tetG、tetL、tetO、tetQ和tetX)的定性PCR电泳结果可知,除tetD未被检出之外,其余8种均有检出。从表2可以看出,在检出的8种抗性基因中,除tetB检出率相对较低(6%)之外,以tetG的检出率为最高(94%),其次为tetC和tetO(75%),其他抗性基因的检出率也较高(44%~69%)。
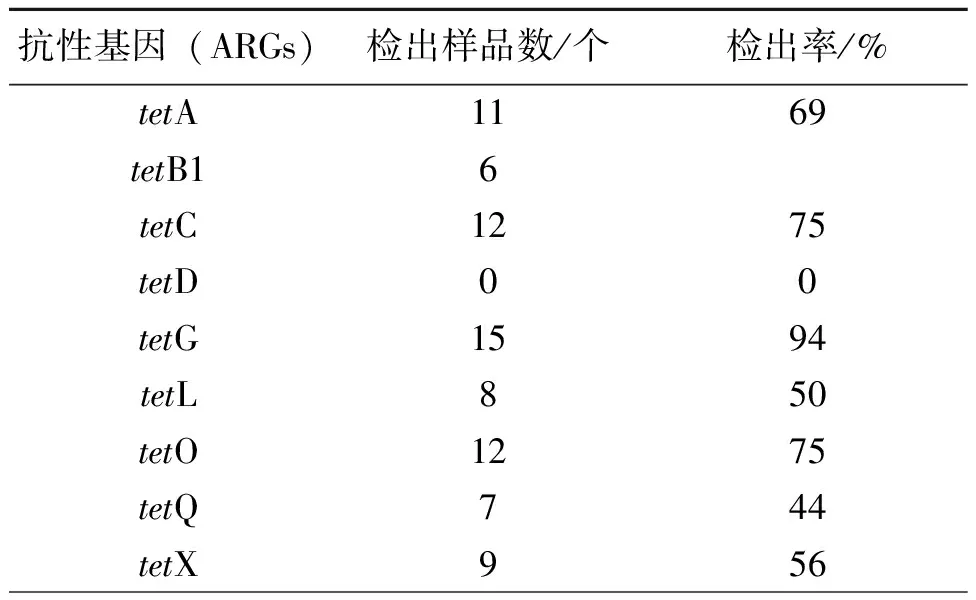
表2 抗生素抗性基因PCR结果统计
值得注意的是,在所检出的8种四环素抗性基因中,tetA、tetB、tetC、tetD、tetG和tetL为用于编码外排泵蛋白的基因。当纳摩尔浓度的四环素进入细胞,与阻遏蛋白结合,使阻遏物不能与DNA操纵作基因结合,调节基因与结构基因开始转录,编码相应的外排蛋白,将细菌体内的药物泵出,达到对抗生素的抗性。这些外排泵基因常与携带不同抗性基因甚至不同来源的质粒相连,这无疑加剧了抗性基因在细菌群体中的转移并使细菌易于产生多重耐药。另外,tetO和tetQ主要为编码核糖体保护蛋白,它们与核糖体结合后使核糖体构象发生改变,从而使四环素不能与核糖体发生结合,从而起到对四环素的抗性。tetX是唯一编码四环素灭活酶的基因,在有氧条件及NADPH作用下,该基因编码的蛋白可以对四环素进行修饰,使四环素失效。
上述结果表明,生长在禽畜养殖场土壤中抗四环素的细菌具有多种不同的抗性基因及其抗性机制,其中以编码外排泵蛋白的基因占优势。这使得细菌可将进入体内的四环素重新泵至外环境,从而造成更大面积的四环素污染;另外,在四环素的低致死剂量的持续排放下,又会进一步加剧tet基因的富集。
2.3 四环素抗性基因(tet)实时荧光定量结果分析
为了对样品中常见的tetA、tetC、tetG和tetX等4种四环素抗性基因作进一步的研究,我们对其进行了实时荧光定量分析。本研究在前述PCR定性结果的基础上,将样品中所获得的tetA、tetC、tetG和tetX等4种四环素抗性基因的测序结果与GeneBank中的目的序列比对发现,其吻合率在99%以上,进一步确认了样品中存在tetA、tetC、tetG和tetX等4种抗性基因。
以成功获得含有目的基因的质粒制作qPCR的标准曲线,并通过LightCycler®480荧光定量PCR系统所携带的样品溶解曲线的设定程序来排除非特异性扩增的干扰。
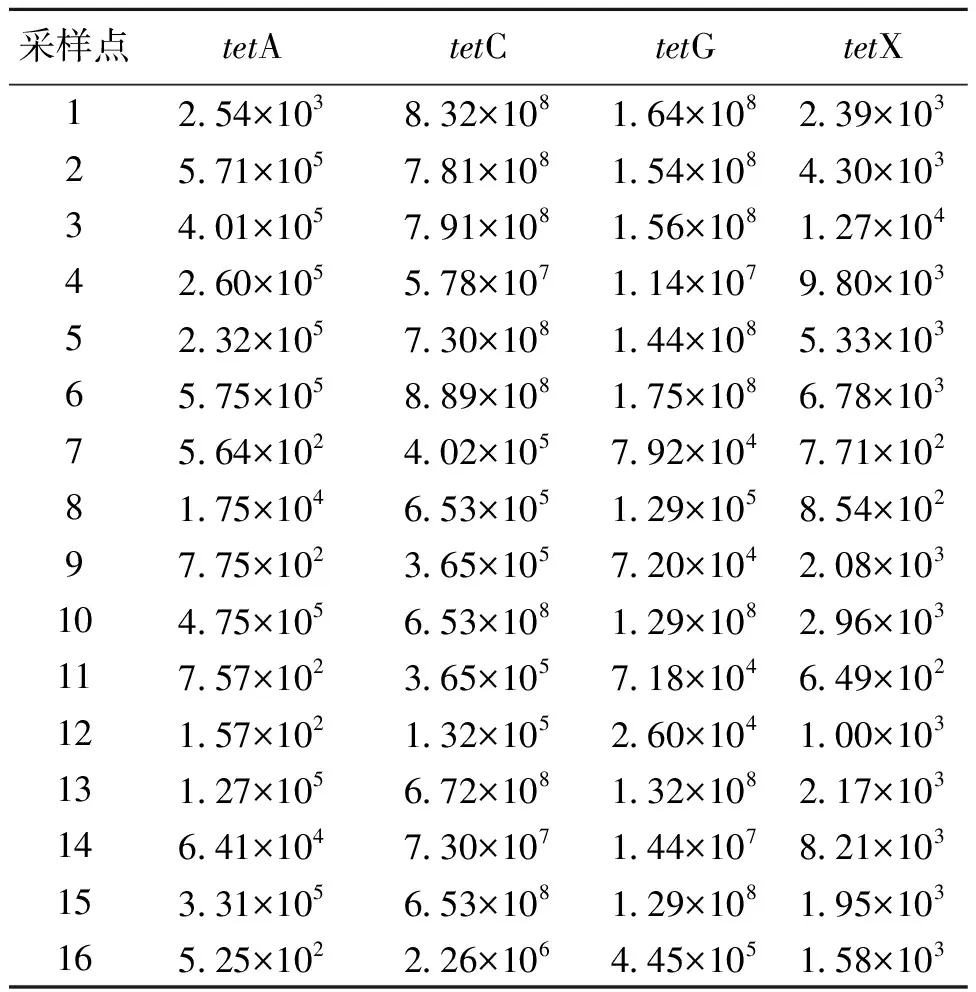
表3 tet-ARGs拷贝数与样品DNA浓度的比值(copies/g DNA)
首先,采用含有目的基因的质粒为样品,获得所对应目的基因tetA、tetC、tetG和tetX的溶解温度分别取84 ℃、84 ℃、84 ℃和78 ℃。选择某一样品对所设定的PCR反应条件及溶解温度进行预实验,通过观察溶解曲线的单峰状态,以确保该反应条件不会出现基因的非特异性扩增。tetA、tetC、tetG和tetX标准质粒的起始浓度分别为336.5、26.5、587.0和111.0 ng/μL。将质粒通过10倍系列稀释后进行实时荧光定量PCR反应,可得到以CT为纵坐标,以拷贝数及初始浓度相应关系所得基因浓度为横坐标的标准曲线。实验结果表明,所有标准曲线的R2在1~0.997之间,满足定量分析要求。通过测定ARGs的拷贝数与不同样品所得DNA浓度的比值,可以代表ARGs在样品细菌种群中总基因的含量比,亦即ARGs在环境中细菌总基因中的丰度,其结果列于表3中。从表3可知,4种tet-ARGs的丰度范围在6.49×102~8.89×108之间,其中tetC在样品中总体丰度最高(1.32×105~8.89×108),其次分别为tetG(2.60×104~1.75×108),tetA(1.57×102~5.75×105)和tetX(6.49×102~1.27×104)。在16个采样点中,tetC和tetG copies/g DNA达到108数量级以上的均达到50%。表3中7、8和9号采样点离养殖场污染源比较远(约300 m),但该3个采样点含量达到105数量级。除tetC之外,tetA和tetA在样品中含量相对较低,但所有采样点的copies/gDNA也处于102~105之间。
3 结 论
以珠海某养殖场土壤中细菌四环素抗性基因为主要研究对象,采用DNA提取、基因克隆、定性PCR和荧光定量PCR等分子生物学方法研究了9种四环素抗性基因的存在及其污染水平。结果发现,在所采集的16个土壤样品中共检出8种四环素抗性基因,样品检出率大多数在40%~94%之间;对其中常用的4种抗性基因的PCR定量分析结果表明,所有采样点中tetC和tetG的copies/g DNA达到108数量级的占50%,其余采样点tetC copies/g DNA含量也在102~105之间。与国内外其他同类研究[14],这种相对高的检出率和高抗性基因水平表明目标养殖场的抗性基因污染已十分严重,有必要进行更加广泛和深入的研究。
参考文献:
[1] MARTINEZ J L, BAQUERO F. Mutation frequencies and antibiotic resistance [J]. Antimicrob Agents Chemothe, 2000, 44: 1771-1777.
[2] MARTINEZ J L, BAQUERO F, ANDERSSON D I. Predicting antibiotic resistance [J]. Nat Rev Microbiol, 2007, 5: 958-965.
[3] LINDBERG R H, BJORKLUND K, RENDAHL P, et al. Environmental risk assessment of antibiotics in the Swedish environment with emphasis on sewage treatment plants [J]. Water Res, 2007, 41: 613-619.
[4] TSUI W H, YIM G, WANG H H, et al. Dual effects of MLS antibiotics: transcriptional modulation and interactions on the ribosome [J]. Chem Biol, 2004, 11: 1307-1316.
[5] DAVIES J. Are antibiotics naturally antibiotics? [J] Ind Microbiol Biotechnol, 2006, 33: 496-499.
[6] LINARES J F, GUSTAFSSON I, BAQUERO F, et al. Antibiotics as intermicrobial signaling agents instead of weapons [J]. Proc Natl Acad Sci USA, 2006, 103: 19484-19489.
[7] YIM G, WANG H H, DAVIES J. Antibiotics as signaling molecules [J]. PhilosTrans Royal Soc B Biol Sci, 2007, 362: 1195-1200.
[8] 罗义, 周启星. 抗生素抗性基因(ARGs):一种新型环境污染物[J].环境科学学报,2008, 28 (8):1499-1505.
[9] 杨颖. 北江水环境中抗生素抗性基因污染分析[D]. 广州:中山大学分析化学系. 2008.
[10] 朱春敬. 环境中抗生素抗性基因污染的初步研究[D].广州:中山大学分析化学系. 2008.
[11] 邹世春,朱春敬,贺竹梅,等. 北江河水中抗生素抗性基因污染初步研究[J].生态毒理学报,2009, 4 (5): 655-660.
[12] NG L K, MARTIN I, ALFA M, et al. Multiplex PCR for the detection of tetracycline resistant genes [J]. Molecular and Cellular Probes, 2001, 15: 209-215.
[13] ZHANG T, ZHANG M, ZHANG X, et al. Tetracycline resistance genes and tetracycline resistant lactose-fermenting Enterobacteriaceae in activated sludge of sewage treatment plants [J]. Environ Sci Technol, 2009, 43: 3455-3460.
[14] 吴楠,乔敏,朱永官.猪场土壤中5种四环素抗性基因的检测和定量[J].生态毒理学报,2009, 4(5): 705-710.

