过量表达鲁氏酵母耐盐基因GPD1对酿酒酵母的影响
侯丽华,于雁飞,王 川,王春玲
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
鲁氏酵母(Zygosaccharomyces rouxii)又称 S酵母,主要应用于酱油的高盐稀态发酵过程中,用以改善酱油的风味[1-2].S酵母是与模式生物酿酒酵母相近的半子囊菌酵母.鲁氏酵母可在高盐的环境中生长,比如,在酱油高盐稀态发酵工艺的后期盐水发酵中含盐量高达17%,鲁氏酵母依然能够生长及发酵[3].但是在此环境中包括酿酒酵母在内的大多数酵母都不能生长.
目前,一些关于鲁氏酵母的耐盐、耐渗的基因,如 ZrPMA1、ZrSOD2、ZrSOD22、ZrGPD1、ZrHOG1和 ZrHOG2等已经被克隆和测序[4-6].其中,GPD1即 3–磷酸甘油脱氢酶(glycerol-3-phosphate dehydrogenase)的编码基因,其编码的酶可使磷酸二羟丙酮生成 3–磷酸甘油,从而增加甘油含量,在酵母耐盐的渗透调节中发挥举足轻重的作用[7].因此,本文对鲁氏酵母的耐盐基因 GPD1进行研究,使其在模式酵母即酿酒酵母实验室菌株W303中过量表达,研究其对酿酒酵母耐盐性、甘油产量等的影响,为构建耐盐菌株奠定理论基础,为阐述酵母菌株的耐盐机制提供更多的理论依据.
1 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养基
鲁氏酵母(Zygosaccharomyces rouxii)、酿酒酵母W303(Saccharomyces cerevisiae W303,MATa,leu2-3/112,ura3-1,trp1-1,his3-11/15,ade2-1,can1-100,GAL,SUC2,mal 0)、多拷贝酵母(S. cerevisiae)与大肠杆菌(E. coli)的穿梭质粒 YEplac195(Ampr,URA3),为本实验室保存.
YPD 培养基(g/L):酵母浸粉 10,葡萄糖 20,蛋白胨 20,121,℃灭菌 20,min.其中,40%葡萄糖溶液115,℃灭菌20,min后,加入培养基中使含量达到2%.
CM-ura培养基(g/L):无氨基酸的酵母氮源(YNB)6.7,腺嘌呤0.05,组氨酸0.1,色氨酸0.1,亮氨酸0.1,精氨酸0.02,天冬氨酸0.1,谷氨酸0.1,异亮氨酸0.03,赖氨酸0.03,甲硫氨酸0.02,苯丙氨酸0.05,丝氨酸0.15,苏氨酸0.15,酪氨酸0.03,缬氨酸0.15,调节pH为6.5,加入1.5%的琼脂,121,℃灭菌 15,min.
1.1.2 试剂与仪器
十六烷基三甲基溴化铵(CTAB),北京鼎国生物技术有限公司;琼脂糖,Gene Tech(上海)有限公司;Easy Pfu DNA Polymerase、Easy Pfu 10×buffer、Ligase 10×Buffer、T4,DNA Ligase,加拿大 Fermentas生物技术公司;2.5,mmol/L dNTPs,北京全式金生物技术公司;HindⅢ内切酶、10×M Buffer、SphI 内切酶、10×H Buffer,日本东洋坊公司;腺嘌呤、组氨酸、色氨酸、亮氨酸等 15种氨基酸、无氨基酸的酵母氮源(YNB),BBI公司.
电热恒温水浴锅,北京市永光明医疗仪器厂;飞鸽牌微量离心机,上海安亭科学仪器厂;My CyclerTM PCR 仪、DYY–6C 型水平电泳仪、凝胶成像仪,美国 Bio-Rad公司;紫外分光光度计,上海精密科学仪器有限公司.
1.2 方法
1.2.1 引物设计
根据鲁氏酵母基因数据(http://www.genolevures.org/zyro.html,序号为 ZYRO0A055390g)设计引物,GDP1-up:5′-GCGCATGCGTTGTTGTTGTC ATCACTC-3'(SphI) ;GDP1-dn :5′-GCAAGCTTTT GTCTTTCTAATACAC-3′(HindⅢ).GPD1 目的片段上游引物 5′端引入 SphI酶切位点(GCATGC),下游引物 5′端引入 HindⅢ酶切位点(AAGCTT).引物由上海生工公司合成.
1.2.2 构建质粒
提取鲁氏酵母基因组,并以其为模板,以 GDP1-up和 GDP1-dn为引物作 PCR扩增(95,℃模板预变性 3,min;95,℃模板变性,55、58、60,℃引物退火1.5,min,72,℃引物延伸 2,min,共 30个循环;最后72,℃再延伸 10,min).纯化 PCR产物,并用 SphI和HindⅢ双酶切,将酶切产物连入到同样双酶切的YEplac195中,得到重组质粒YEplac195-GPD1.
1.2.3 耐盐性变化实验
分别取 200,mL灭菌后含盐量为 0、9%、18%的YPD 培养基各 3瓶,其中分别接种 106,mL–1的菌种2,mL.将上述样品置于摇床中 180,r/min、30,℃培养,每隔4,h取样测A600的值.
1.2.4 抗性实验
将待测菌株接种到 YPD液体培养基中培养(30,℃,12,h,转速<200,r/min);测 A600值,计算细胞浓度,取出约含5×106个细胞的菌液加入到1,mL新鲜培养液中活化 2,h;测 A600值,计算细胞浓度,取出约含2×106个细胞的菌液,10,000,r/min离心1,min,弃上清液;加入20,µL无菌水混匀,终浓度为1×106,µL-1.取 2,µL 加入到 18,µL 无菌水中稀释 10倍.同样方法按浓度递增顺序分别得到1×106、1×105、1×104、1×103、1×102,µL-1的菌液.每个稀释度取 3,µL菌液滴在所需平板上,超净台晾干后,30,℃倒置培养.
1.2.5 甘油产量的测定
Cu(OH)2悬浊液的配制:取 5支试管.各注入1,mL 0.05,g/mL 的 CuSO4溶液和 3.5,mL 0.05,g/mL的NaOH溶液,振荡,生成Cu(OH)2悬浊液.
甘油铜溶液的配制:向上述 Cu(OH)2悬浊液的试管中分别注入 6‰、7‰、8‰、9‰、10‰的甘油标准品溶液 0.5,mL,充分振荡,即生成甘油铜溶液,离心分离,取上清液备用;以超纯水为空白,630,nm 为测定波长.以 Cu(OH)2为横坐标,630,nm 下的吸光度为纵坐标绘制标准曲线.样品如上操作,将测得的值代入公式计算即可得出甘油产量[8].
2 结果与讨论
2.1 工程菌株的构建
将构建的质粒 YEplac195-GPD1(见图 1)转入大肠杆菌感受态细胞(TOP10)中,提取质粒后,用 SphI与 HindⅢ双酶切验证,琼脂糖凝胶电泳检测(见图2).然后将质粒 YEplac195-GPD1和空质粒 YEplac 195分别转入酿酒酵母实验室菌株W303中[9],得到工程菌株WYS和对照菌株WY.
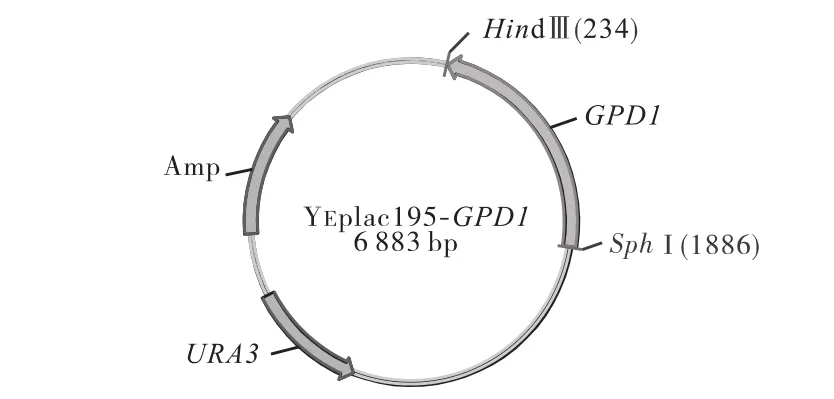
图1 质粒YEplac195-GPD1结构示意图Fig.1 Schematic view of the plasmid YEplac195-GPD1

图2 重组表达质粒的SphI 和HindⅢ双酶切鉴定Fig.2 Analysis of recombined plasmid digested by SphI and HindⅢ
2.2 耐盐性变化
对工程菌株 WYS和对照菌株 WY在含盐量为0、9%、18%的 YPD 培养基中的生长情况进行研究,实验结果如图3所示.
因为在一定浓度下,酵母细胞在 600,nm下的吸光度与细胞个数有对应关系,所以本文中通过测定不同菌株在600,nm波长下的吸光度来反映菌株的生长状况.由图 3可知,随着盐的加入,菌株 WYS和对照菌株 WY到达对数期的时间变长.这说明盐的加入,使得细胞内外渗透压发生变化,从而影响细胞增殖,导致到达对数期的时间延长且延缓对数期细胞的增殖.但是,在每个含盐量下,WYS与对照菌株 WY相比,对细胞的抗渗透压耐盐作用仍旧可以明显表现出来.
由上述分析可知,重组后的质粒 YEplac195-GPD1明显比空质粒 YEplac195促进了酵母细胞的生长,不仅表现在对数生长期的提前,而且平稳期的细胞数量也有所增加,这说明基因 GPD1对于酵母细胞耐盐性的重要作用.

图3 菌株在不同含盐量YPD培养基中的生长情况Fig.3 Growth of engineered strains in YPD culture media with different salt concentration
2.3 抗性变化
分别研究菌株 WYS和 WY 对 LiCl、盐、山梨醇、乙醇和高温的抗性,结果如图 4所示,从左到右菌体的浓度依此为 1×106、1×105、1×104、1×103、1×102,µL-1.
由图 4可见,在 LiCl、NaCl、乙醇不同程度刺激而产生的渗透压力下[2],WYS生长趋势明显优于WY,表现出了较好的耐性;对比图 4(a)和图 4(e)发现,(a)组菌落比(e)组菌落大而圆,这说明随着盐的加入,导致了细胞内水分的外流,细胞发生了质壁分离现象.而1,mol/L的山梨醇浓度对于该系列菌株来说并无太大影响.42,℃培养对两株菌株的影响基本相同,只有最高浓度才能生长,但是 WYS的生长优于WY,表明过量表达GPD1对细胞耐受热具有明显的作用.

图4 工程菌株的抗性比较Fig.4 Tolerance comparison of engineered strains
2.4 甘油产量变化
按照 1.2.5方法得到标准曲线 y=0.044,3x+0.001,3,R2=0.999,6.将工程菌株WYS和WY 分别培养在含盐量为0、9%、18%的YPD培养基中,30,℃培养.当培养至对数后期,测定细胞内外甘油产量,如图5所示.

图5 甘油产量变化Fig.5 Changes of glycerol content
由图 5可知,随着含盐量的增加,WYS和 WY菌株的甘油产量都依次增加,但增加的程度并不一致,这表明它们对环境的应答并不完全一样.对于同一菌株,随着含盐量的增加,其甘油产量也随之增加;对于同一个含盐量,WYS菌株的甘油产量高于WY,结合图 4(e)结果,这说明 WYS中过量表达GPD1使其更能适应外界渗透压的变化.
3 结 语
基因 GPD1只是耐盐通路中的一个小分支,要进一步阐明酵母菌株的耐盐机制,将需要研究此通路中的其他关键基因,如FPS1(编码甘油由胞内向胞外渗透的通道蛋白)、PMA1(编码质膜 H+-ATPase)、PDC1(编码丙酮酸脱羧酶)、ALD6(编码胞质乙醛脱氢酶)等.还需建立起一个立足点较多的基因功能网络,结合酵母的代谢网络,对酱油添加酵母的耐盐机制进行研究.此外,在本研究中只是对过量表达鲁氏酵母耐盐基因 GPD1对酿酒酵母 W303的影响进行了分析,并没有研究自身过表达 GPD1对耐盐家族成员鲁氏酵母的影响.因此在后续的研究中可以利用质粒 pZEU[10]在鲁氏酵母△ura3缺陷型菌株中过量表达耐盐基因GPD1.
[1] Murooka Y,Yamshita M. Traditional healthful fermented products of Japan[J]. Journal of Industrial Microbiology& Biotechnology,2008,35(8):791-798.
[2] Pribylova L,Montigny J,Sychrova H. Osmoresistant yeast Zygosaccharomyces rouxii:The two most studied wild-type strains(ATCC 2623 and ATCC 42981)differ in osmotolerance and glycerol metabolism[J]. Yeast,2007,24(3):171-180.
[3] Sluis C,Tramper J,Wijffels R H. Enhancing and accelerating flavour formation by salt-tolerant yeasts in Japanese soy-sauce processes[J]. Trends in Food Science &Technology,2001,12(9):322-327.
[4] Pribylova L,Papouskova K,Sychrova H. The salt tolerant yeast Zygosaccharomyces rouxii possesses two plasma-membrane Na+/H+-antiporters(ZrNha1p and Zr Sod2-22p)playing different roles in cation homeostasis and cell physiology[J]. Fungal Genetics and Biology,2008,45(10):1439-1447.
[5] Iwaki T,Higashida Y,Tsuji H,et al. Characterization of a second gene(ZSOD22)of Na+/H+antiporter from salttolerant yeast Zygosaccharomyces rouxii and functional expression of ZSOD2 and ZSOD22 in Saccharomyces cerevisiae[J]. Yeast,1998,14(13):1167–1174.
[6] Iwaki T,Kurono S,Yokose Y,et al. Cloning of glycerol-3-phosphate dehydrogenase genes(ZrGPD1 and Zr GPD2)and glycerol dehydrogenase genes(ZrGCY1 and ZrGCY2)from the salt-tolerant yeast Zygosaccharomyces rouxii[J]. Yeast,2001,18(8):737-744.
[7] Hohmann S. Osmotic stress signaling and osmoadaptation in yeasts[J]. Microbiology and Molecular Biology Reviews,2002,66(2):300-372.
[8] André L,Nilsson A,Adler L. The role of glycerol in osmotolerance of the yeast Debaryomyces hansenii[J].Journal of General Microbiology,1988,134:669-677.
[9] Schiestl R H,Gietz R D. High efficiency transformation of intact yeast cells using single stranded nucleic acids as carrier[J]. Current Genetics,1989,16(5/6):339-346.
[10] Pribylova L,Straub M L,Sychrova H,et al. Characterisation of Zygosaccharomyces rouxii centromeres and construction of first Z. rouxii centromeric vectors[J].Chromosome Research,2007,15(4):439-445.
- 天津科技大学学报的其它文章
- 枯草芽孢杆菌工程菌产耐酸性高温α-淀粉酶发酵条件的优化

