丹参注射液对脂多糖致腹膜纤维化大鼠腹膜TGF-β1、MMP9、TIMP1的影响
何伟明,高 坤,周 栋,孙 伟,盛梅笑
(江苏省中医院 肾内科,江苏 南京 210029)
腹膜透析是治疗急慢性肾哀竭的主要肾脏替代治疗方法。腹膜透析相关性腹膜纤维化是维持性腹膜透析患者常见的严重并发证,是导致腹膜超滤功能丧失,患者退出腹透治疗的重要原因。越来越多的研究发现转化生长因子(Transforming growth factor beta1,TGF-β1)、基质金属蛋白酶-9(Matrix metallopeptidase-9,MMP9)、基质金属蛋白酶抑制因子1(tissue inhibitor of metalloproteinase-1,TIMP1)等因子在腹膜纤维化的形成过程中起重要的作用[1-2]。本实验选取不同剂量丹参干预加入脂多糖的高浓度腹透液对腹膜间皮细胞分泌TGF-β1、MMP9、TIMP1的影响,探讨其可能的机制和治疗价值。
1 材料与方法
1.1 实验动物、分组及给药情况 雄性SD大鼠56只,体质量177~252 g,平均(214.34±7.17)g(由南京青龙山动物饲养厂提供,许可证号:SCXK-2001-0018)。所有实验动物作适应性喂养1周。将大鼠随机分为5组。空白组正常饲育,不加用任何药物;脂多糖组每日腹腔内直接注射4.25%PD液20 mL,并在第3、5、7、9天按0.6 mg/(kg·d)加入腹透液中;丹参低剂量组每日腹腔内直接注射含丹参6 mL/L 4.25%腹透液20 mL;丹参中剂量组每日腹腔内直接注射含丹参12 mL/L 4.25%腹透液20 mL;丹参高剂量组每日腹腔内直接注射含丹参24 mL/L 4.25%腹透液20 mL,后3组在第3、5、7、9天予脂多糖(LPS)0.6 mg/kg体质量腹腔注射。
1.2 实验用药及试剂 4.25%腹透液,由广州百特医疗公司提供;丹参注射液,规格10 mL/支,江苏高邮制药厂提供,批号991014;脂多糖,规格10 mg/支,武汉博士德生物工程有限公司;TGFB1、MMP-9、TIMP-1由北京中杉金桥生物技术有限公司提供,批号:sc-6832;IL-6由北京博奥森生物技术有限公司提供。RT-PCR试剂盒为PROMEGA产品(货号:A3500);dNTPs(货号:CBF4901A);MgCl2(货号:AB401A);rTaq PCR聚合酶(货号:DR100AM);PCR DL2000 Marker(货号:D501A)为TAKARA产品;DEPC(AMRESCO分装,E174);Tris-base(AMRESCO分装,D0194)等试剂为进口分装产品。
1.3 药物配制 脂多糖生理盐水稀释0.6 mg/100 mL,混匀备用;丹参小剂量组:丹参注射液6 mL加入每升腹透液;丹参中剂量组:丹参注射液12 mL加入每升腹透液;丹参大剂量组:丹参注射液24 mL加入每升腹透液。
1.4 造模方法 注射针头为带鞘管的7号针头,以左下腹靠近腹股沟中点为穿刺点,常规碘酒消毒后,针头与腹平面呈30~45 °夹角向右腹背部进针。模型组:按脂多糖0.6 mg/kg体质量分别在实验开始的3、5、7、9 d进行腹腔注射。药物组:取不同浓度丹参的腹透液20 mL腹腔注射,每日1次,同时按照脂多糖0.6 mg/kg体质量分别在实验开始的3、5、7、9 d同步进行腹腔注射。
1.5 标本留取 5组大鼠于实验第28天,10%水合氯醛(35 mg/kg)肌注麻醉,左上腹壁避开注射部位取壁层腹膜组织、膈腹膜及肠系膜组织用10%中性甲醛固定,石蜡包埋用于常规、特殊染色及免疫组化检测。
1.6 引物 根据网上NCBI数据库中各自基因序列设计而获得,序列如下,由上海博亚生物技术有限公司合成:β-actin:548 bp 上游引物:5’-GTTGTCCCTGT
ATGCCTCTG-3’ 下游引物:5’-GGAGCCAGGGCAGTA
ATCT- 3’ TGF-β1:682 bp 上游引物:5’-CTTGCTGTACTGTGTGTCCAG-3’ 下游引物:5’-TAATGGTGGACCGCAACAACG-3’ MMP-9:248 bp 上游引物:5’-TTT
TGCTCGGGCCTTAAAA-3’ 下游引物:5’-CATACTTTACGCGGACCACTT-3’ TIMP-1:310 bp 上游引物:5’-GCCATGGAGAGCCTCTGTGG-3’ 下游引物:5’-GCAGGCAGGCAAAGTGATCG-3’。
1.7 大鼠腹膜组织提取总RNA及纯度鉴定 每组加入2 mL trizol试剂,组织匀浆器中匀浆后,移入1.5 mL离心管中。室温静置5 min。4 ℃、12 000 r/min离心10 min。每管加入0.2 mL氯仿,振荡混合液15 s,室温放置3 min。4 ℃、12 000 r/min离心15 min。将水相转移至一离心管内,加入等体积异丙醇,充分混匀,-20 ℃放置1 h。4 ℃、12 000 r/min离心10 min。弃上清,加入75%乙醇1 mL,4 ℃、7 500 r/min离心5 min。超净台内弃乙醇上清,自然干燥,加入无酶水,轻振荡使溶解,离心、混匀,转入-80 ℃保存。
总RNA纯度鉴定:取出各组总RNA少量,核酸蛋白定量仪(德国EPPENDORF公司,EPPENDORF)检测各组总RNA浓度及纯度,各组总RNA纯度A260/280值在1.95~2.0之间。
1.8 RT-PCR反应
1.8.1 RT反应 1)取0.6 mL离心管,每管内加入随机引物2 μL,总RNA 1.0 μg。混匀,70 ℃孵育10 min。2)每管加样:MgCl2(25mM)4 μL,RT 10×Buffer 2μL,dNTPs(10 mM)2 μL,RNasin Inhibiter 0.5 μL,AMV逆转录酶0.5 μL,加水至总体积20 μL。PCR扩增仪(英国HYBAID公司,HYBAID EXPRESS):42 ℃1 h;95 ℃10 min;4 ℃保存。
1.8.2 PCR反应 1)25 μL PCR(β-actin)反应液如下:dNTPs(10 mM)0.5 μLM,MgCl2(25 mM)2.5 μL,r Taq PCR10×Buffer 2.5 μL,上游引物P1(10 μM)1.0 μL,下游引物P2(10 μM)1.0 μL,r Taq DNA聚合酶0.3 μL,cDNA第一链合成液5 μL,无酶水12.2 μL,总体积25 μL。反应程序:94 ℃ 3 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 60 s,30个循环;72℃ 7 min;4℃保存。2)25 μL PCR(TGF-β1)反应液如下:dNTPs(10 mM)0.5 μL,MgCl2(25 mM)2.5 μL,r Taq PCR10×Buffer 2.5μL,上游引物P1(10 μM)1.0 μL,下游引物P2(10 μM)1.0 μL,r Taq DNA聚合酶0.3 μL cDNA第一链合成液5 μL,无酶水12.2 μL,总体积25 μL。反应程序:94 ℃ 3 min;94℃ 30s,57 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃7 min;4 ℃保存。3)25 μL PCR(TIMP-1)反应液如下:dNTPs(10 mM)0.5 μL,MgCl2(25 mM)2.5 μL,r Taq PCR10×Buffer 2.5 μL,上游引物P1(10 μM)1.0 μL,下游引物P2(10 μM)1.0 μL,r Taq DNA聚合酶0.3 μL,cDNA第一链合成液15 μL,总体积25 μL。反应程序:94 ℃ 3 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 60 s,30个循环;72 ℃ 7 min;4 ℃保存。4)25 μL PCR(MMP-9)反应液如下:dNTPs(10 mM)0.5 μL,MgCl2(25 mM)2.5 μL,r Taq PCR10×Buffer 2.5 μL,上游引物P1(10 μM)1.0 μL,下游引物P2(10 μM)1.0 μL,r Taq DNA聚合酶0.3 μL,cDNA第一链合成液15 μL,总体积25 μL。反应程序:94 ℃ 3 min;94 ℃ 45 s,58 ℃ 45 s,72 ℃ 60 s,30个循环;72 ℃ 7 min;4 ℃保存。
1.9 PCR产物电泳 1.6%琼脂糖凝胶电泳:0.24 g琼脂糖凝胶+30 mL 0.5×TBE,加热溶解,加入EB,混匀后倒平板。Marker为PCR DL 2000(TAKARA产品)。加5.0 μL PCR扩增液(TGF-β1加8.0 μL PCR扩增液)电泳,80 V电泳40 min。Alpha Imager 2 000凝胶图象系统(美国2000公司)对凝胶进行拍照、光密度数据分析。
1.10 实验结果评估 免疫组化标记:各组指标均定位于细胞浆,以细胞浆着色呈棕黄色为阳性细胞,参照Watanabe等免疫组织化学评分标准,采用双盲法,通过评分对它们的染色强度进行分级。根据腹膜组织中间皮细胞免疫组织化学染色的深浅和阳性细胞百分数对每个切片逐一评分,取其平均值为该片染色强度。
染色强度评分标准:阳性细胞百分数<5%、未被染色为阴性(-),5%~20%、浅棕色为弱阳性(+),21%~50%、棕色为阳性(++),51%~75%、深棕色为阳性(+++),>75%、棕褐色为强阳性(++++)。为了统计方便,予以半定量计分:0、1、2、3、4。分别对应-、+、++、+++、++++。

2 结果
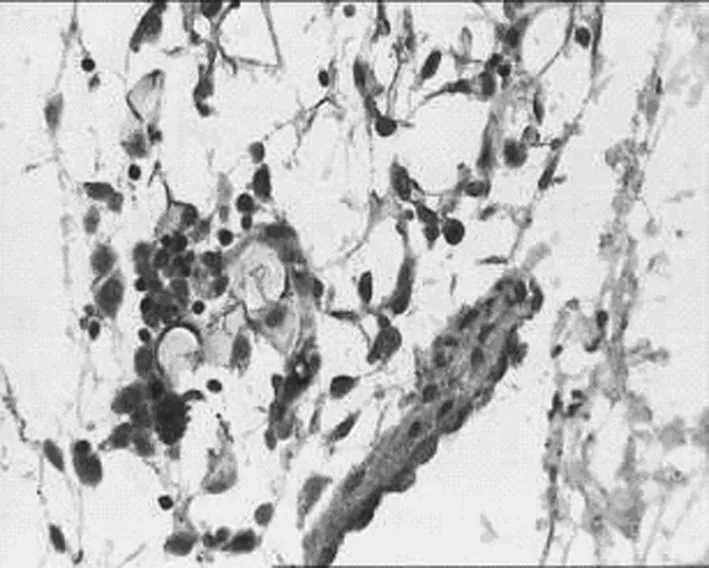
2.1 对腹膜组织TGF-β1表达的影响 见表1,图1,表2,图2。
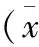
表1 腹膜组织TGF-β1 mRNA(/β-actin)表达值±s,n=6)
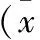
表2 各组大鼠TGF-β1光密度积分结果±s,n=6)
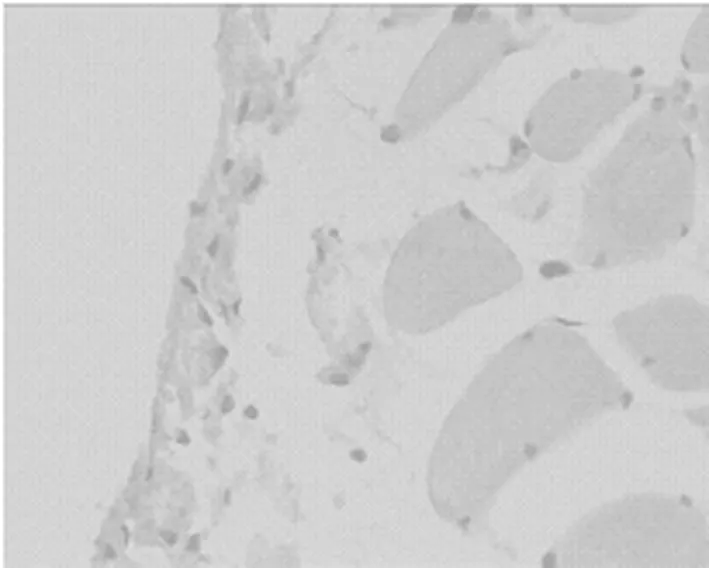
2.2 对腹膜组织MMP-9表达的影响 见表3,图3,表4,图4,图5。
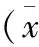
表3 腹膜组织MMP-9 mRNA(/β-actin)表达值±s,n=6)
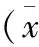
表4 MMP9光密度积分结果±s,n=6)
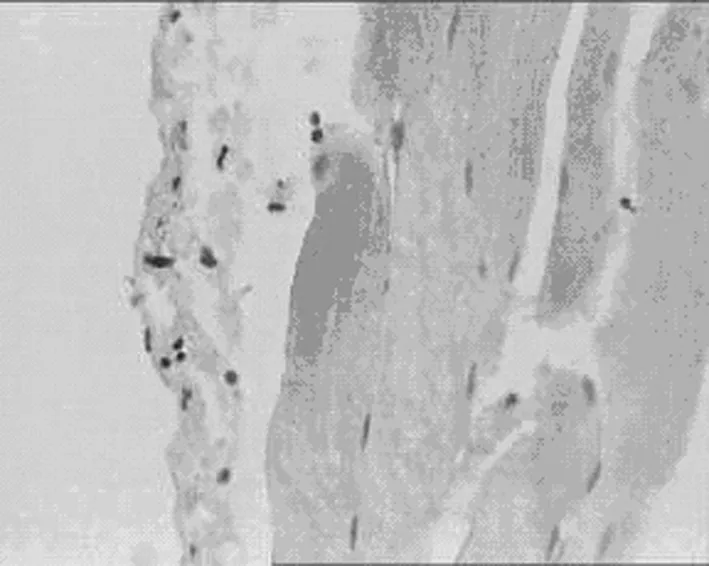
2.3 对腹膜组织TIMP-1表达的影响 见表5,图6,表6,图7。
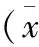
表5 腹膜组织TIMP-1 mRNA(/β-actin)表达值±s,n=6)
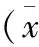
表6 TIMP-1光密度积分结果±s,n=6)
3 讨论
腹膜透析目前已经广泛应用于终末期肾脏疾病的替代治疗。随着治疗时间延长,腹膜转运功能衰竭已成为透析技术性失败的最重要的原因[2]。如何有效提高腹膜透析的透析效能、保护腹膜功能是当前临床工作者所面临的一个重大课题。丹参主要成分为丹参酮和丹参素,是重要的活血化瘀药物,具有扩张血管、改善微循环,使血流速度加快,提高跨毛细血管超滤的作用。已有动物试验[3]证实丹参可保护腹膜间皮层结构的完整,拮抗Ca2+内流,减弱淋巴管的收缩,从而减少了腹腔淋巴回流使净超滤量增加。
TGF-β1是一种调节细胞生长和分化的生长因子,是胶原纤维和其他细胞外成分合成和沉积的强有力的始动因子[1]。高渗性葡萄糖刺激腹膜间皮细胞产生TGF-β1增加,呈剂量依赖性[3]。TGF-β1可以促进间质细胞如腹膜间皮细胞、成纤维细胞及成骨细胞等的增殖,不仅促进细胞外基质(ECM)成分沉积,同时又抑制其降解。TGF-β1还可通过下调组织纤溶酶原激活剂(tPA)和纤溶酶原激活剂抑制剂-1(PAI-1)的比例而降低机体纤溶能力[4-5]。TGF-β1诱导VEGF因子产生,腹膜新生血管生成增加,最终导致腹膜纤维化的形成,腹膜失超滤[5]。因此针对TGF-β1研究成为防治腹膜纤维化的新的治疗靶点。本实验研究发现,丹参注射液加入腹透液中,中剂量及高剂量组均可下调TGF-β1的表达,与模型组相比具有统计学意义(P<0.05),从而抑制腹膜纤维化的产生。
MMPS及TIMPS的功能紊乱与ECM过多堆积密切相关,是调节ECM动态平衡的最重要的一大酶系[6]。MMPs的主要生理性抑制剂是内源性的TIMPS。TIMPS可与MMPs以非共价键形式生成1∶1复合物,对活性MMPS具有专一的抑制作用。MMPS和TIMPS活性的精确平衡对ECM成分的完整非常重要,二者之间的平衡共同实现着对胶原合成与降解稳态的调控[7]。已发现20种MMPs,其中MMP-9又称明胶酶B,主要降解明胶、Ⅳ、Ⅴ、Ⅶ型胶原及层黏连蛋白、蛋白聚糖及弹性蛋白等,能降解完整的基底膜[8],TIMP-1作为MMP-9特异性抑制物,可特异性地与相应MMP催化活性中心的锌离子结合封闭其催化活性,阻断其对细胞外基质的降解作用,引起细胞外基质的积聚。
本研究显示,丹参各剂量组均可上调MMP-9 mRNA的表达(P<0.05),下调TIMP-1 mRNA的表达(P<0.05)。提示丹参能抑制TGF-β1的表达,上调MMP-9,下调TIMP-1,调节MMP-9/TMIP-1之间的平衡,干预ECM的重塑从而干预腹膜纤维化。丹参注射液对大鼠腹膜纤维化比模型组显著减轻,其机制可能通过保护腹膜间皮细胞,抗炎、抗纤维化、抗氧自由基,并具有抑制TIMP-1表达,上调MMP9的作用[9]。

1.正常组 2.模型组 3.丹参低剂量组 4.丹参中剂量组 5.丹参高剂量组

A正常组
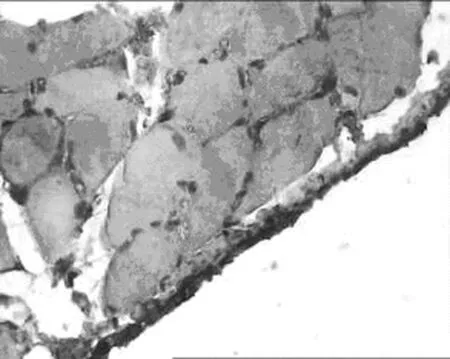
B模型组

C丹参低剂量组
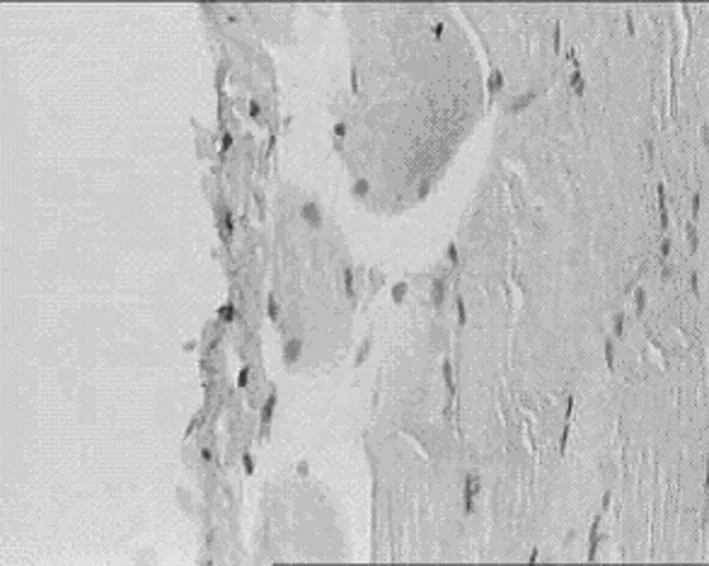
D丹参中剂量组

E丹参高剂量组

1.正常组 2.模型组 3.丹参低剂量组 4.丹参中剂量组 5.丹参高剂量组

A正常组

B模型组

C丹参低剂量组
D丹参中剂量组
E丹参高剂量组

A正常组

B模型组

C丹参低剂量组
D丹参中剂量组

E丹参高剂量组

1.正常组 2.模型组 3.丹参低剂量组 4.丹参中剂量组 5.丹参高剂量组

A正常组

B模型组

C丹参低剂量组

D丹参中剂量组

E丹参高剂量组
本研究提示丹参加入腹膜透析液中具有一定的拮抗腹膜纤维化的作用。
[1]Shin GT,Kim SJ,Ma KA,et al.ACE inhibitors attenuate expression of renal transforming growth factor-beta1 in humans[J].Am J Kidney Dis,2000,36:894-902.
[2]Nakamoto H,Kawaguchi Y,Suzuki H.Is technique survival on peritoneal dialysis better in Japan[J].Perit Dial Int.2006,26(2):136-143.
[3]朱桂松,何劲松.中医药在腹膜透析相关性腹膜纤维化防治中的应用[J].长春中医药大学学报,2008,24(5):519.
[4]池泉,黄文政,江妙津.肾素-血管紧张素系统与肾脏固有细胞表型转化的关系[J].长春中医药大学学报,2007,23(4):450-451.
[5]Medcalf JF,Walls J,Pawluczyk IZ,et al.Effects of glucose Dialysate on extracellu-lar matrix production by human peritoneal mesothelial cells (HPMC):The role of TGF-beta[J].Nephrol Dial Transplant,2001,16(9):1885-1892.
[6]Naiki Y,Maeda Y,Matsuo K,et al.Involvemene of TGFbeta signal for peritoneal sclerosing in coninuonus ambulatory peritoneal dialysisl[J].J Nephrol,2003,16(1):95-102.
[7]Shih SC,Ju M,Liu N,et al.Transforming growth factor betal induction of vascular growth factor receptor 1:Mechanism of pericyte in duced vascular suvival in vivo[J].Proc Natl Acad Sci USA,2003,100(26),15859-15864.
[8]Brew K,Dinak arpandian D,Nagase H.Tissue in hibitors of metal oproteinases:evolution,structure and function[J].Biochim Biophys Acta,2000,1477:267-283.
[9]杨振,郑友兰,洪铁.丹参黄芪提取物对大鼠血管内皮损伤的保护作用[J].长春中医药大学学报,2010,26(2):183-184.

