微创单侧入路双侧减压治疗腰椎椎管狭窄症早期疗效观察
吴文坚,梁 裕,张兴凯,曹 鹏,郑 涛
对于有症状的腰椎椎管狭窄症,后路切开减压内固定融合术疗效确切,但由于广泛的软组织剥离可能导致术后的疼痛,影响患者的功能恢复[1]。因此如何在保证手术有效性的前提下,减少组织的损伤是摆在脊柱外科医生面前的一个课题。
1988年,Young等[2]首先提出微创单侧入路进行双侧减压技术,此后McCulloch等[3]对于该技术进行了改良。应用该技术,通过单侧入路可充分解除硬膜囊和双侧神经根的压迫。本研究中将比较微创单侧入路双侧减压结合微创经椎间孔椎体间融合术与切开双侧减压内固定融合术2种方法治疗腰椎椎管狭窄症的疗效。
1 资料与方法
1.1 一般资料
2010年6~10月,38例节段腰椎椎管狭窄症患者接受手术治疗,所有患者均主诉腰痛伴双下肢疼痛或麻木,伴或不伴间歇性跛行,经CT和/或MRI确认均为单节段或双节段腰椎椎管狭窄,伴或不伴有Ⅰ或Ⅱ度退变性滑脱,非手术治疗>3个月无效。排除标准包括双侧椎间盘突出而需要进行双侧椎间盘切除的患者,以及峡部性腰椎滑脱伴双侧神经根损伤症状而需要进行双侧充分减压的患者。由患者选择进行微创或切开手术,所有手术均由同一组资深脊柱专科医师完成。
1.2 微创经椎间孔椎体间融合术的手术技术和术后处理
患者取俯卧位,选取症状较重一侧作为手术的入路。如果两侧症状相近,则选取影像学资料显示压迫更严重的一侧进入。
C形臂X线机透视定位,以目标椎体间隙与小关节外侧缘连线的交点为中心,做纵行切口。单节段手术切口长3.0~3.5 cm,双节段手术切口长4.0~5.0 cm。纵向切开深筋膜,从多裂肌与最长肌间隙进入,依次放入软组织扩张器,置入Pipeline管道和光源(DePuy Spine,USA)并固定好,再次透视确认手术间隙。以骨刀切除下关节突及部分上关节突,咬除黄韧带,暴露、牵开硬膜囊和神经根,切除同侧致压的椎间盘、黄韧带和增生骨赘。牵开硬膜囊和神经根,依次置入椎体间撑开器撑开椎间隙,刮除软骨终板,置入带自体松质骨的单枚合适大小的腰椎椎体间融合器(OIC,Stryker,USA)。
完成一侧减压以后,将手术床向对侧倾斜约15°,调整管道牵开器的方向,用骨刀切除部分棘突基底部,潜行切除对侧椎板腹侧部分、黄韧带及增生骨赘,确认对侧神经根游离度良好,实现充分减压。
完成减压后,于透视下经皮置入双侧椎弓根螺钉和连接棒,缝合切口。
切口一般无需放置引流管,手术后第1天复查X线片,若患者耐受,即可佩戴腰围下床活动。
1.3 观察和随访项目
分别记录患者每节段的手术时间,术中出血量和引流量,术后住院时间,及并发症情况。
以视觉模拟量表(visual analog scale,VAS)评分[4]评估患者手术前后腰痛的情况,以日本骨科学会(Japanese Orthopaedic Association,JOA)评分[5]评估患者手术前后的功能,并根据以下公式计算手术的JOA改善率:JOA改善率=(末次随访时JOA评分-术前JOA评分)/(29-术前JOA评分)×100%。
1.4 统计学方法
2 结 果
所有患者平均随访7.6个月(6~10个月)。所有患者伤口均Ⅰ期愈合。
2.1 一般情况
微创组患者17例,开放组患者21例。2组患者性别组成、年龄和手术节段见表1。2组患者间性别、平均年龄、双节段患者所占比例的差异均无统计学意义(P>0.05)。

表1 2组患者一般资料Tab.1 General information of both groups
2组患者术中出血量、手术时间和术后平均住院时间见表2。微创组患者节段平均出血量明显少于开放组,手术时间明显较开放组长,而术后住院时间明显较开放组短。
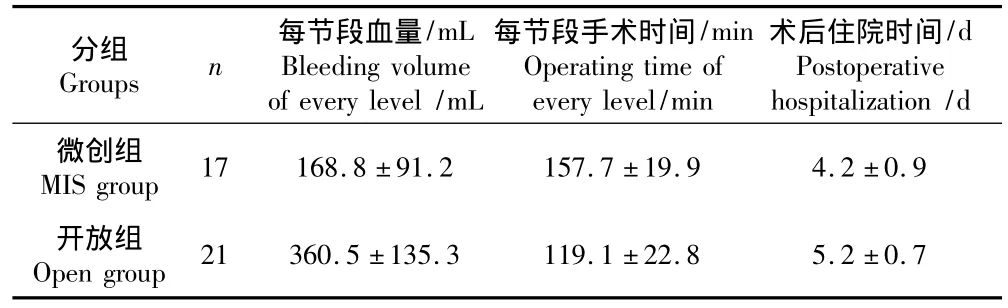
表2 两组患者出血量、手术时间和术后住院时间Tab.2 Bleeding volume,operating time and hospitalization of both groups
2.2 疼痛与功能恢复情况
患者术前及随访时的腰痛 VAS评分及功能JOA评分见表3。2组患者术前腰痛程度和JOA评分差异无统计学意义(P>0.05)。2组患者术后腰痛均有显著改善(P<0.05),微创组末次随访时疼痛评分明显低于开放组(P<0.05)。2组患者手术后功能均有明显改善;微创组患者术前JOA评分、随访时JOA评分及JOA改善率均明显高于开放组(P<0.05)。
2.3 并发症发生情况
微创组患者中有3例出现围手术期并发症,其中2例硬膜撕裂,但均未出现脑脊液漏;1例由于螺钉位置不佳而导致术后早期出现神经根刺激症状,经对症治疗后缓解。开放组没有患者出现并发症。微创组患者并发症发生率略高于开放组但差异无统计学意义(P>0.05)。微创组患者典型病例影像学资料见图1。
3 讨 论
对于腰椎椎管狭窄症,后路切开减压内固定融合术可有效地解除神经压迫,重建脊柱的排列和稳定性。为了获得充分的暴露和减压,传统的后路切开减压内固定融合术常需要进行广泛的软组织和椎板切除,特别是对于需要进行双侧减压的患者。软组织的损伤导致手术的出血增多,加重术后疼痛,延迟术后恢复的时间。同时由于棘旁肌的剥离和医源性损伤,可能导致术后疼痛和肌肉的缺血、萎缩,影响术后的功能[6]。而椎板切除后硬膜外疤痕的形成更可能导致神经的再压迫,影响手术的疗效[7]。

表3 2组患者手术前后腰痛及功能评分比较Tab.3 VAS of low back pain and JOA scores of 2 groups

图1 微创组患者影像学资料Fig.1 Radiologic data of a typical patient in MIS group
近年来,微创技术越来越多的应用于脊柱疾病的手术治疗。微创脊柱外科手术的目标在于保证开放手术目的的前提下,通过微创管道或者显微镜等技术减少对周围软组织和骨性组织的创伤和破坏,最大程度地保留脊柱的节段稳定性,减少术后的疼痛,加快术后的功能恢复[1,8-9]。
微创单侧入路双侧减压技术最早由Young等[2]提出,并由 McCulloch 等[3]进行了改良。对于双侧腰椎椎管狭窄并有相应神经压迫症状的患者应用该技术,借助于微创管道不但可以进行同侧的减压、固定及进行经椎间孔椎体间融合,还可以潜行切除对侧黄韧带、椎板及增生的小关节,达到扩大中央椎管和减压对侧神经根的目的[10]。该技术在进行同侧减压时选取了多裂肌与最长肌之间的Wiltse入路,减少了同侧的软组织剥离和损伤,同时避免了棘间韧带和棘上韧带损伤,也避免了对侧多裂肌等的剥离,达到腰椎椎管狭窄症减压的微创化。Oertel等[11]报道应用该技术治疗102例腰椎椎管狭窄症患者,随访4~10年(平均5.6年)后优良率为85.3%,再手术率为11.8%。Cavuşolu等[12]报道术后4年患者的优良率为68%。本组患者中,无论是开放还是微创手术,术后患者的功能均较术前显著改善;而微创手术组患者术后腰痛程度明显低于开放手术组患者,功能的评分也优于开放手术组患者;微创组患者手术出血量明显较少,术后住院时间也明显较短,这都说明微创手术能够达到至少与开放手术一样的临床效果,且由于对于软组织的创伤较小,患者的术后恢复也较快,短期功能恢复较好。
相对于开放手术而言,微创手术术野较小,对于医师的手术技术要求较高,特别是经单侧入路双侧减压手术难度更高,手术风险更大,手术医生的学习曲线更为陡峭[13]。本组患者的手术医师均为资深脊柱专科医师,有10年以上的切开手术的经验,且有20例以上的微创经椎间孔椎体间融合术的经验积累。即便如此,微创手术组患者的手术时间明显较长,且并发症的发生率也较高,这与微创手术的特点有关,也与术者仍然处于学习曲线的过程中有关。
选择合适的患者是手术成功的关键。微创单侧入路双侧减压主要通过潜行切除增生的椎板、黄韧带、小关节达到扩大椎管容积,解除神经压迫的目的,该技术对于多数单纯的腰椎椎管狭窄患者均可适用[14]。但是通过单侧入路不可能进行对侧椎间盘的直接切除,因而并不适用于双侧椎间盘明显突出而需要进行双侧椎间盘切除的患者,对于此类患者,可以考虑双侧入路进行减压和内固定。对于峡部性腰椎滑脱,有学者应用微创技术进行手术治疗获得良好的疗效[15],但有部分患者有双侧神经根损伤症状而需要双侧入路切除峡部局部的疤痕组织,以达到充分减压的目的,对于此类患者并不适用该技术。
本研究为前瞻性研究,但例数相对较少,且由于患者经济条件和伦理的因素,不可能进行随机分组,从最后分组的结果来看,开放手术组患者症状和病情均较微创手术组略为严重,这是本研究的局限性。此外,本研究为短期随访的结果,对于微创单侧入路双侧减压与切开手术之间长期疗效的差异,有待于进一步的随访研究。
综上所述,微创单侧入路双侧减压结合微创经椎间孔椎体间融合术治疗单节段或双节段腰椎椎管狭窄症短期疗效满意,相对于开放手术而言,微创手术出血量较少,术后疼痛较轻,术后住院时间较短,恢复较快,但手术时间更长,放射线暴露也更多,该技术的长期疗效有待进一步随访明确。
[1] Oppenheimer JH,DeCastro I,McDonnell DE.Minimally invasive spine technology and minimally invasive spine surgery:a historical review[J].Neurosurg Focus,2009,27(3):E9.
[2] Young S,Veerapen R,O’Laoire SA.Relief of lumbar canal stenosis using multilevel subarticular fenestrations as an alternative to wide laminectomy:preliminary report[J].Neurosurgery,1988,23(5):628-633.
[3] McCulloch JA,Young PH.Essentials of spinal microsurgery[M].Philadelphia,PA:Lippincott-Raven,1998.
[4] Huskisson EC.Measurement of pain[J].Lancet,1974,2(7889):1127-1131.
[5] Fukui M,Chiba K,Kawakami M,et al.Japanese Orthopaedic Association Back Pain Evaluation Questionnaire.Part 2.Verification of its reliability:The Subcommittee on Low Back Pain and Cervical Myelopathy Evaluation of the Clinical Outcome Committee of the Japanese Orthopaedic Association[J].J Orthop Sci,2007,12(6):526-532.
[6] Schizas C,Tzinieris N,Tsiridis E,et al.Minimally invasive versus open transforaminal lumbar interbody fusion:evaluating initial experience[J].Int Orthop,2009,33(6):1683-1688.
[7] Schoeggl A,Maier H,Saringer W,et al.Outcome after chronic sciatica as the only reason for lumbar microdiscectomy[J].J Spi-nal Disord Tech,2002,15(5):415-419.
[8] 池永龙,王向阳.对微创外科技术治疗脊柱疾患的一些看法[J].脊柱外科杂志,2012,10(1):1-2.
[9] 王文军,薛静波,晏怡果,等.单侧微创经椎间孔腰椎椎体间融合内固定治疗腰椎退变性疾病[J].脊柱外科杂志,2012,10(1):9-12.
[10] Toyoda H,Nakamura H,Konishi S,et al.Clinical outcome of microsurgical bilateral decompression via unilateral approach for lumbar canal stenosis:minimum five-year follow-up[J].Spine(Phila Pa 1976),2011,36(5):410-415.
[11] Oertel MF,Ryang YM,Korinth MC,et al.Long-term results of microsurgical treatment of lumbar spinal stenosis by unilateral laminotomy for bilateral decompression[J].Neurosurgery,2006,59(6):1264-1269.
[13] Peng CW,Yue WM,Poh SY,et al.Clinical and radiological outcomes of minimally invasive versus open transforaminal lumbar interbody fusion[J].Spine(Phila Pa 1976),2009,34(13):1385-1389.
[14] Weiner BK,Walker M,Brower RS,et al.Microdecompression for lumbar spinal canal stenosis[J].Spine(Phila Pa 1976),1999,24(21):2268-2272.
[15] Wang J,Zhou Y,Zhang ZF,et al.Comparison of one-level minimally invasive and open transforaminal lumbar interbody fusion in degenerative and isthmic spondylolisthesis grades 1 and 2[J].Eur Spine J,2010,19(10):1780-1784.

