ICU病区泛耐药的鲍曼不动杆菌碳青霉烯类药物耐药基因分析
陈士华 魏取好 吕火烊
泛耐药(pandrug-resistant,PDR)是指分离菌株对临床常用的绝大多数抗菌药物均耐药的菌株。鲍曼不动杆菌(Acinetobacter baumannii,AB)特别是泛耐药的鲍曼不动杆菌(pandrug-resistant Acinetobacter baumannii,PDR-AB)是院内定植及导致难治性医院感染的主要病原体[1,2]。随着广谱或超广谱抗菌药物的广泛及不协规范的使用,导致PDR-AB发生率增高,PDR-AB的耐药机制复杂,且多种耐药机制共存,常见的包括β-内酰胺酶特别是碳青霉烯酶的产生、药物作用靶位的改变、外膜通透性下降及药物主动外排等等。近年来,研究表明PDR-AB对碳青霉烯类抗菌药物的耐药主要其产生多动碳青霉烯类酶,如blaVIM、blaNDM-1和blaIMP和OXA酶,而其中最为多见的为OXA酶。OXA酶可分为4个族,第1族是blaOXA-23,第2族是blaOXA-24,第3族是blaOXA-51和第4族blaOXA-58,其中第1族和第4族是由质粒介导,而中间2和3族是由染色体介导[3]。本研究对近2年分离自笔者医院的20株PDR-AB进行了耐药性及耐药基因的检测,现报道如下。
材料与方法
1.菌株来源:2009年1月~2010年12月从笔者医院ICU病区分离的泛耐药的鲍曼不动杆菌(pandrug-resistant Acinetobacter baumannii,PDR-AB)20株,所有菌株均由Vitek-32全自动微生物鉴定系统鉴定及药物敏感性试验筛查。质控菌株大肠杆菌ATCC 25922,铜绿假单胞菌ATCC27853购自卫生部临床检验中心。
2.仪器与试剂:全自动微生物鉴定系统Vitek-32及配套试剂革兰阴性杆菌鉴定卡(GNI+);哌拉西林(piperacillin,PIP)、哌拉西林/他唑巴坦(piperacillin/tazobactam,TZP)、头孢噻肟(cefotaxime,CTX)、头孢他啶(ceftazidime,CAZ),头孢曲松(ceftriaxone,CRO),头孢吡肟(cefepime,FEP),头孢哌酮/舒巴坦(cefoperazone/sulbactam,CPS),亚胺培南(imipenam,IMP),美罗培南(meropenem,MEM),庆大霉素(gentamycin,GEN),阿米卡星(amikacin,AMK),环丙沙星(ciprofloxacin,CIP),米诺环素(minocycline,MIN),复方新诺明(trimethoprim-sulfamethoxazole,SXT)和多黏菌素B(polymyxin B,POB)E-试条均购自法国梅里埃公司;PE-9700 PCR仪(美国ABI公司);Eppendorf 5417R高速离心机(德国艾本得); Bio-Rad GelDoc凝胶电泳成像分析系统 (美国伯乐公司); MH琼脂干粉购自英国OXIOD公司;PCR通用试剂盒EmeraldAmpTMPCR Master Mix及DNA分子质量标准 DL2000TMDNA Marker均为宝生物工程(大连)有限公司新产品,各种耐药基因引物由生工生物工程(上海)有限公司合成,其序列见表1。
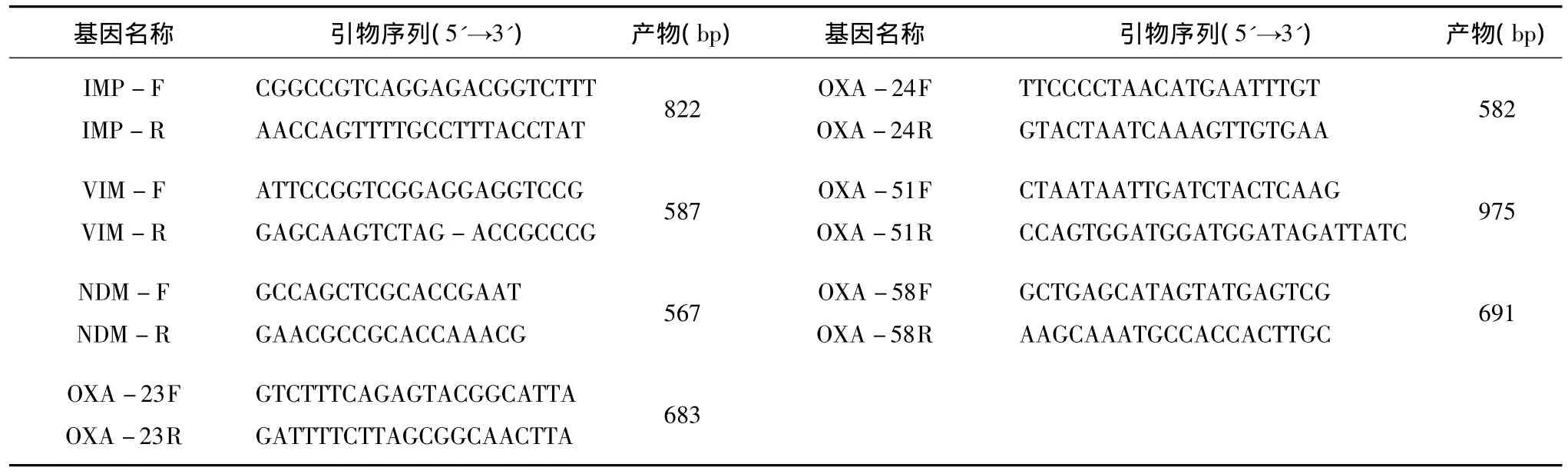
表1 PCR扩增基因种类引物序列及产物大小(bp)
3.菌株鉴定及抗菌药物的耐药性试验:按全自动微生物鉴定系统Vitek-32及配套试剂革兰阴性杆菌鉴定卡(GNI +)使用说明书对菌株进行鉴定;哌拉西林(PIP)、哌拉西林/他唑巴坦(TZP)、头孢噻肟(CTX)、头孢他啶(CAZ),头孢曲松(CRO),头孢吡肟(FEP),头孢哌酮/舒巴坦(CPS),亚胺培南(IMP),美罗培南(MEM),庆大霉素(GEN),阿米卡星(AMK),环丙沙星(CIP),米诺环素(MIN),复方新诺明(SXT)和多黏菌素B(POB)的耐药性检测用浓度梯度法(E-试条法),其耐药性解释标准(除CPS)参照CLSI2011中关于不动杆菌属的规定[4];CPS的解释标准参照辉瑞公司建议的标准(MIC值:≤16 S,32 I,≥64 R)。
4.耐药基因检测:模板DNA的提取各种靶基因PCR扩增检测参加文献进行略作修改[5]。具体为:每反应体系P1引物1μl(1.0μmol/L)、P2引物 1μl(1.0μmol/L),dNTPs 2μl (2mmol/L),10倍缓冲液2μl[KCl 10mmol/L,(NH4)2SO48mmol/L,MgCl22mmol/L,Tris-HCl(pH9.0)10mmol/L,NP400.5%,BSA 0.02%(wt/vol)],Taq DNA pol1U(不计体积),超纯水9μl,模板液5μl,总反应体积20μl。PCR扩增热循环参数均为:94℃预变性2min,然后94℃ 60s→50℃ 60s→72℃ 60s,循环35周期,最后1个72℃延长至5min。产物经2%琼脂糖凝胶电泳,出现与阳性对照分子相当的目的条带为阳性。
结果
1.抗菌药物浓度梯度法检测结果:20株PDRAB对PIP、TZP、CTX、CAZ、CRO、FEP、CPS、IMP、MEM、GEN、CIP的耐药率均为100%;AMK的耐药率55%,MIN的耐药率70%,SXT的耐药率80%,POB的耐药率为0%;各菌株的详细结果见表2。
2.耐药基因PCR扩增结果:20株PDR-AB株,检测blaOXA-23、blaOXA-24、blaOXA-51、blaOXA-58、blaVIM、blaNDM-1和blaIMP 7种耐药基因,检测blaOXA-23、blaVIM和blaIMP基因阳性9株,阳性率45%;blaOXA-23阳性,6株,占阳性菌株中的66.7%(6/9),分别为1号、5号、6号、9号、12号和17号菌株;blaVIM阳性2株,占阳性菌株中的22.2%(2/9),分别为2号和15号菌株;blaIMP阳性1株,为19号菌株。20株 PDR-AB PCR扩增blaOXA-23基因电泳结果见图1。
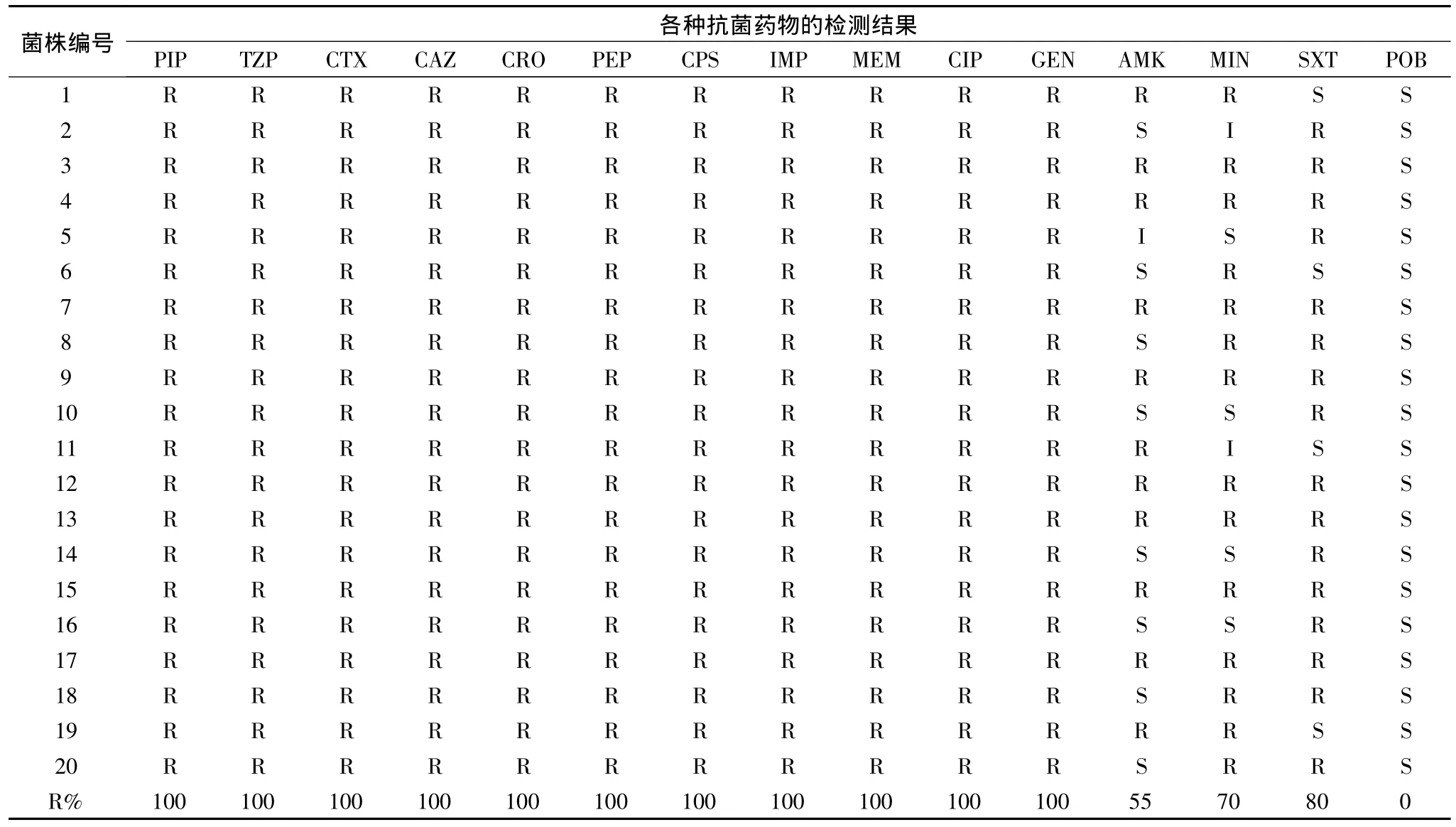
表2 20株PDR-AB对15种抗菌药物耐药性的体外检测结果
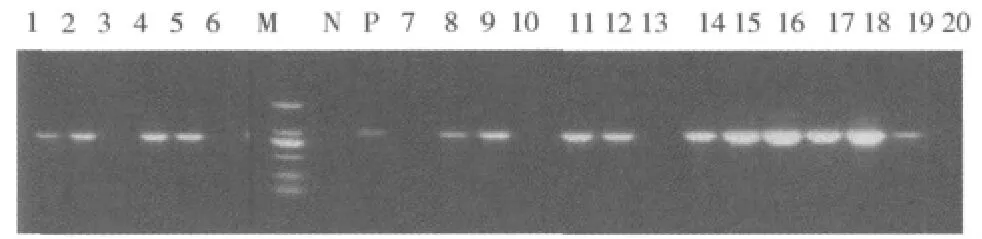
图1 PCR扩增blaOXA-23基因结果
讨论
ICU病区由于病人基础疾病较重,抗菌药物使用较广,多耐药菌株的分离率相对较高。PDR-AB是这些菌株中的典型代表菌,为条件致病菌,近年来已成为医院感染的主要病原菌之一,引起的感染逐年增加[6~8]。笔者医院ICU分离到的20株PDR-AB对临床常用的14种抗菌药物中的11种全部耐药,只对阿米卡星(AMK)、米诺环素(MIN),复方新诺明(SXT)3种部分菌株敏感;而对临床不常用的多黏菌素B,所有菌株均敏感(表2)。对由PDR-AB感染的病人,临床可综合考虑选用阿米卡星(AMK)、米诺环素(MIN),复方新诺明(SXT)及多黏菌素B进行治疗。
研究表明,PDR-AB对碳青霉烯类药物的耐药机制由以下几个因素引起,一是产生各种碳青霉烯类酶(包括金属β-内酰胺酶),二是青霉素结合蛋白(PBPs)的改变,三是通透性的改变(如膜孔蛋白OprD的缺失),四是主动外泵的增加等,而其中最为主要的因素是产生各种碳青霉烯类酶[9~11]。本研究对20株PDR-AB主要检测了blaOXA-23、blaOXA-24、blaOXA-51、blaOXA-58、blaVIM、blaNDM-1和blaIMP 7种碳青霉烯类药物的耐药基因。检测到blaOXA-23、blaVIM和blaIMP基因阳性9株,阳性率45%;其中blaOXA-23阳性,6株,占阳性菌株中的66.7%(6/9);blaVIM阳性2株,占阳性菌株中的22.2%(2/9);blaIMP阳性1株,占阳性菌株中的11.1%(1/9)(图1)。说明笔者医院ICU病区的PDR-AB可能存在有3种以上的碳青霉烯酶基因,而在这些基因中又以blaOXA-23为主。OXA类酶为Bush分类中的D类(2d)β-内酰胺类酶,结构上与C类青霉素结合蛋白相关,具有活性丝氨酸位点,能水解碳青霉烯类菌物,不能被克拉维酸抑制。编码OXA类酶的基因blaOXA可以在染色体上,质粒上,转座子上。目前已发现140多种OXA类酶。OXA型酶耐药谱一般较窄,但近年来可水解第3代头孢菌素和(或)亚胺培南的超广谱OXA酶不断被发现,主要由OXA-2或OXA-10突变衍生而来,其编码基因通常位于质粒或整合子上,具有很强的扩散能力。对鲍曼不动杆菌的研究主要集中在4族突变(blaOXA-23、blaOXA-24、blaOXA-51、blaOXA-58)体上,blaOXA-23为其中的一族(包括blaOXA-23、blaOXA27和blaOXA-49),由质粒介导[3],易引起传播,故临床对分离到此PDR-AB的病人应尽快做好隔离。
本研究检测到另外2型碳青霉烯酶基因blaVIM和blaIMP,均为金属β-内酰胺酶(metallo-betalactamase,MBL)基因,能水解除单环类抗菌药外包括碳青霉烯类在内的几乎全部的β-内酰胺类抗生素,基因可位于染色体或质粒高度可移动遗传因子上,并可被整合子捕获,这使得MBLs基因具有可传播性,MBLs不能被β-内酰胺酶抑制剂所抑制,成为治疗的一大难题[12,13]。
综合本研究结果,笔者医院ICU病区分离的PDR-AB对临床绝大多数抗菌药物耐药,选用抗菌药物应依据实验室的检测结果。对碳青霉烯类药物的耐药机制检测表明,笔者医院ICU病区的PDRAB以产blaOXA-23型碳青霉烯类酶为主,其次为blaVIM和blaIMP金属β-内酰胺酶(MBL),由于这些基因均可在质粒上且可被整合子捕获,因此很容易在菌株或菌属之间传播,因此临床加强对此类菌的监测及预防隔离工作。
1 SouliM,Galani I,Giamarellou H.Emergence of extensively drugresistant and pandrug-resistant Gram-negative bacilli in Europe[J].Euro Surveill,2008,13(47):1-11
2 Doi Y,Husain S,Potoski BA,etal.Extensively drug-resistant Acinetobacter baumannii[J].Emerg Infect Dis,2009,15(6):980-982
3 Merkier AK,Centrón D.Bla(OXA-51)-type beta-lactamase genes are ubiquitous and vary within a strain in Acinetobacter baumannii[J].International Journal of Anti-microbial Agents,2006,28 (2):110-113
4 Clinical and Laboratory Standards Institute(CLSI).Performance standards for antimicrobial susceptibility testing;nineteenth informational supplement,CLSIM100-S21[J].Pennsylvania:CLSI,2011,31(1):62-63
5 胡丽庆,史煌波,孙定河,等.宁波地区肠杆菌科细菌碳青霉烯酶基因的检测研究[J].中国微生态学杂志,2011,23(6):529-532
6 王刚,黄洁,秦帅.等.不同抗菌药物对ICU泛耐药鲍曼不动杆菌感染的疗效比较[J].上海交通大学学报(医学版),2011,30(1): 111-114
7 Lee CM,Lim HK,Liu CP,et al.Treatment of pan-drug resistant Acinetobacter baumannii[J].Scand J Infect Dis,2005,37(3):195-199
8 Zong Z,Lv X,Valenzuela JK,et al.An outbreak of carbapenem-resistant Acinetobacter baumannii producing OXA-23 carbapenemase in western China[J].International Journal of Antimicrobial Agents,2008,31(1):50-54
9 陈民钧.细菌对β-内酰胺酶药的耐药性及检测方法[J].中华检验医学杂志,2001,24(4):197-200
10 Mussi MA,Relling VM,Limansky AS,et al.CarO,an Acinetobacter baumannii outermembrane protein involved in carbapenem resistance,is essential for L-ornithine uptake[J].FEBS Letters,2007,581 (29):5573-5578
11 韩竹俊,丁正萍,张学娟.碳青霉烯类抗生素耐药菌的耐药机制[J].中国药房,2011,22(2):181-183
12 赵旺胜,江淑芳,顾兵,等.鲍曼不动杆菌对碳青霉烯类耐药性及耐药基因型分析[J].南京医科大学学报:自然科学版,2006,26(10):929-932
13 Boonkerd N,Pibalpakdi P,Tiloklurs M,et al.Class1 integron containingmetallo beta-lactamase gene blaIMP-1in carbapenem-resistant pseudomonas aeruginosa in Thailand[J].J Infect Chemother, 2009,15(4):257-261

