顶空气相色谱法测定盐酸伐昔洛韦中的残留溶剂
宁伟志,吴秀荣,林焕泽,李 桃,莫 剑(茂名市人民医院药剂科,广东茂名 525000)
药品中的残留溶剂系指在原料药或辅料的生产中,以及制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。由于此类杂质不仅没有疗效,还可能增加药物的毒副作用,影响药物的稳定性,故其中的有机溶剂应尽可能除去。因此,有必要对药品中的残留溶剂量进行控制。盐酸伐昔洛韦(Valaciclovir hydrochloride)是阿昔洛韦的前体物,进入体内后立即水解成阿昔洛韦,其抗病毒作用由阿昔洛韦发挥。笔者考察盐酸伐昔洛韦的制备工艺后,发现其中有可能引入甲醇、乙醇、丙酮和四氢呋喃4种有机溶剂。本试验采用顶空气相色谱法对盐酸伐昔洛韦中的残留溶剂进行了测定,结果表明,本方法灵敏度高、分离度好、简单快速,可用于盐酸伐昔洛韦中的残留溶剂检查。
1 仪器与试药
1.1 仪器
GC-6890N气相色谱仪、氢火焰离子化检测器(FID)、色谱柱 DB-5(30 m×0.53 mm,0.25 μm)、G1888顶空炉(美国Agilent公司);色谱柱 CP-Sil 8 CB(30 m×0.53 mm,1.5 μm)(美国瓦里安公司)。
1.2 试药
盐酸伐昔洛韦(某公司提供,批号:20100701、20100817、20101104,纯度:均大于99.0%);甲醇、乙醇、四氢呋喃(广州化学试剂厂)、丙酮(天津化学试剂一厂)均为分析纯;水为纯净水。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent DB-5(30 m×0.53 mm,0.25 μm);柱温:35℃;进样口温度:200℃;FID温度:260℃;流速:1.5 mL·min-1;分流比:1∶1;载气:氮气;顶空炉温度:80 ℃(平衡时间:45 min);定量环温度:85 ℃;转移线温度:90 ℃;进样量:1 mL。
2.2 对照品溶液的制备
分别取甲醇、乙醇、丙酮和四氢呋喃置于同一量瓶中,加水溶解并稀释至刻度,得4种溶剂浓度分别为0.75、1.25、1.25、0.18 mg·mL-1的溶液,作为对照品贮备液。
2.3 供试品溶液的制备
取供试品约1.0 g,加水20 mL溶解,摇匀,取该溶液5 mL,加入含无水硫酸钠1 g的顶空瓶中密封,即得。
2.4 系统适用性试验
将对照品贮备液稀释5倍后取5 mL,加入无水硫酸钠1 g,置于顶空瓶中密封,进样,结果,各峰分离度均大于4.0。另取供试品进样,色谱结果见图1。

图1 气相色谱图Fig 1 GC chromatograms
2.5 线性关系考察
取对照品贮备液,分别稀释20倍(甲醇、乙醇、丙酮、四氢呋喃浓度分别为37.5、62.5、62.5、9 μg·mL-1)、10倍(甲醇、乙醇、丙酮、四氢呋喃浓度分别为0.075、0.125、0.125、0.018 mg·mL-1)、5倍(甲醇、乙醇、丙酮、四氢呋喃浓度分别为0.15、0.25、0.25、0.036 mg·mL-1)、2倍(甲醇、乙醇、丙酮、四氢呋喃浓度分别为0.375、0.625、0.625、0.09 mg·mL-1)和不稀释(甲醇、乙醇、丙酮、四氢呋喃浓度分别为0.75、1.25、1.25、0.18 mg·mL-1),并分别取5 mL和无水硫酸钠1 g,置于顶空瓶中密封,进样,记录色谱图,并测量各待测溶液峰的峰面积,以峰面积(Y)对浓度(x)作线性回归,结果见表1。
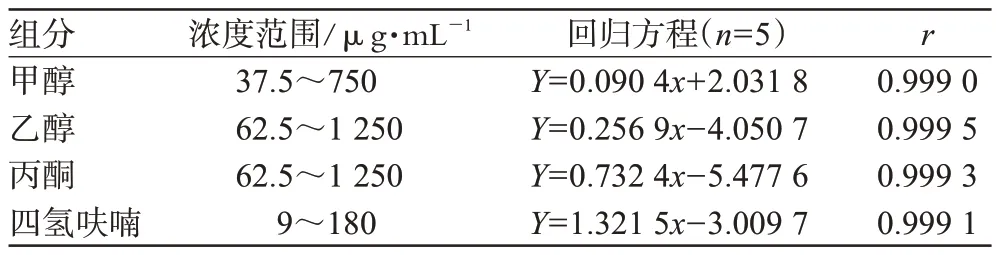
表1 线性关系结果Tab 1 Result of linear correlations
2.6 精密度试验
取“2.5”项下试验溶液(甲醇、乙醇、丙酮、四氢呋喃浓度分别为0.15、0.25、0.25、0.036 mg·mL-1),在同一天内重复进样5次,记录色谱图,并测量各待测溶液的峰面积,计算各组分峰面积的RSD,结果分别为2.1%、0.9%、1.3%、2.8%。
2.7 检测限和定量限检测
精密量取对照品贮备液适量,作系列稀释后进样测定,以各峰达信噪比3倍和10倍时的量分别为最低检测限和最低定量限,结果甲醇、乙醇、丙酮、四氢呋喃检测限分别为0.596、0.38、0.32、1.251 μg·mL-1),定量限分别为0.239、0.117、0.83、5.013 μg·mL-1)。
2.8 回收率试验
取供试品(批号:20100701)溶液5 mL,以2010年版《中国药典》二部附录规定的相应溶剂限度[1]所得相应的对照品溶液(甲醇、乙醇、丙酮、四氢呋喃分别为0.15、0.25、0.25、0.036 mg·mL-1)为基准,制备浓度为该对照品溶液80%、100%、120%的溶液,并分别取各溶液5 mL及无水硫酸钠1 g,置于顶空瓶中密封,依法测定,每个浓度测定3次,计算回收率,结果见表2。

表2 回收率试验结果Tab 2 Results of recovery test
2.9 耐用性试验
取“2.5”项下溶液(甲醇、乙醇、丙酮、四氢呋喃浓度分别为0.075、0.125、0.125、0.018 mg·mL-1),分别用色谱柱Agilent DB-5和Varian CP-Sil 8 CB重复进样6次,进行耐用性试验,结果4组分峰面积的RSD分别为1.38%、0.98%、1.34%、2.01%。
2.10 样品检测结果
取3批样品进样,结果甲醇、乙醇、丙酮、四氢呋喃的含量均小于《中国药典》2010年版二部附录[1]中对相应有机溶剂的限度规定(甲醇:0.3%;乙醇:0.5%;丙酮:0.5%;四氢呋喃:0.072%),详见表3。
3 讨论
《中国药典》2010年版和《欧洲药典》(EP)7.0都收载有盐酸伐昔洛韦质量标准[1,2],但均未列有残留溶剂检查项,《美国药典》(USP)32未收载伐昔洛韦的质量标准。国内王文芳等[3]采用直接进样法测定盐酸伐昔洛韦中的甲醇、乙醇、醋酸乙酯、四氢呋喃和N,N-二甲基甲酰胺的含量;而本文是根据待测样品的相关工艺确定检测的有机溶剂为甲醇、乙醇、丙酮和四氢呋喃,且本文采用顶空气相色谱法,因此,检测限和定量限结果更优于直接进样法,因此本法更能真实地反映盐酸伐昔洛韦中有机溶剂的残留量。

表3 样品中4种溶剂测定结果(%)Tab 3 Results of content determination of 4 solvents in samples(%)
本研究的方法和限度参考人用药品注册技术要求国际协调会(ICH)[4]和《中国药典》2010年版的相关规定,对甲醇、乙醇、丙酮和四氢呋喃4种有机溶剂的量进行检测,采用顶空气相色谱法。本试验样品进样处理中加入了无机盐无水硫酸钠,其作用是改变有机溶剂在液相和气相中的分配系数,以促进有机溶剂的挥发[5]。本试验柱温采用35℃,因柱温较低,建议试验结束后升高柱温以净化色谱柱。
本试验测定结果表明,盐酸伐昔洛韦中4种有机溶剂的量均符合相关规定,各峰间达到良好的分离。本方法操作简单、准确、可靠、灵敏度高,能达到残留溶剂的检测要求,可用于盐酸伐昔洛韦中残留溶剂的检测。
[1]国家药典委员会.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:686、附录61-65.
[2]European Director for the Quality of Medicines & Healthcare.European Pharmacopeia(7.0)[S].Germany:Druckerei C.H.Beck Nordlingen,2010:3 185-3 188.
[3]王文芳,杨 敏,赖招连.盐酸伐昔洛韦中有机溶剂残留量的测定 [J].医药导报,2007,26(9):1 088.
[4]李 眉,马玉楠.简介ICH关于药品中溶剂残留的指导原则[J].中国药师,1998,1(3):119.
[5]朱海燕,蓝伟松,郑凝坚.顶空气相色谱法测定利巴韦林中的残留溶剂[J].分析试验室,2002,21(2):33.

