PEG模拟干旱胁迫对玉带草生理特性的影响
刘晓东,李洋洋,何 淼
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
近年来,随着节约型社会的建设,可持续型园林的兴起,观赏草因具有实用性广、管护成本低、茎秆姿态优美、色彩丰富等特点,越来越受到人们的关注,在国内外景观设计和建设中日益受到青睐。因此对观赏草的研究日益增多,但大多数研究主要集中在其观赏特性和园林应用上[1-4],关于其抗逆的研究相对较少,对其耐旱性的研究更为少见,且在品种上有一定的局限性[5-7]。同时,东北地区草的应用品种和研究比南方的要少,因此加大北方观赏草的研究、应用和推广具有重大意义。
玉带草[8-9](Phalarisarundinaceacv.Picta)为禾本科虉草属多年生草本,分布于我国东北、华北、华中及欧洲和北美洲部分地区。生性喜光耐寒;植株高30~50 cm,具匍匐茎,叶扁平、线性;叶面绿色间有白色或黄绿色条纹,质地光滑、飘逸,形似玉带,圆锥花序,分株繁殖。可植于花镜草坪边缘,山坡或路边,是北方较优良的观赏地被植物。目前对玉带草的抗逆性研究还未见报道,仅见杨立宾和陈之欢[10]对玉带草的营养解剖器官进行研究,其结果推测玉带草是一种既抗旱又耐涝的植物。
研究植物抗旱性的方法有模拟渗透胁迫和土壤干旱。但土壤干旱研究过程中常被一些客观因素所困扰:一是土壤的组分非常复杂,作为试验系统常难以控制;二是有时难以将渗透胁迫效应与土壤系统中的其他胁迫效应有效区分开。因此,人们都在试图找到一种能取代控制水分的办法以模拟干旱逆境,而采用渗透调节剂模拟干旱就是其中一类。聚乙二醇6000(PEG-6000,以下简称PEG)是一种亲水性很强的惰性高分子聚合物,近几十年作为理想的渗透调节剂被广泛应用于模拟干旱胁迫。研究表明[11-13],PEG能模拟干旱胁迫的原因是其可阻塞植物的输导组织,且其模拟干旱胁迫与土壤控水的结果相同。本研究通过观察和测定不同质量浓度的PEG模拟干旱胁迫下玉带草形态及生理指标的动态变化,分析玉带草对干旱的生理反应,对其耐旱性进行评价,旨为其在园林中的推广应用提供理论基础和依据。
1 材料与方法
1.1试验材料 供试材料于2010年11月引种于辽宁省锦州市义县北方苗木公司,栽种于哈尔滨东北林业大学园林学院温室,2011年1月选取长势一致的苗进行分株,栽种于直径20 cm的盆中,培养土为黑土∶沙子∶松针土=2∶2∶1。2011年5月选取高度相同,长势一致的单株,平均分成4组,每组30盆,每组3个重复。
1.2试验方法 2011年5月20日将玉带草从土壤中取出,避免损伤根系,并用清水冲洗干净根系,移植到1/2 Hoagland’s营养液平衡培养3 d后,将其移入不同质量浓度的PEG溶液中(不同质量浓度的PEG溶液是用PEG溶解于1/2 Hoagland’s营养液中配制而成),对照(CK)为不加PEG的1/2 Hoagland’s营养液。PEG质量浓度设为100、200、300 g·L-1,分别为轻度胁迫、中度胁迫、重度胁迫,每个处理重复3次。放入培养箱中,培养条件为白天16 h,25 ℃,夜间8 h,15 ℃,分别于0、8、16、24和32 h取样测定各项指标。
1.3测定项目及方法 枯叶率[6]为50%面积出现干枯症状的叶片数占总叶片数的百分比。
叶片相对含水量(RWC)采取烘干法测定[14];细胞质膜透性采用电导法[14]测定相对电导率(REC);丙二醛(MDA)含量采用硫代巴比妥酸法[15]测定;游离脯氨酸(Pro)含量采用茚三酮比色法[14]测定;可溶性蛋白含量采用考马斯亮蓝G-250染色法[15]测定;超氧物歧化酶(SOD)活性采用氮蓝四唑法测定[16];过氧化物酶(POD)活性采用愈创木酚法测定[16]。
1.4数据处理 试验所得数据使用Excel 2003和SPSS 17.0进行处理和分析。
2 结果与分析
2.1干旱胁迫对玉带草枯叶率的影响 在干旱胁迫中玉带草叶片出现干枯症状的顺序为较幼小苗早于较强壮苗;同一植株下部叶片先于上部叶片。300 g·L-1胁迫的枯叶率随胁迫时间的延长呈上升趋势,8~24 h增幅最大,在32 h时枯叶率达到100%(图1)。100和200 g·L-1胁迫下在16 h时枯叶率有小幅上升,之后保持平稳,且200 g·L-1胁迫下的枯叶率略高于100 g·L-1胁迫下的。200 g·L-1胁迫下在32 h时约70%玉带草叶片叶尖2 cm左右出现萎蔫,但枯叶率为16%(图2)。

图1 不同质量浓度PEG胁迫处理对玉带草枯叶率的影响

图2 玉带草受不同质量浓度PEG胁迫处理32 h后的形态比较
2.2干旱胁迫对玉带草生理指标的影响
2.2.1干旱胁迫对玉带草叶片相对含水量的影响 PEG质量浓度为100 g·L-1时,玉带草的RWC与对照之间无显著差异(P>0.05)(图3);为200 g·L-1时,RWC在8 h时与对照无显著差异,胁迫8~16 h时出现显著下降(P<0.05),24和32 h时保持稳定,与16 h时无显著性差异;300 g·L-1时,RWC随胁迫时间的延长呈下降趋势,且均极显著(P<0.01)低于对照,在32 h时达到最低值,仅为27.67%。

图3 PEG胁迫处理对玉带草叶片相对含水量的影响
2.2.2干旱胁迫对玉带草质膜透性和丙二醛含量的影响 3个不同PEG质量浓度胁迫下玉带草叶片的相对电导率均随胁迫时间的延长而有所上升,上升幅度随PEG质量浓度的增大而增大。100和200 g·L-1胁迫下在16 h时的叶片相对电导率与对照的存在显著差异(P<0.05),之后保持相对平稳(图4)。这表明,在短时间内轻度胁迫、中度胁迫没有对细胞膜透性造成影响,但随时间的延长,细胞膜透性受到一定的伤害。PEG质量浓度为300 g·L-1的处理,从8 h开始叶片相对电导率呈上升趋势,且极显著(P<0.01)高于对照,在32 h时达到最大值(91.67%),是对照的1.97倍。由此可见,重度胁迫下,细胞膜透性短时间内就受到严重伤害,随胁迫时间的延长而逐渐加重。
不同质量浓度PEG胁迫下,MDA含量变化不同(图5)。100 g·L-1胁迫下MDA含量和对照之间无显著差异(P>0.05);200 g·L-1胁迫下在8 h内MDA含量没有变化,16 h时显著增加之后保持稳定;30%胁迫下MDA含量8 h内有显著升高,但幅度不大,之后呈大幅度上升,在16、24和32 h时MDA含量分别为对照的2.22、3.03和4.33倍。

图4 PEG胁迫处理对玉带草叶片相对电导率的影响
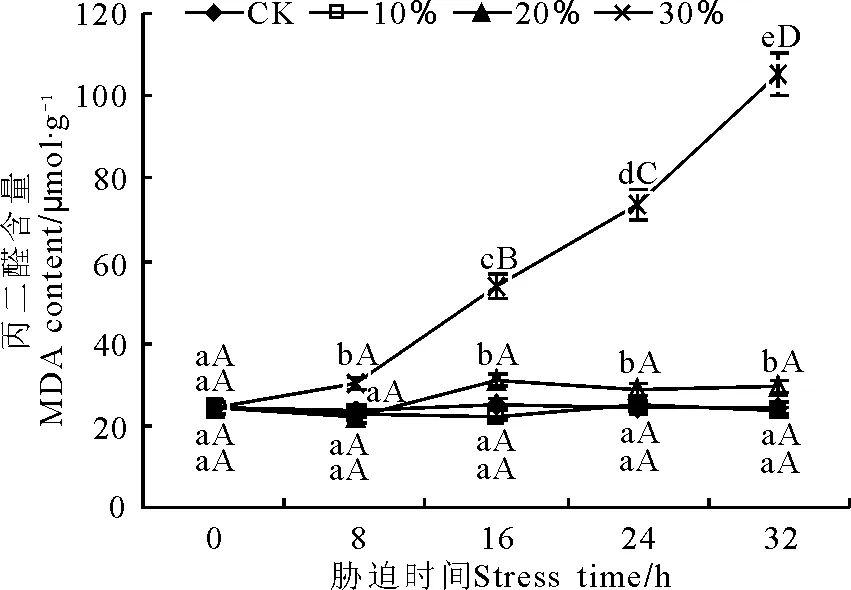
图5 PEG胁迫处理对玉带草叶片丙二醛含量的影响
2.2.3干旱胁迫对玉带草渗透调节物质的影响 随着PEG质量浓度的增大,Pro含量逐渐增加(图6)。100 g·L-1胁迫下的Pro含量与对照间没有显著差异;200和300 g·L-1胁迫下在8 h时的Pro含量与对照间没有显著差异。200 g·L-1胁迫下16 h时Pro含量增加了0.54 mg·g-1,显著(P<0.05)高于对照,之后保持稳定;300 g·L-1胁迫下16 h时Pro含量增加了3.71 mg·g-1,极显著(P<0.01)高于对照,且随胁迫时间的延长急剧增加,32 h时达到对照的79.67倍。

图6 PEG胁迫处理对玉带草叶片游离脯氨酸含量的影响
不同质量浓度PEG胁迫下,玉带草叶片可溶性蛋白含量表现出不同的变化趋势(图7)。100和200 g·L-1胁迫下在不同胁迫时间的可溶性蛋白含量与对照相比均存在极显著差异(P<0.01)。100 g·L-1胁迫下可溶性蛋白含量先降低后增高,在16 h时可溶性蛋白含量达到最低值,为3.28 mg·g-1;16~24 h时显著上升,24~32 h保持稳定。20%处理在8 h时可溶性蛋白含量达到最低值,为4.13 mg·g-1,之后保持相对稳定。300 g·L-1胁迫下可溶性蛋白含量随胁迫时间的延长而增加, 8 h时极显著(P<0.01)高于对照,8~24 h之间虽有所增加但差异显著,24~32 h极显著增加,32 h时达到最大值为8.61 mg·g-1。
2.2.4干旱胁迫对玉带草保护酶活性的影响 100 g·L-1胁迫下的SOD活性在8 h时略有升高,之后又恢复正常,与对照之间不存在显著差异(图8),说明100 g·L-1胁迫下SOD活性保持稳定且和对照之间没有差异。在200 g·L-1胁迫下SOD活性呈逐渐上升趋势,但是8~24 h均与对照没有显著差异,仅32 h时显著(P<0.05)高于对照。300 g·L-1胁迫下在24 h内SOD活性呈极显著上升,24 h时达到最大值,为174.72 U·g-1,之后呈极显著下降,但32 h时的SOD活性仍极显著(P<0.01)高于对照,为131.47 U·g-1。
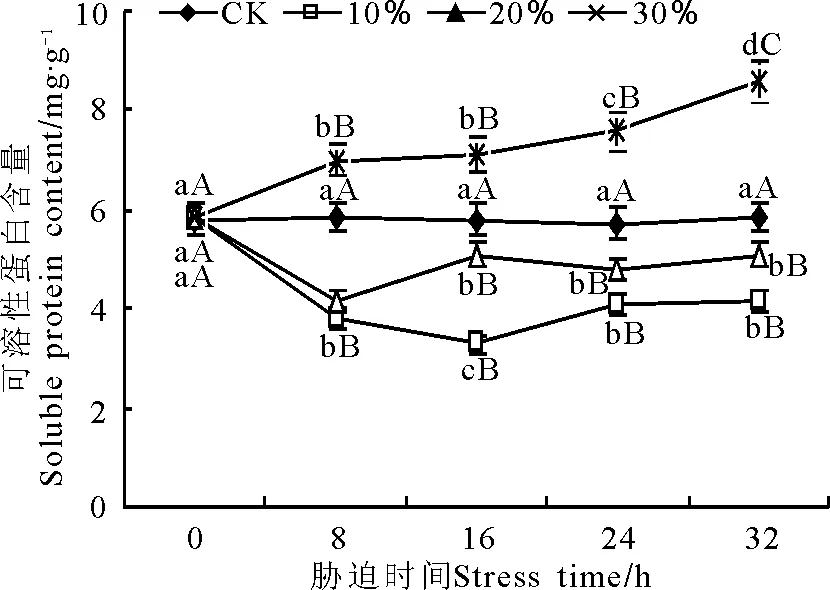
图7 PEG胁迫处理对玉带草叶片可溶性蛋白含量的影响
在100 g·L-1胁迫下,玉带草的POD活性保持稳定,且在不同胁迫时间与对照之间没有显著差异(图9)。200 g·L-1胁迫下, 0~24 h的POD活性之间没有显著差异,在32 h时显著升高,比对照增加了30.70%,表明200 g·L-1胁迫下,短时间内POD活性基本稳定,长时间胁迫下会略有升高。300 g·L-1胁迫下的POD活性呈现先升后降的趋势,在8~24 h时呈上升趋势,极显著(P<0.01)高于对照,24 h时POD活性达到最大值,为2 962 U·g-1·min-1,比对照增加了195.28%,24~32 h时POD活性大幅下降,32 h时为1 985 U·g-1·min-1,但仍极显著高于对照。

图8 PEG胁迫处理对玉带草叶片SOD酶活性的影响

图9 PEG胁迫处理对玉带草叶片POD酶活性的影响
2.3干旱胁迫下玉带草各个指标之间的相关性分析 PEG胁迫质量浓度与枯叶率、相对电导率和SOD活性呈极显著正相关(P<0.01),与RWC呈极显著负相关,与MDA含量、Pro含量和POD活性呈显著正相关(P<0.05),与可溶性蛋白含量不相关(表1),说明随胁迫质量浓度的增加,玉带草受到的旱害程度加深。枯叶率与RWC呈极显著负相关,与其他各生理指标呈显著正相关,说明枯叶率作为玉带草干旱胁迫的外部形态指标较好地反映了玉带草的抗旱性。此外,除了叶片相对含水量与其他各指标呈极显著负相关外,其余各项生理指标之间呈极显著正相关。
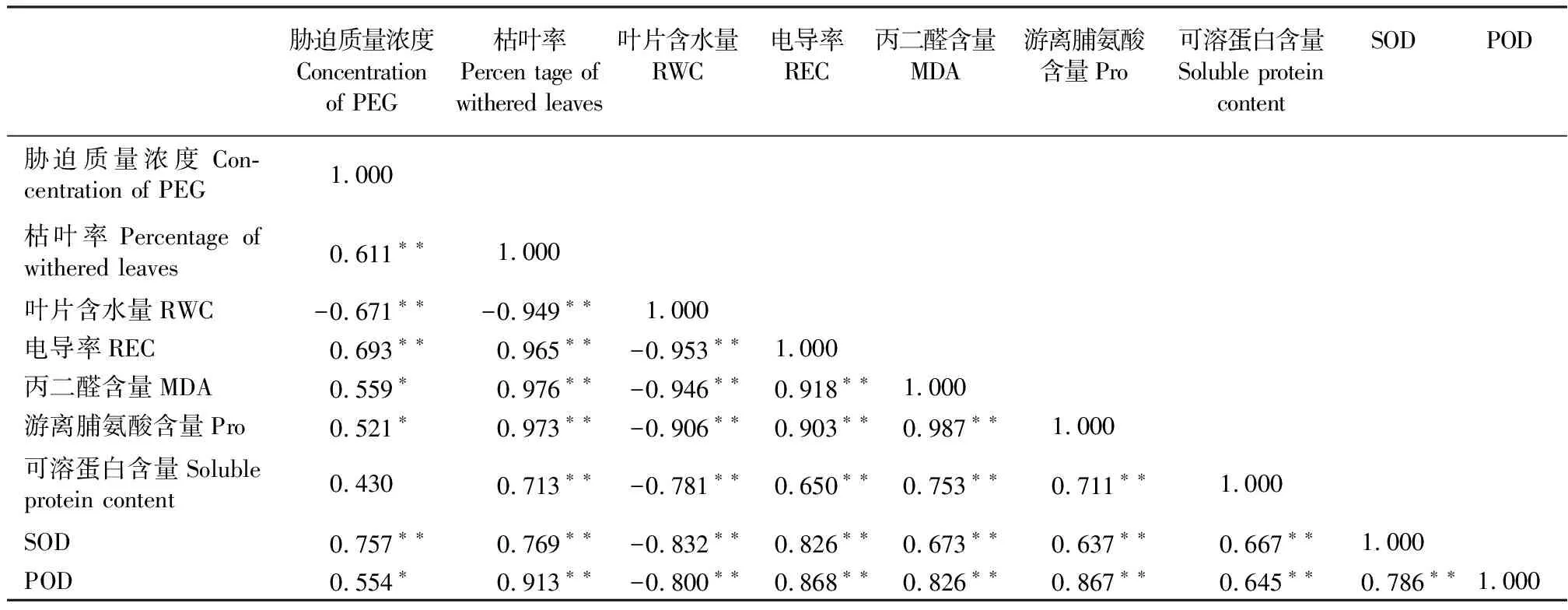
表1 PEG胁迫下玉带草各指标之间的相关系数
3 讨论
干旱胁迫下植物外部形态有明显变化,受到直接影响的是叶片[17]。玉带草作为观赏性植物,其观赏价值在园林应用中具有重要的影响,在干旱胁迫下的表现也应当给予考虑。因此本研究主要以玉带草枯叶率作为外部形态指标,结果表明枯叶率能够较好地反映出干旱胁迫对玉带草的伤害程度。300 g·L-1胁迫32 h时玉带草叶片全部萎蔫,完全丧失观赏价值,此时对其进行复水,则叶片可以部分恢复正常,但大部分叶片的叶尖部分不能恢复正常状态,说明此时的叶片虽受到严重旱害却并未完全死亡,但可以预计随着胁迫时间的延长,300 g·L-1胁迫下玉带草叶片会逐渐死亡。玉带草具有匍匐茎,其根状茎是繁殖的主要材料,因此玉带草叶片死亡的胁迫质量浓度并不代表玉带草植株的致死干旱胁迫质量浓度。如果要确定玉带草植株的致死胁迫质量浓度,需对玉带草的根系进行研究。
植物在逆境条件下,细胞体内活性氧的不断积累加速质膜过氧化的反应,引起丙二醛等有害物质的积累,严重损伤生物膜,导致细胞膜透性的增大和胞间物质的外渗,植物的相对电导率增大。所以质膜透性的大小是衡量膜结构和功能完整性的可靠指标[18],丙二醛含量是判断细胞遭受胁迫程度大小的指标[19],且两者呈显著正相关关系[20]。本研究中,随胁迫程度加深和胁迫时间延长,玉带草的丙二醛含量和相对电导率逐渐增加,呈显著正相关关系,说明干旱胁迫加剧了丙二醛等对细胞膜有害物质的积累,细胞膜受到损伤。
游离脯氨酸和可溶性蛋白等是植物体内的渗透调节物质,在干旱胁迫下细胞内渗透调节物质的增加,可以降低渗透势,有利于植物在干旱条件下吸收水分,从而提高抗旱能力[21]。游离脯氨酸含量在一定程度上反映了植物遭受逆境的伤害情况及其对逆境的抵抗能力。在正常条件下,作物体内游离脯氨酸含量甚微(每克干质量0.20~0.69 mg),占游离氨基酸总量的百分之几,但在受到干旱、盐渍等渗透胁迫时,脯氨酸会大量积累,其含量甚至提高百倍以上[22]。本研究中,游离脯氨酸在不同质量浓度PEG的胁迫下均呈上升趋势,重度胁迫下上升幅度很大,增强了玉带草的抗旱性。而可溶性蛋白在100和200 g·L-1胁迫下先降后升,在300 g·L-1胁迫下呈上升趋势,这与师进霖等[23]和刘丹等[24]的研究结果是一致的。这可能是在轻度和中度胁迫下,蛋白质的降解大于蛋白质的合成,从而使植株体内的总蛋白含量降低;在重度胁迫下,玉带草体内迅速合成可溶性蛋白降低渗透势以抵御胁迫造成的伤害。作为渗透调节物质的游离脯氨酸和可溶性蛋白在干旱胁迫下表现出不同的变化趋势,可能是渗透胁迫物质所起的作用和调节机制存在一定的差异,其原因还有待于进一步研究。此外,研究[25-26]认为游离脯氨酸含量在一定程度上反映了植物受胁迫影响的程度与相对电导率和丙二醛之间呈显著正相关关系,本研究的结果与之相一致。
4 结论
在干旱胁迫下玉带草叶片的枯叶率、相对含水量、相对电导率、丙二醛含量和游离脯氨酸含量呈逐渐升高;可溶性蛋白含量呈先降后升;超氧化物歧化酶和过氧化物酶活性呈先升后降的变化趋势。胁迫程度与枯叶率、相对电导率、丙二醛含量、可溶性蛋白含量、游离脯氨酸含量、超氧化物歧化酶和过氧化物酶活性呈正相关关系,与相对含水量呈负相关关系,且高质量浓度胁迫下各指标的变化幅度要大于低质量浓度胁迫下的。综上所述,在适度的干旱条件下,玉带草生长良好,具有一定的耐旱性,是优良的地被观赏草本植物。
[1]宋希强,钟云芳,张启翔.浅析观赏草在园林中的运用[J].中国园林,2004(3):32-36.
[2]武菊英.观赏草及其在园林景观中的应用[M].北京:中国林业出版社,2007:2-5.
[3]齐海鹰,安吉磊.浅谈观赏草在园林造景中的应用[J].现代园林,2007(7):63-67.
[4]Wolfe J,Zajicek J M.Are ornamental grasses acceptable alternatives for low maintenance landscapes[J].Journal of Environmental Horticulture,1998,16(1):8-11.
[5]孔兰静,彭卫东,柳玉芳,等.干旱胁迫对三种观赏草叶片渗透调节的影响[J].中国草地学报,2010,32(3):82-87.
[6]张智,夏宜平,常乐,等.3种观赏草在自然失水胁迫下的生理变化与耐旱性关系[J].东北林业大学学报,2007,35(12):17-20.
[7]Li K,Li H B,Zhao Y J,etal.Effects of NaCl stress on two blue fescue varieties (Festucaglauca)[J]. Frontiers of Agriculture in China,2010,4(1):96-100.
[8]刘延江,王洪力,曲素华.园林观赏花卉应用[M].沈阳:辽宁科学技术出版社,2008:561.
[9]李作文,刘家祯.园林地被植物的选择与应用[M].沈阳:辽宁科学技术出版社,2009:144.
[10]杨立宾,陈之欢.玉带草营养器官解剖结构初探[J].黑龙江科技信息,2008(8):128.
[11]Atree S M,Fowke L C.Embryogeny of gymnosperms: advances in synthetic seed technology of conifers[J].Plant Cell,Tissue and Organ Culture,1993,35:1-35.
[12]Rawlor D W.Absorption of polyethylene glycol by plants and their effects on plant growth[J].New Phytologist,1970,69:501-513.
[13]Kaufmann M R,Eckard A N.Evaluation of water stress control with polyethylene glycol by analysis of guttation[J].Plant Physiology,1971,47:453-456.
[14]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:22-108.
[15]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-263.
[16]徐启贺.苹果砧木对干旱胁迫的生理响应及抗旱性评价[D].北京:中国农业科学院,2010:9-10.
[17]黄承玲,陈讯,高贵龙.3种高山杜鹃对持续性干旱的生理响应及抗旱性评价[J].林业科学,2011,46(6):48-55.
[18]肖用森,王正直,郭绍川.渗透胁迫下稻苗中游离脯氨酸积累与膜脂过氧化的关系[J].武汉植物学研究,1996,14(4):334-340.
[19]杨帆,苗灵凤,胥晓,等.植物对干旱胁迫的响应研究进展[J].应用与环境生物学报,2007,13(4):586-591.
[20]韩永华.水分胁迫对大豆幼苗叶片细胞质膜的影响[J].广西师范大学学报(自然科学版),1999,17(4):85-87.
[21]张玉霞,杜晓艳,张玉芹,等.PEG胁迫对苔草渗透调节特性的影响[J].内蒙古民族大学学报(自然科学版),2008,23(3):289-292.
[22]齐永清,肖凯,李雁鸣.作物在渗透胁迫下脯氨酸积累的研究进展[J].河北农业大学学报,2003,26(增刊):24-27.
[23]师进霖,陈恩波,姜跃丽.PEG-6000渗透胁迫对甜瓜幼苗叶片渗透调节物质及膜脂过氧化的影响[J].西北农业学报,2010,19(1):182-185.
[24]刘丹,陈国祥,魏晓东,等.干旱对银杏生理生化特性及叶绿体超微结构的影响[J].南京师大学报(自然科学版),2011,34(2):64-69.
[25]范苏鲁,苑兆和,冯立娟,等.干旱胁迫对大丽花生理生化指标的影响[J].应用生态学报,2011,22(3):651-657.
[26]常雪刚,徐柱,易津,等.7种鹅观草属植物苗期干旱胁迫的生理评价[J].中国草地学报,2011,33(4):44-50.
[27]原向阳,郭平毅,杨丽光,等.干旱胁迫下草甘膦对抗草甘膦大豆幼苗保护酶活性及脂质过氧化作用的影响[J].中国农业科学,2010,43(4):689-705.
[28]夏新莉,郑彩霞.土壤干旱胁迫对樟子松针叶膜脂氧化、膜脂成分和乙烯释放的影响[J].林业科学,2000,36(3):25-34.
[29]赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[30]胡景江,顾振瑜,文建雷,等.水分胁迫对元宝枫膜脂过氧化作用的影响[J].西北林学院学报,1999,14(2):7-11.
[31]姜慧芳,任小平.干旱胁迫对花生叶片SOD活性和蛋白质的影响[J].作物学报,2004,30(2):169-174.

