As2O3预处理对离体缺血再灌注心肌的保护作用及机制
王方岩,戴雍月,方周溪,郝卯林,汪 洋
(1温州医学院病理生理学教研室,浙江温州325000;2温州医学院电镜室)
心肌缺血再灌注损伤(MIRI)常见于冠脉狭窄再通、心脏移植及冠脉搭桥术等外科手术过程中。对MIRI切实有效的保护方法至今仍为研究热点[1,2]。2011年,我们观察了三氧化二砷(As2O3)预处理对缺血再灌注损伤心肌的保护作用并探讨其机制。
1 材料和方法
1.1 实验材料 16只雄性SD大鼠(200~250 g)由温州医学院实验动物中心提供,均自由觅食、觅水;As2O3(哈尔滨伊达药业),热休克蛋白27 (HSP27)多克隆抗体(武汉博士德),即用型二步法试剂盒(北京中杉)。Langendorff装置(ML870B2,AD Instruments,Australia);Powerlab生物信号数据记录及分析系统(AD Instruments,Australia)。其余试剂均购于温州金山化学试剂仪器公司。
1.2 离体心脏缺血再灌注模型建立 以水合氯醛麻醉大鼠,肝素1 000 U/kg下腔静脉注射后迅速开胸取心,接Langendorff装置逆行灌注,采用恒压恒温灌流,灌注压力100 mmHg,灌注温度37℃。K-H液成分如下(单位:g/L):NaCl 6.896、KCl 0.350、KH2PO40.163、MgSO4·7H2O 0.296、NaHCO32.100、CaCl20.278、Glucose 1.982,pH 7.4。灌注液95%O2+5% CO2饱和。左心耳根部剪一小口,经左心房、房室瓣置入一连接压力传感器的乳胶球囊,与Powerlab生物信号数据记录及分析系统连接。调整球囊大小使左心室舒张末期压力(LVEDP)初始值为4~10 mm-Hg。将SD大鼠随机分为两组,每组8只。对照组灌注生理盐水,观察组实验前24 h腹腔注射As2O35 mg/kg。离体灌流时,先平衡20 min,再结扎冠状动脉左前降支缺血20 min后,松开复灌60 min。
1.3 观察项目
1.3.1 心功能及血流动力学指标 结扎前、缺血20 min、再灌注后30、60 min测定左心室压力收缩速率(LV+dP/dtmax)、左心室压力舒张速率(LV-dP/ dtmax)及左室发展压(LVDP)。
1.3.2 心肌梗死面积 复灌结束行常规伊文斯蓝、氯化三苯基四氯唑染色,并用Image J图像分析软件计算梗死区心肌面积占危险区面积(红色+灰白色)的百分比,得出梗死面积。
1.3.3 心肌组织超微结构 取左心室前壁0.1 cm ×0.1 cm×0.1 cm的组织2~3块,常规电镜标本固定脱水后超薄切片,醋酸硝酸铅双重染色,透射电镜下观察。
1.3.4 心肌组织HSP27表达 采用二步法,按说明书操作。镜检显色呈棕黄色为阳性表达。应用Image-Pro Plus 4.1专业图像分析软件测量平均吸光度值(A值)作为相对表达量。
1.4 统计学方法 采用SPSS13.0统计软件。计量资料以s表示,单因素方差进行分析,重复测量资料应用方差成分的混合模型进行统计分析。P≤0.05为差异有统计学意义。
2 结果
2.1 心脏功能 两组不同时间点LVDP、LV+dP/ dtmax、LV-dP/dtmax比较见表1。
表1 两组缺血再灌注各时点心功能指标变化(n=8,%,s)

表1 两组缺血再灌注各时点心功能指标变化(n=8,%,s)
注:与对照组同时点比较,*P<0.05,△P<0.01
组别LV+dP/dtmax LV-dP/dtmax LVDP观察组缺血20 min 79.94±8.97 76.78±8.63*60.14±1.82△再灌注30 min 80.09±11.51△79.19±10.59△73.07±7.03△再灌注60 min 75.96±13.62△71.77±10.56*68.84±4.68△对照组缺血20 min 73.94±9.82 67.44±8.51 50.88±3.64再灌注30 min 61.61±9.87 61.46±8.54 65.37±2.54再灌注60 min 55.85±7.58 61.33±6.95 57.20±5.07
2.2 心肌梗死面积及HSP27表达 见表2。
表2 两组心肌梗死面积和HSP27表达变化(n=8,s)
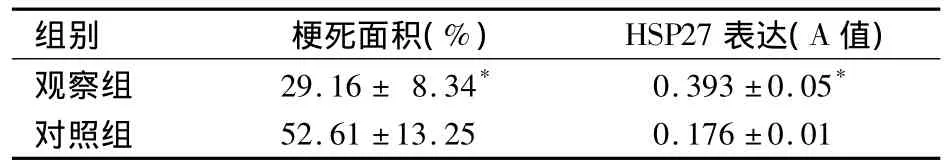
表2 两组心肌梗死面积和HSP27表达变化(n=8,s)
注:与对照组比较,*P<0.01
组别 梗死面积(%) HSP27表达(A值)观察组 29.16±8.34* 0.393±0.05*对照组52.61±13.25 0.176±0.01
2.3 心肌超微结构变化 电镜下可见对照组心肌纤维的聚集排列不规则甚至溶解,线粒体出现显著肿胀(图1A),观察组上述损伤现象明显轻于对照组(图1B)。

图1 两组心肌超微结构变化
3 讨论
毒物兴奋效应(Hormesis)是指毒物低于抑制浓度时对机体产生的刺激作用,是毒理学用来描述毒性因子(刺激)的双相剂量效应的一个术语。即高剂量致毒因素(包括毒物、辐射、热、机械刺激等)对生物体有害,而低剂量致毒因素对生物体有益。实际上,经典的缺血预处理(IPC)属于一种利用毒物刺激效应激发机体保护作用的手段[3]。
HSP是在从细菌到哺乳动物中广泛存在一类热应急蛋白质,具有高度保守性,当生物细胞在受到刺激时产生的一类特殊蛋白质,具有生物活性和免疫协同功能,可保护机体或细胞不受或少受伤害,对维持机体自身的稳定性起着重要作用。目前,对HSP的研究涉及多个领域,其中包括IR机制及防治方面。HSP27属于小分子HSP家族又名HSPB1,热休克、氧化应激及缺血、缺氧等均可诱导其表达,静息状态下,细胞中该蛋白几乎不表达或表达程度很低[4]。已有研究表明其参与心肌对IR[5]、严重缺氧[6]的耐受力机制。在异氟醚预处理的研究中发现HSP27增加通过抗氧化、分子伴侣等多方面发挥拮抗MIRI作用[7]。庞斯斯等[8]发现HSP27激活蛋白激酶B是其发挥心肌保护作用的重要途径。As2O3虽被视为剧毒物质,但千年前就已被古人应用于临床治疗各种疾病,现代医学也将其用于肿瘤的治疗。杨萍等[9]在人胚肺成纤维细胞上观察了亚砷酸钠刺激的剂量效应关系,发现小剂量确实能够提高细胞的增殖及抗氧化能力。本研究采用As2O3小剂量预处理发现其对MIRI有拮抗作用[2]。即对缺血再灌注心肌损伤具有保护作用,其机制可能为增加HSP27的表达,但具体机制仍需进一步深入研究。
[1]李洪亮,程齐来,曾靖,等.染料木素对心肌缺血再灌注损伤的保护作用及机制研究[J].山东医药,2010,50(40):38-39.
[2]邱玲玲,汪萍,刘乐,等.三氧化二砷预处理在离体心肌缺血-再灌注损伤中保护作用的初探[J].中国微循环,2009,13(6): 475-477.
[3]Mattson MP.Hormesis defined[J].Ageing Res Rev,2008,7(1): 1-7.
[4]Yan LJ,Christians ES,Liu L,et al.Mouse heat shock t ranscription factor 1 deficiency alters cardiac redox homeostasis and increases mitochondrial oxidative damage[J].EMBO J,2002,21(19): 5162-5172.
[5]Pantos C,Mourouzis I,Dimopoulos A,et al.Enhanced tolerance of the rat myocardium to ischemia and reperfusion injury early after acute myocardial infarction[J].Basic Res Cardiol,2007,102(4): 327-333.
[6]Martin JL,Mestril R,Hilal-Dandan R,et al.Small heat shock proteins and protection against ischemic injury in cardiac myocytes[J].Circulation,1997,96(12):4343-4348.
[7]秦文艳,刘保江,田首元,等.异氟醚对大鼠急性心肌缺血再灌注损伤的保护作用[J].中西医结合心脑血管病杂志,2008,6 (6):667-669.
[8]庞斯斯,张小进,姜苏蓉,等.Akt参与热休克蛋白27保护大鼠心肌细胞过氧化损伤[J].南京医科大学学报(自然科学版),2008,28(5):613-617.
[9]杨萍,刘起展,李爱萍,等.亚砷酸钠所致人胚肺成纤维细胞增殖兴奋效应与氧化应激的关系[J].中华劳动卫生职业病杂志,2006,(2):103-105.
