纳米三氧化二砷磁性脂质体的热化疗作用对卵巢癌细胞nm23H1及c-myc的影响*
邢宝玲,张东生,王 丽,林 梅,余慧萍
(1.东南大学医学院病理与病理生理学系,南京210009;2.常州市妇幼保健医院,江苏 常州213003)
磁性微载体是一种独特的靶向药物运载系统,包括纳米脂质体、纳米球和纳米囊等,目前此类药物磁性载体已可达纳米水平。磁性粒子不仅可以被用作药物载体,还可在交变磁场下发挥其居里温度的特性升温恒温,从而对肿瘤进行热疗及化疗。近几十年来,砒霜(三氧化二砷,As2O3)治疗白血病取得了良好的临床效果,对实体肿瘤的治疗研究也显示出良好的应用前景。本研究小组已成功制备了在交变磁场下控温恒温的As2O3磁性纳米脂质体[1],其热化疗双重作用可强烈抑制人卵巢癌HO-8910细胞的生长并诱导凋亡[2]。本文通过 nm23H1和c-myc表达的研究从分子水平进一步揭示As2O3磁性纳米脂质体热化疗治疗卵巢癌的机制。
1 材料和方法
1.1 主要材料和仪器
空白脂质体、As2O3溶液、纳米As2O3脂质体以及以 Mn0.4Zn0.6Fe2O4为载体的 NML 和 NMLA 由本实验室自行制备[1];人浆液性卵巢癌HO-8910细胞株,中国科学院上海细胞研究所;β-actin、nm23H1、c-myc上下游引物,申能博彩公司合成;RT-PCR试剂盒,Takara公司;能谱仪,EDAX,美国;基因扩增仪,基因公司。
1.2 方法
1.2.1 细胞培养
HO-8910细胞接种于含有10%小牛血清的RPMI1640培养液中,在37℃、饱和湿度、体积分数为5%CO2的培养箱中培养,实验时取对数生长期细胞。
1.2.2 工作液的制备
以含10%小牛血清的RPMI1640培养基将前述5种制剂分别配成工作液,使 As2O3的浓度为6 μmol·L-1,磁性材料的浓度为 15 mg·mL-1,对照组选用含10%小牛血清的RPMI1640培养液。
1.2.3 细胞处理、形态学观察及能谱分析
制备浓度为3×105mL-1的细胞悬液,以每瓶4 mL种于6个培养瓶中,培养48 h后,分别加入以上5种工作液及培养液,并将NMLA热疗组和NML热疗组细胞置于200 kHz、4 kW的AMF中加热40 min,继续培养48 h后取出,收集细胞。制备超薄切片。
1.2.4 RT-PCR 分析 nm23H1、c-myc 的 mRNA表达
提取并纯化总RNA。RT反应条件:42℃ 60 min,99 ℃ 5 min,0 ℃ 5 min.PCR 引物:nm23H1 F 5'GTGAAAAGCAATGTGGT 3',R 5'TTGCCATGGTCTGGGAG 3',267 bp;c-myc F 5'AAGTCCTGCGCCTCGCAA 3',R 5'GCTGTGGCCTCCAGCAGA 3',248 bp;β-actin F 5'GTGGGGCGCCCCAGGCACCA 3',R 5'TTGCCATGGTCTGGGAG 3',513 bp。
1.3 统计学方法
用SPSS11.5统计软件进行分析,以P<0.05为差异具有统计学意义。
2 结果
透射电子显微镜下观察,As2O3化疗和热疗后,均可见凋亡的HO8910细胞,染色质浓聚深染,边集于核膜,形成致密的环状或半月形结构,部分线粒体肿胀空化,细胞质膜有内折及泡状外凸。在纳米磁性脂质体组和磁性纳米As2O3脂质体热疗组细胞浆中明显可见散在或片状聚集的电子密度高的物质(见图1),扫描电子显微镜下,任选一个纳米As2O3磁性脂质体处理的细胞,能谱分析发现含有锰、锌、铁和砷等组分(见图2)。

图1 As2O3纳米磁性脂质体热疗组:HO8910细胞胞浆内可见颗粒状、片块状电子密度高的物质聚集,细胞核内异染色质浓染,边集于核膜
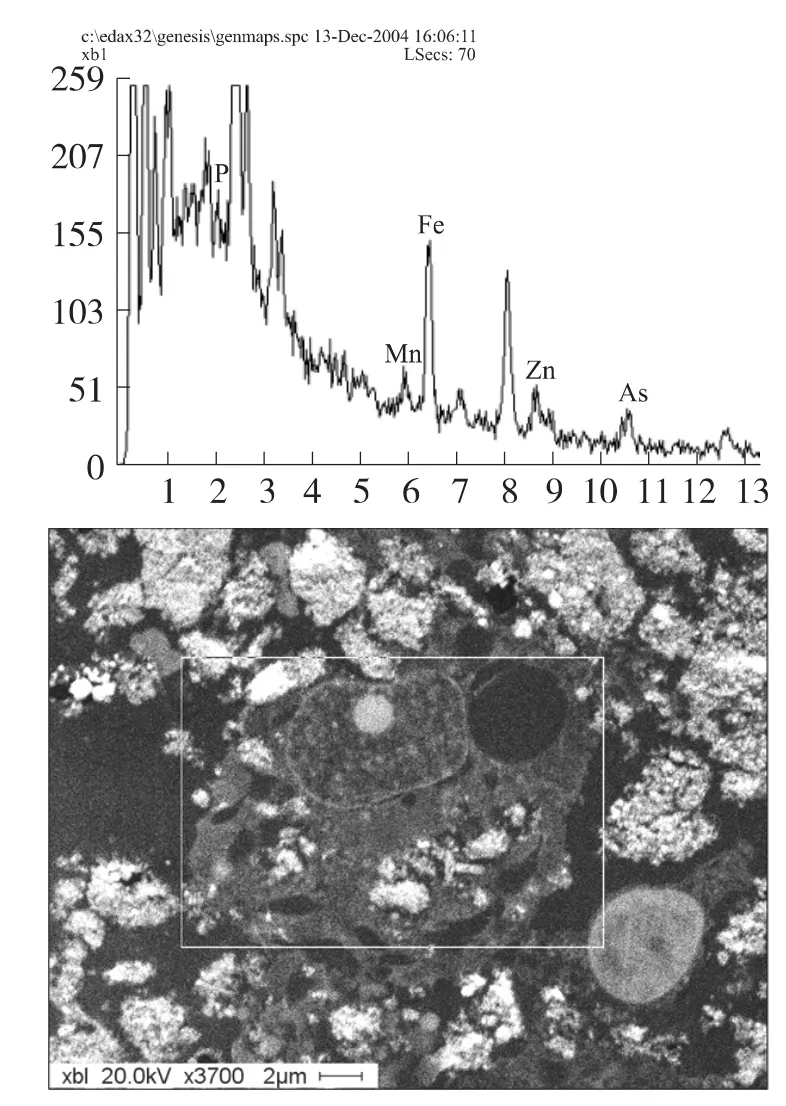
图2 纳米As2O3磁性脂质体热疗处理细胞48 h的切片能谱图(P元素为PBS缓冲液及磷脂中含有)
用Total Lab分析软件对PCR电泳条带进行扫描分析,目的片段和β-actin的比值作为实验数据,用 SPSS11.5统计软件进行单因素方差分析,nm23H1mRNA在HO8910细胞(培养液组,空白脂质体组)中有表达,As2O3溶液、As2O3脂质体及As2O3磁性脂质体可使其表达升高(P<0.05),磁性脂质体单纯热疗不改变其表达量(P>0.05)(见图3(a))。c-mycmRNA在HO8910细胞中有表达,As2O3溶液、As2O3脂质体和磁性脂质体单纯热疗均使其表达下降(P<0.05),As2O3磁性脂质体的热疗及化疗作用对其表达量的下调更为明显(P<0.05)(见图3(b))。

图3 1纳米As2O3磁性脂质体热疗组,2纳米磁性脂质体热疗组,3纳米As2O3脂质体组,4As2O3溶液组,5空白脂质体组,6培养液组,N阴性对照组(cDNA)
3 讨论
纳米脂质体是一种定向药物载体,NMLA将Mn0.4Zn0.6Fe2O4磁感应粒子与 As2O3包裹于脂质体内,利用纳米粒子载药量高、细胞亲和力强的特点,在高频AMF中将热疗和化疗的作用协同放大,对人浆液性卵巢癌HO-8910细胞具有明显的生长抑制和促凋亡作用。
在治疗恶性肿瘤方面,As2O3诱导凋亡及对抗肿瘤转移相关基因的研究进行得较为广泛而且深入[3-4],而对于热疗治疗肿瘤的机制研究较少,但也有文献认为热疗也可诱导凋亡、对抗转移,还可以逆转肿瘤细胞耐药[5-6]。热疗与化疗作用不仅可以相加,而且可以产生协同放大的效应,同时或化疗以后进行热疗,可以对化疗制剂发挥增敏作用[7]。
nm23H1基因对肿瘤转移有抑制作用[8],在正常卵巢和卵巢良性肿瘤中均有nm23H1表达,但卵巢癌中的nm23表达率明显高于正常卵巢组织、良性和交界性肿瘤,提示nm23H1表达与卵巢癌发生有关。淋巴结阴性的肿瘤nm23H1表达水平显著高于淋巴结阳性的肿瘤,说明nm23H1基因是在卵巢癌发生早期被激活,对卵巢癌的淋巴结转移起抑制作用。黄守国[9]研究As2O3对黏液性卵巢癌3AO的作用,体外实验的结果是,As2O3诱导3AO细胞表面Fas基因的过量表达导致凋亡,诱导nm23基因的上调,抑制恶性卵巢肿瘤细胞的侵袭转移能力。本实验显示,nm23H1在卵巢癌细胞HO8910中有明显的表达,As2O3上调nm23H1的表达,磁性脂质体单纯热疗对它的表达无明显影响。本实验的热疗与水浴、微波等加热方式不同,是纳米磁性粒子进入细胞介导的反应,更为直接快速,对癌细胞的杀伤力度更强,而热疗本身是否能够抑制肿瘤转移及其途径,还需要进一步研究。
c-myc基因与恶性肿瘤的发生发展密切相关,有学者[10]研究了Myc的相关蛋白Max和Mad,发现在正常细胞和癌细胞中c-myc都表达,其正常表达是细胞完成周期过程所必须的,但正常细胞中高表达Mad,而癌细胞中高表达Max,c-myc的表达产物与Mad的表达产物竞争结合Max蛋白,癌细胞中Myc-Max蛋白二聚体促进了人端粒酶逆转录酶(hTERT)基因的转录,正常细胞中hTERT的低表达与Myc-Max蛋白二聚体转录活性的丢失有关。Shen等[11]实验证实,经 As2O3诱导后,细胞的 Bcl-2和c-myc基因表达均下调,一方面促进细胞凋亡的发生,另一方面通过下调hTERT的表达来下调端粒酶活性。Trieb[12]发现高温(42.5 ℃,90 min)可逆性下调骨肉瘤细胞的端粒酶活性,抑制骨肉瘤细胞的增生。但热疗与c-myc的关系不清楚。
33% ~37%的卵巢上皮性癌有c-myc基因的扩增或过表达,c-myc过表达更常见于浆液性腺癌,与肿瘤分期有关,提示在肿瘤进展期中起作用。HO8910细胞来自于浆液性卵巢癌患者的腹水中,经As2O3或热疗的作用后,它的表达量均下降,As2O3和热疗的联合处理使其表达进一步降低,推测As2O3和热疗都可通过降低c-myc基因的表达来诱导HO8910细胞凋亡,二者联合可以增强这一途径诱导凋亡,但本实验中是否c-myc的下降通过抑制hTERT基因转录最终下调端粒酶的活性来诱导凋亡,还需要进一步的实验加以证实。
研究表明nm23基因与c-myc基因在许多肿瘤中有阳性表达,c-myc的阳性率随着卵巢癌浸润程度及淋巴结转移而增高,说明c-myc蛋白过度表达对癌细胞的浸润转移起促进作用。nm23H1的过度表达可促使基底膜的形成,抑制肿瘤的生长和转移,还能部分抑制肿瘤形成[8]。c-myc与nm23之间虽无明确的内在相关性,但对二者的再深入研究,对于进一步了解肿瘤细胞增殖、分化和转移的机制,抗转移药物的筛选将产生不可估量的作用。本研究通过新纳米药物剂型-NMLA对HO8910细胞的作用,表明了As2O3和热疗对浆液性卵巢癌的治疗作用与cmyc和nm23 H1相关,NMLA的热化疗作用还可协同增强下调c-myc的表达。
[1]邢宝玲,张东生.纳米As2O3磁性脂质体的制备及表征[J].南京医科大学学报(自然科学版),2005,25(1):13-19.
[2]邢宝玲,余惠萍,张东生.纳米三氧化二砷磁性脂质体对卵巢癌HO-8910细胞热化疗作用的研究[J].现代医学,2007,35(6):419-423.
[3]Zhang X W,Yan X J,Zhou Z R,et al.Arsenic Trioxide Controls the Fate of the PML-RARalpha Oncoprotein by Directly Binding PML[J].Science,2010,328(5975):240-243.
[4]王琼,王子妤,林梅,等.As2O3纳米粒的制备和体外治疗肺癌及其抗转移机制实验[J].纳米技术与精密工程,2008,6(2),99-102.
[5]Shido Y,Nishida Y,Suzuki Y,et al.Targeted Hyperthermia Using Magnetite Cationic Liposomes and an Alternating Magnetic Field in a Mouse Osteosarcoma Model[J].J Bone Joint Surg Br.,2010,92(4):580-585.
[6]Wrzal P K,Bettaieb A,Averill-Bates D A.Molecular Mechanisms of Apoptosis Activation by Heat Shock in Multidrug-Resistant Chinese Hamster Cells[J].Radiat Res,2008,170(4):498-511.
[7]Amber P Barnes,Brigitte E Miller,Gregory L Kucera.Cyclooxygenase Inhibition and Hyperthermia for the Potentiation of the Cytotoxic Response in Ovarian Cancer Cells[J].Gynecologic Oncology,2007,104:443-450.
[8]Otsuki Y,Tanaka M,Yoshii,S.Tumor Metastasis Suppressoe Nm23H1 Regulates Rac1 GTPase by Interaction with Tiam[J].Proc Natl Acad Sci,2001,98(8),4385-4390.
[9]黄守国,孔北华,杨瑞芳.三氧化二砷诱导人卵巢癌裸鼠腹腔转移瘤的形成及机制的初步研究[J].癌症,2002,21(4):401-404.
[10]Fujimoto R,kamata N,Taki M,et al.Gene Expression of Telomerase Related Proteins in Humannormal Oral and Ectocervical Epithelial Cells[J].Oral Oncology,2003,39(5):445-452.
[11]Shen L,Chen T X,Wang Y P,et al.As2o3Induces Apoptosis of the Human Blymphoma Cell Line MBC-1[J].J Biol Regul Homeost Agents,2000,14(2):116-119.
[12]Trieb K,Thurnher D,Bakroeva M,et al.Reversible Downregulation of Telomerase Activity by Hyperthermia in Osteosarcoma Cells[J].Int J Hyperthermia,2000,16(5):445-448.

