低温对黄瓜几种内源激素含量的影响
阎世江,刘 洁,张继宁,司龙亭
(1山西省农业科学院蔬菜研究所,山西太原,030031;2山西省农业科学院科技情报研究所;3沈阳农业大学园艺学院)
黄瓜(Cucumis sativusL.)属葫芦科1年生草本蔓生攀缘植物,喜温,对低温十分敏感[1],由于目前常在气温较低的冬春季节进行保护地黄瓜栽培,因此低温对生产带来巨大危害,成为最主要的限制因素。随着研究的深入,有关黄瓜耐低温性的研究已经开展,主要集中在耐低温鉴定[2]、低温下有关性状的遗传[3,4]、低温对生理指标的影响[5,6]、品种选育[7,8]等方面,而进一步有关抗寒基因表达的研究少见报道。学者普遍认为,植物激素可能是抗寒基因表达的启动因素,而应用植物生长调节剂是生产上控制作物抗寒力的可能途径[9]。笔者利用6份黄瓜高代自交系,给予其低温处理,调查低温对脱落酸(ABA)、生长素(IAA)、赤霉素(GA3)、腐胺(Put)、亚精胺(Spd)、精胺(Spm)的含量的影响,以期摸索黄瓜耐低温性的机理,为今后的抗逆育种奠定理论基础。
1 材料与方法
1.1 供试材料
选取9504,9506,9507,9511,9514,9517 等耐低温性不同的 6 份材料。其中9504,9507 耐低温性较强;9511,9514耐低温性居中;9506,9517耐低温性较弱。
1.2 方法
1.2.1 材料种植与性状调查 本试验于2006年3月开始至6月结束。3月将9504等6份材料播种于沈阳农业大学园艺学院育种基地1号温室,每份材料播40粒,30 d后,待其长至3片真叶,分苗至营养钵(10 cm×10 cm),每份材料取5株,将苗拿到日本SANYO公司产MLR-350H型人工光照培养箱中进行低温处理,每天光照处理7.5 h,强度为30μmol(m2·s)-1,约合2 000 lx,白天12℃,晚上8℃,共处理14 d。另取5株作对照,随机区组设计,3次重复,然后调查耐低温性及脱落酸(ABA)、生长素(IAA)、赤霉素(GA3)、腐胺(Put)、亚精胺(Spd)、精胺(Spm)的含量。耐低温性分级标准如下:0级,全株受冻死亡或接近死亡;1级,秧苗各叶片普遍受冻,其中3~4叶受冻面积>50%;2级,秧苗3~5叶受冻,其中2~3叶受冻面积>50%;3级,秧苗2~4叶受冻,其中1~2叶受冻面积>50%;4级,秧苗1~2叶受冻,面积约20%~30%;5级,秧苗生长正常,无任何受冻症状[10]。测定内源激素的含量采用张宪政等[11]的方法。数据分析采用DPS软件,Excel统计并制图。
2 结果与分析
2.1 黄瓜幼苗耐低温性
供试的6份材料的耐低温性在材料间差异达极显著水平(表1),说明它们的耐低温性差异很大,即耐低温性不同,因此可进行进一步的分析。
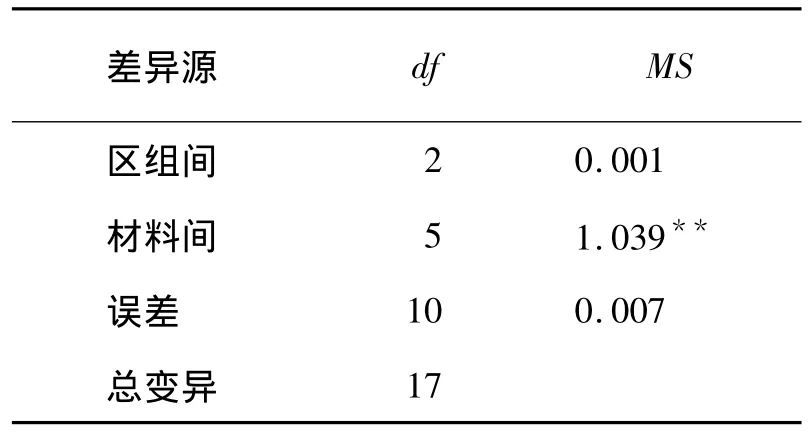
表1 6份黄瓜幼苗耐低温性的方差分析
试验结果表明,材料9504,9507的耐低温性最高,达4以上;9511,9514的耐低温性居中,在4左右;9506,9517的耐低温性最低,在2.1以下(图1)。
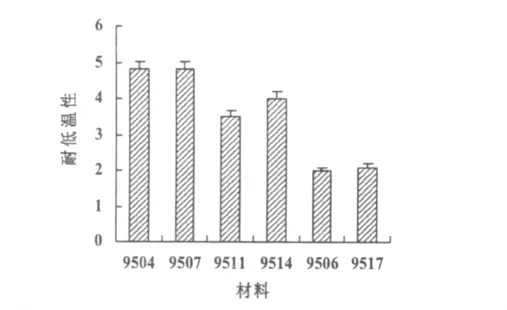
图1 不同材料的耐低温性
2.2 低温对内源激素含量的影响
常温条件下,6份材料间的差异不显著,经低温处理,在材料间的差异均达显著水平(表2,表3)。
经过低温处理供试的6份材料ABA的质量摩尔浓度均出现大幅度的增加(图2)。其中9504,9507增加的幅度较大,分别达2.301,3 456 μmol·g-1;9511,9514 增加的幅度居中,分别达 1.8,1.5 μmol·g-1;而 9506,9507 增加的幅度较低,达 1.166,1.316 μmol·g-1。
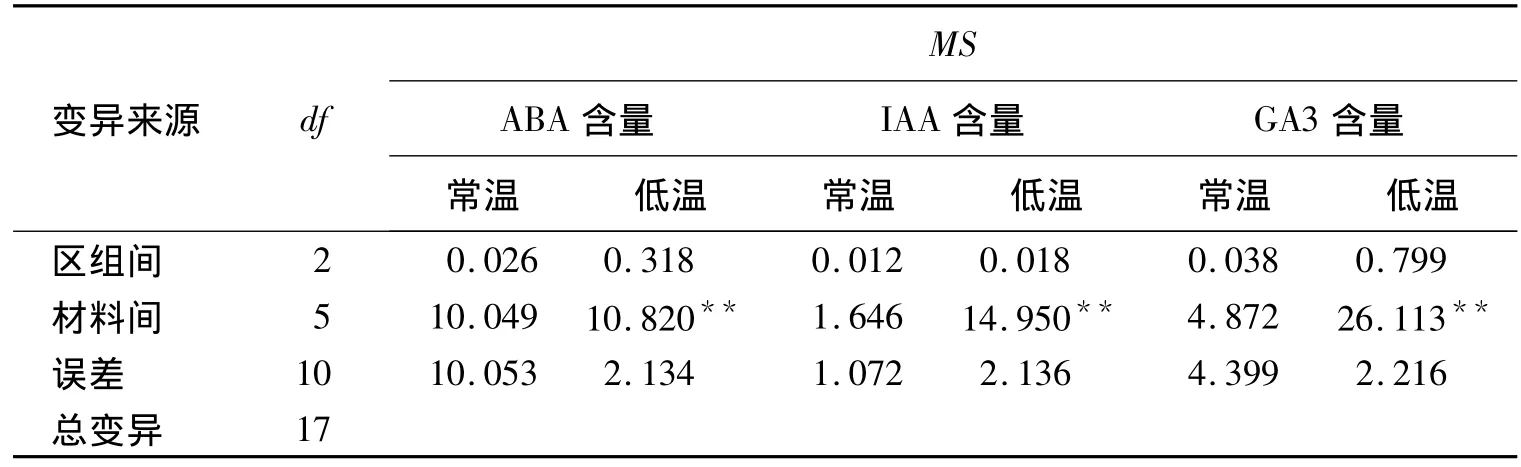
表2 低温对6份材料ABAIAAGA3含量影响的方差分析
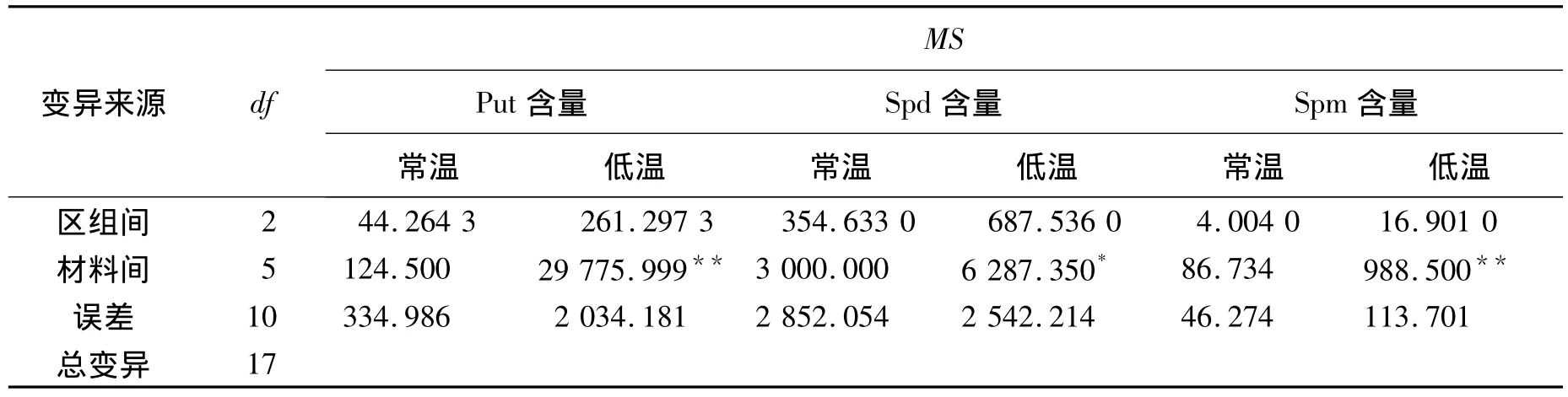
表3 低温对6份材料多胺含量影响的方差分析
所有材料经低温处理后,IAA含量均出现增加(图3)。其中9504,9507的含量与增加的幅度均较大,9507的IAA质量摩尔浓度达2.438μmol·g-1;而9506,9517的质量摩尔浓度最低,9506的IAA达1.41 μmol·g-1,9517 的 IAA 达1.1 μmol·g-1;耐低温性中等的材料 9511,9514 居中。
经比较发现,9504,9507等材料的 GA3质量摩尔浓度增幅较大,分别增至12.616,10.618μmol·g-1(图4);9506,9517 的增幅很小,分别达 2.282,2.357 μmol·g-1;9511,9514 的增幅居中。变化的趋势与ABA,IAA类似。
由于Put,Spd,Spm均属于PA,且作用机理相近,因此将这3类生长调节物质含量综合说明。在常温条件下,3类物质的含量基本保持在相同的水平上,经低温处理,全部出现含量增加(图5~图7)。9504,9507等材料中3类物质的质量摩尔浓度较高,9504的分别为256,350,56μmol·g-1;9507的分别为254,340,61 μmol·g-1。9506,9517 等材料中 3 类物质的质量摩尔浓度较低,9506 的分别为 150,300,41 μmol·g-1;9517 的分别为162,300,42 μmol·g-1。9511,9514 等材料中3 类物质的质量摩尔浓度居中,9511 的分别为 210,315,45 μmol·g-1;9514 的分别为 200,320,46 μmol·g-1。
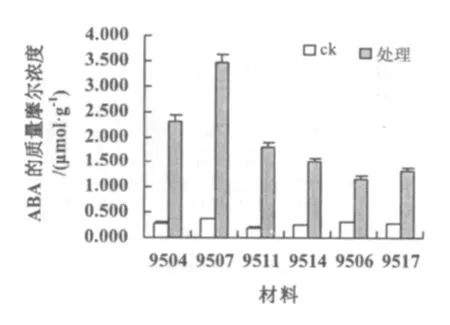
图2 低温处理对不同材料ABA含量的影响
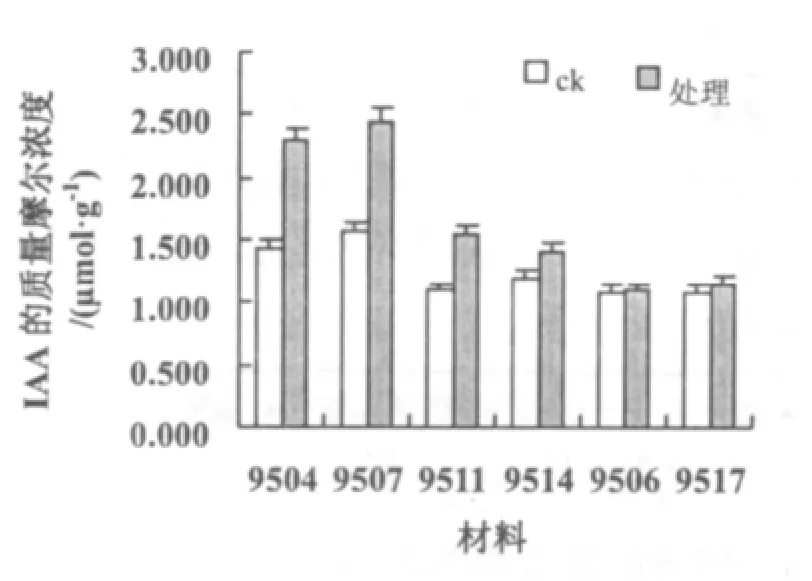
图3 低温处理对不同材料IAA含量的影响
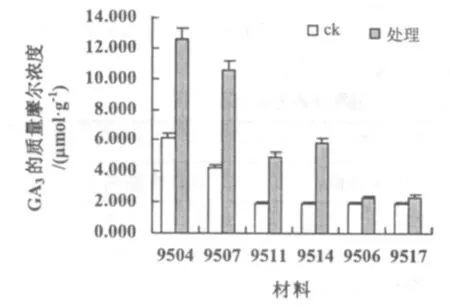
图4 低温处理对不同材料GA3含量的影响
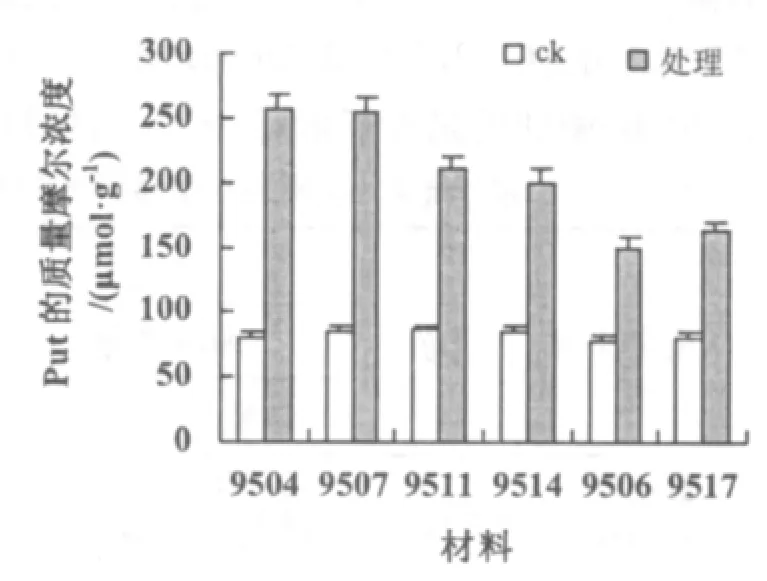
图5 低温处理对不同材料Put含量的影响
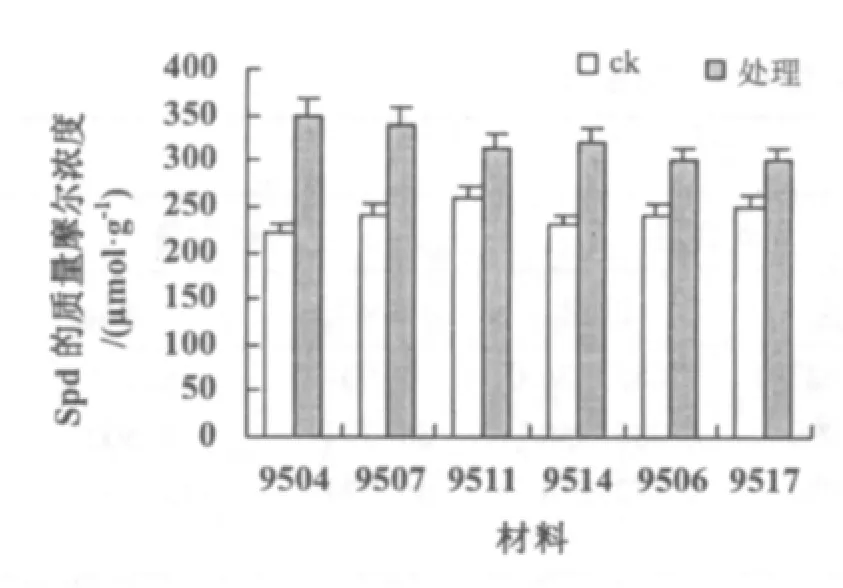
图6 低温处理对不同材料Spd含量的影响
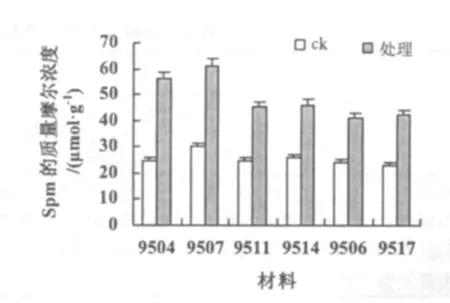
图7 低温处理对不同材料Spm含量的影响
2.3 内源激素含量与耐低温性的相关分析
耐寒指数与处理后的全部激素含量的偏相关均呈正相关,但均未达显著水平,IAA含量与GA3含量呈显著负相关(表4)。IAA含量与Put含量、Spm含量的偏相关,GA3含量与3类多胺含量的偏相关为显著正相关。
在单相关中耐寒指数与与全部激素含量均达显著正相关,ABA含量与除Spd含量外的其余指标均达显著正相关,IAA含量与GA3含量达显著负相关,GA3含量与Put含量、Spd含量与Spm含量达显著正相关。
其余性状间的相关未达显著水平。
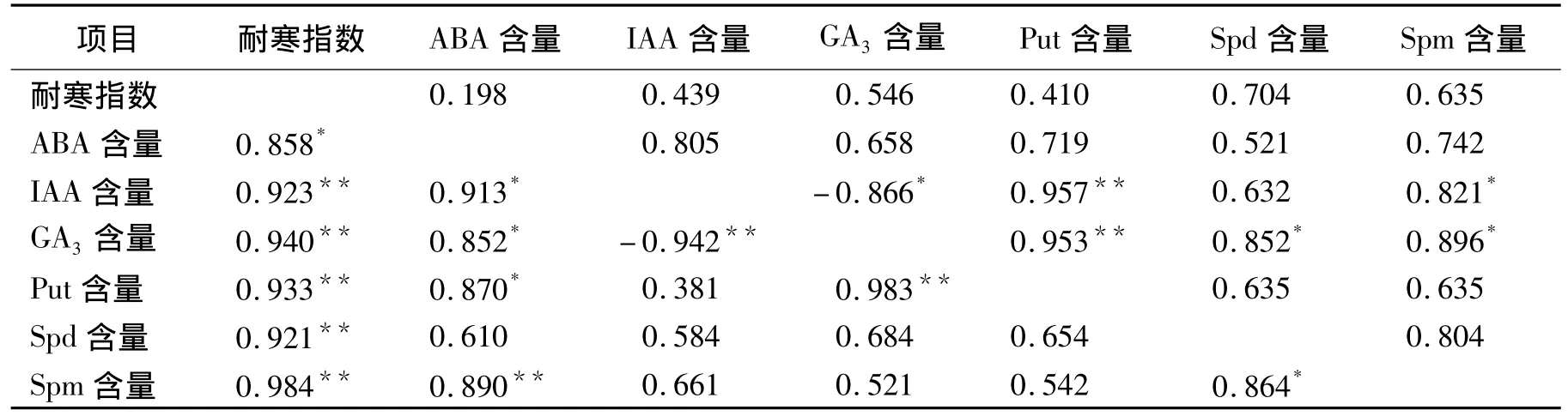
表4 内源激素含量与耐低温性的相关分析
3 讨 论
植物激素是植物正常代谢的产物,是在植物体内合成的,并能从产生部位转移到作用部位,其在很低的浓度下就能调节植物生长发育的有机物质。目前激素与黄瓜低温耐受性的关系的研究日益受到广大科研工作者的重视。许多报道指出,植物在低温下ABA含量增加,且具有较高水平的ABA含量可提高菜豆和棉花抗冷性[12]。欧阳琳等[13]通过比较盐、冷、热激等3种不同胁迫超级稻幼苗结果表明,3种处理苗的ABA,GA3,IAA含量均高于未处理苗。上述结论基本与本次试验的结论相同。孙红梅等[14]报道,低温贮藏期间,兰州百合母鳞茎与新鳞茎的GA3,IAA含量均有升高过程,而ABA含量呈下降趋势。究其原因,可能是处理的条件与试验材料的不同引起的。王丽丽等[15]报道,随着低温处理时间的延长,GA3和IAA含量的变化趋势表现为先升高后降低。可见试验结果与取材的时间密切相关。
结合本次试验的结果,笔者认为在低温来临时,上述几种激素的含量均会降低,但耐低温性强的材料,可能开启了一些基因,使这些激素又开始积累,这些激素除直接对黄瓜耐低温性起作用外,还调控了其它的代谢,间接对耐低温性起作用。如ABA提高植物耐低温性与对细胞微管的生理稳定性的维持有关[16],特别是消除冷温引起的次生水分胁迫伤害[12]。IAA可以通过增加细胞壁的可塑性,增强细胞伸展性。GA3含量的高低与从光合器官输入可溶性糖有密切关系。
多胺是一类具有生物活性的脂肪族含氮碱,对植物生长发育、形态建成及抗逆性有重要调节作用[17]。有学者认为,多胺处理可以降低低温贮藏冷害的发生,延长保鲜期[18,19]。其中Spm抑制冷害效果好于Put和Spa[20~22]。其原因可能是多胺处理可延缓低温条件下黄瓜叶绿素的分解、可滴定酸含量的降低和维生素C的降解,使可溶性固形物和果肉硬度保持在较高水平。黄瓜苗期耐低温性与内源PA的研究少见报道,本次试验得出的结论与上述结论相近。黄瓜耐低温性与膜流动性及膜脂肪酸构成关系密切,由于多胺可以结合到细胞膜的磷脂部位,防止细胞内溶质外渗[23],其含量增加还可以降低不饱和脂肪酸下降速率,它能抑制酸性蛋白酶和RNA酶的活性,保持膜脂高的不饱和脂肪酸组成,延缓脂肪酸不饱和度下降,抑制脂肪酸的膜脂过氧化,从而提高了膜的流动性,起到稳定细胞膜结构和原生质的作用,这都有利于提高膜的抗冷性和对低温的适应能力。
笔者在测定激素的过程中还发现,对于测定黄瓜激素含量没有成熟的方法,只能借鉴别的蔬菜的方法,并在实践中摸索,测定的步骤多,前处理时间很长,尤其是使用液相色谱仪,提取的样品不能放置很长时间,在提取时往往由多人完成,增加了人为误差。对最终的结果有一定的影响,以后如有条件,对于激素的提取与测定的研究也要多加重视。
[1] 周长久.现代蔬菜育种学[M].北京:科学技术文献出版社,1996.
[2] 朱其杰,高守云,蔡洙湖,等.黄瓜耐冷性鉴定及遗传规律的研究[C]//李树德.中国主要蔬菜抗病育种进展.北京:科学出版社,1995:474-462.
[3] 于拴仓,崔鸿文,孟焕文.黄瓜发芽期耐低温性鉴定方法与指标的研究[J].西北农业大学学报,2000,28(3):1-6.
[4] 庞金安,沈文云,马德华.黄瓜幼苗耐低温指标研究初报[J].天津农业科学,1998,4(2):53-56.
[5] 刘鸿先,曾韶西,李平.植物抗寒性与酶系统多态性的关系[J].植物生理学通讯,1981(6):6-11.
[6] 沈文云,侯锋,吕淑珍,等.低温对杂交一代黄瓜幼苗生理特性的影响[J].华北农学报,1995,10(1):56-59.
[7] 王孝琴,胡云海.三个耐寒黄瓜品种简介[J].长江蔬菜,2003(11):10.
[8] 李加旺,孙忠魁,杨森,等.60Coγ射线在黄瓜诱变育种中的应用初报,中国蔬菜,1997(2):22-24.
[9] 罗正荣.植物激素与抗寒力的关系[J].植物生理学通讯,1989(8):1-5.
[10] 查丁石,陈建林,丁海东.茄子耐低温弱光鉴定方法初探[J].上海农业学报,2005,21(2):100-103.
[11] 张宪政,陈凤玉,王荣富,等.植物生理学[M].沈阳:辽宁科学技术出版社,1994.
[12] RIKIN A,BLUMENFELD A,RICHMOND A E.Chilling resistance as affected by stressing environments and abscisic acid[J].Bot Gas,1976,137(5):307-311.
[13] 欧阳琳,洪亚辉,黄丽华,等.不同逆境胁迫信号对超级稻幼苗生理生化影响及植物激素变化的初步研究[J].农业现代化研究,2007,28(1):104-106.
[14] 孙红梅,李天来,李云飞.兰州百合鳞茎发育及低温解除休眠过程中内源激素的变化[J].植物研究,2006,26(5):570-576.
[15] 王丽丽,于锡宏.低地温对黄瓜幼苗内源GA3和IAA含量的影响[J].北方园艺,2004(3):44-45.
[16] 何若韫.植物低温逆境生理[M].北京:中国农业出版社,1995.
[17] 戴尧仁.多胺及其在植物体内的生理作用[J].植物学通报,1988,5(2):69-76.
[18] 潘永贵.多胺对采后果蔬生理影响及其应用[J].热带农业科学,1999(4):68-74.
[19] 陈学好,于杰,李伶利.高等植物开花结实的多胺研究进展[J].植物学通报,2003,20(1):36-42.
[20] 乔勇进,冯双庆,李丽萍,等.多胺处理对黄瓜贮藏冷害及品质的影响[J].吉林农业大学学报,2005,27(1):55-58.
[21] 乔勇进,冯双庆,李丽萍,等.热处理、多胺处理对黄瓜膜脂肪酸变化的影响[J].食品科学,2006,27(5):246-249.
[22] 周玉萍,倪智玲,张海燕,等.外源多胺对香蕉叶片的低温效应模拟实验[J].广州大学学报:自然科学版,2002,1(4):29-31,34.
[23] BOUCHEREAU A,AZIZ A,LARHER F,et al.Polyamines and environmental challenge recent development[J].Plant Science,1999,140:103-125.

