糖络宁对糖尿病大鼠背根神经节细胞凋亡的影响*
朱智耀,高彦彬,邹大威,李步满,彭继升
糖尿病周围神经病变(Diabetic peripheral neuropathy DPN)是糖尿病常见的慢性并发症之一。其发病机制目前有多种学说,其中氧化应激引起的细胞凋亡在DPN的发生发展中发挥重要作用[1-3]。中药复方糖络宁治疗DPN的疗效在临床和实验研究中已得到初步证实[4-8]。本实验通过观察糖络宁对糖尿病大鼠背根神经节(DRG)细胞凋亡、半胱天冬酶-3(Caspase-3)蛋白表达的影响,进一步探讨其治疗DPN的作用机制,为更好地指导临床用药提供理论及实验依据。
1 材料
1.1 动物
SPF/VAF级雄性8周龄 SD大鼠,体重180g~220g,由北京维通利华实验动物公司提供。分笼饲养于北京中医药大学屏障环境动物实验室,环境温度控制在 20℃ ~25℃,相对湿度 40% ~70%,12/12h光照/黑暗循环。实验期间大鼠自由进水和进食。
1.2 药物
中药制剂糖络宁浸膏(主药为生黄芪、生地、牛膝、狗脊、丹参、川芎等)由北京中医药大学东方医院制剂中心提供,1ml浸膏含生药3g。
1.3 试剂
链脲佐菌素为美国 Sigma公司,兔抗大鼠Caspase-3多克隆抗体为美国 Cell Signaling Technology公司产品,原位细胞凋亡检测试剂盒为Roche公司产品(天津灏洋生物分装),两步法免疫组化检测试剂盒、DAB显色试剂盒、Mayor,s苏木素均购自武汉博士德生物工程有限公司。
1.4 仪器
Olympus BX51显微镜、Olympus DP71摄像系统、稳豪血糖仪以及血糖试纸(美国LifeScan,Inc)。
2 方法
2.1 模型建立与分组处理
选用雄性SD大鼠适应性喂养1周,随机选择8只为正常对照(control)组,其余大鼠禁食不禁水12h后,将链脲佐菌素(STZ)溶入柠檬酸缓冲液(p H值=4.2~4.5)配制成1%的溶液,按60mg/kg给予一次性腹腔注射(control组大鼠注射等体积的柠檬酸缓冲液)。72h后大鼠禁食8h断尾取血,测血糖≥16.7mmol/L视为糖尿病造模成功,造模成功大鼠随机分为模型组(model)、糖络宁组(TLN),每组8只,随即开始灌胃。糖络宁组按生药10g/(kg·d)灌胃,模型组给予等量蒸馏水灌胃,连续给药32周。
2.2 一般情况观察与血糖测定
观察各组大鼠毛色、精神状态、摄食量、饮水量、尿量、日常活动情况等;禁食8h后尾静脉采血,4周测定1次血糖。
2.3 免疫组化检测DRG中Caspase-3表达
切片脱蜡至水,3%H2O2室温孵育10min,以消除内源性过氧化物酶的活性。蒸馏水冲洗后滴加封闭液,室温孵育10 min甩去多余液体。滴加1∶150稀释的一抗(Caspase-3多克隆抗体),4℃过夜(并同时用PBS代替一抗作为阴性对照)。次日PBS冲洗,滴加聚合HRP标记抗兔IgG,37℃孵育30 min,PBS冲洗,DAB显色,自来水充分冲洗,苏木素复染、脱水透明、封片。从Caspase-3在背根神经节中表达结果判断,清晰的背景上胞质和(或)核棕黄色为阳性表达,阴性对照无特异性着色。
2.4 DNA末端标记法(TUNEL)检测细胞凋亡
切片脱蜡至水,蛋白酶 K室温消化30min后,PBS洗片,与阻断剂(0.3%H2O2甲醇溶液)室温孵育30 min,PBS洗片。滴加50ul的 TUNEL反应混合溶液,在湿盒中37℃孵育60 min,PBS冲洗后加入50ul转化剂-POD,在湿盒中 37℃孵育 30 min,PBS冲洗3次,DAB显色,苏木素复染,脱水透明、封片。光镜下观察细胞核中出现棕黄色颗粒者为TUNEL染色阳性细胞。
2.5 图像分析
每张切片在400倍光镜下选取4个互不重叠的视野,使用Image Pro-Plus 5.0.1图像分析软件半定量测定每个视野中所有阳性像素的积分光密度值(IOD),取均值为Caspase-3的结果;TUNEL结果用凋亡神经元的阳性百分率表示,取均值为TUNEL的结果。
2.6 统计学分析
计量资料以均数±标准差(珋x±s)表示,多组均数比较采用方差分析,所有数据均经SPSS13.0软件处理,P<0.05表示差异有统计学意义。
3 结果
3.1 大鼠一般情况观察
正常组大鼠精神状态良好,毛色有光泽,进食和饮水量以及尿量都正常,体重增加明显,活动自如。模型组大鼠进食和饮水量以及尿量都明显增多,神态萎靡,毛竖无光泽,尾巴苍白湿冷,蜷卧拱背,活动少,体重增长缓慢。糖络宁治疗组的大鼠表现与模型组类似,但程度较轻。
3.2 糖络宁对大鼠血糖值的影响
表1显示,与正常对照组比较,造模后大鼠血糖明显升高(P<0.05),同时在未进行糖络宁干预前(0周),TLN组与模型组血糖值无差异(P>0.05)。在TLN干预8周后大鼠血糖开始下降,与模型组相比有统计学差异(P<0.05)。
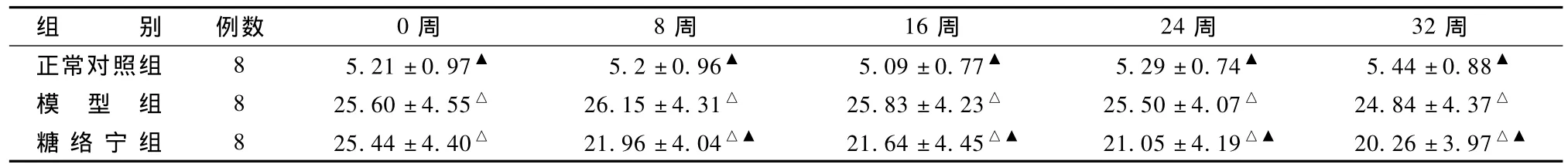
表1 糖络宁对大鼠血糖值的影响
3.3 糖络宁对大鼠背根神经节神经元凋亡阳性率的影响
表2图1显示,模型组背根神经节神经元的凋亡率与正常对照组相比明显增加,有统计学差异(P<0.05);糖络宁组的凋亡率低于模型组,有统计学差异(P<0.05)。

图1 背根神经节TUNEL染色图片(×400)
3.4 糖络宁对大鼠背根神经节Caspase-3蛋白表达的影响
表2图2显示,Caspase-3免疫组织化学染色显示在正常大鼠背根神经节中仅有少量阳性反应。模型组染色呈强阳性反应,棕黄色颗粒状弥漫分布于胞浆中。经图像分析处理,模型组积分光密度值与正常对照组相比明显增多,有统计学差异(P<0.05)。糖络宁干预后,大鼠背根神经节Caspase-3的表达减少,其积分光密度值与模型组比较有统计学差异(P<0.05)。
4 讨论
细胞凋亡主要通路分别为死亡受体介导的凋亡途径(外在途径)和线粒体凋亡途径(内在途径)[9],内外途径都是通过激活caspase家族引起细胞凋亡,在caspase蛋白家族中caspase-3又是研究的焦点,几乎有关caspase的所有凋亡途径最终都是通过激活caspase-3导致细胞凋亡[10]。Caspase-3酶原激活后可切割不同底物,形成蛋白酶级联切割放大机制,最终导致细胞凋亡形态学和生化特征的形成。细胞凋亡的生化学特征主要是细胞核内的染色质在核小体间断裂[11],产生若干大小不一的寡核苷酸片段。TUNEL检测是1种将细胞凋亡时DNA断端进行标记的方法,它的检测原理是荧光素标记的dUTP在脱氧核糖核苷酸末端转移酶的作用下连接到凋亡细胞中断裂DNA的3-OH末端,而荧光素能被结合有过氧化物酶的抗荧光素抗体识别,最后利用过氧化物酶与其底物反应而标记出凋亡的细胞核。该方法是最为常用的检测凋亡手段之一,优点是灵敏度高,特异性强,可原位显示凋亡细胞及其分布。

表2 糖络宁对大鼠背根神经节神经元凋亡阳性率及Caspase-3蛋白表达的影响
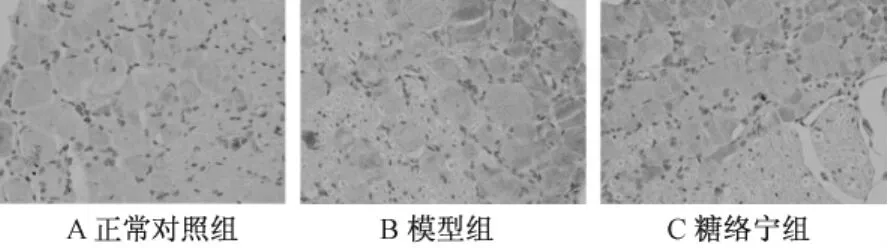
图2 背根神经节Caspase-3蛋白表达图片(×400)
糖尿病周围神经病变是多因素共同作用的结果,细胞凋亡在DPN的发生发展中发挥重要作用。关于DPN细胞凋亡的研究主要集中在背根神经节和坐骨神经,本研究以背根神经节为主。Srinivasan等[12]认为,糖尿病大鼠背根神经节细胞凋亡的增加是DPN的致病因素。Schmeichel等[13]研究也发现,糖尿病大鼠随病程的延长,DRG神经元凋亡率逐渐上升,且Caspase-3蛋白表达和DRG神经元凋亡与DNA氧化损伤存在明显相关性,支持氧化损伤导致细胞凋亡。另外,通过体外对DRG神经元的培养发现,随着培养基中葡萄糖增加,神经突的退变和细胞凋亡增加[14]。在本实验中,模型组同样也出现DRG中Caspase-3表达增加、神经元凋亡率上升的现象,在应用糖络宁干预后细胞凋亡有明显改善,提示糖络宁有抑制凋亡的作用。另外,本实验还观察到糖络宁有一定降低大鼠血糖的功效。
现代医学对于DPN的治疗尚无理想方法。糖络宁以生黄芪、生地、牛膝、狗脊、丹参、川芎等为主要组成,具有益气养阴、滋补肝肾、活血通络之效。经多年临床验证,可以明显改善患者肢体麻木、疼痛、反射减弱等神经系统症状,对神经传导速度、末梢微循环积分以及患者氧化应激状态均有改善作用,在治疗过程中未见明显的不良反应[4、5]。同时动物实验证明,糖络宁可有效提高糖尿病大鼠坐骨神经传导速度,改善糖尿病大鼠的痛觉异常以及氧化应激状态[6、8]。本实验结果表明,糖络宁能抑制DRG中神经元凋亡,从而起到神经保护作用,这可能为DPN治疗提供新思路,为DPN临床防治用药提供实验依据,但糖络宁是通过何种凋亡通路发挥作用有待进一步研究。
[1] Raha S,Robinson BH.Mitochondria,oxygen free radicals,and apoptosis[J].Am J Med Genet,2001,106(1):62-70.
[2] Russell JW,Golovoy D,Vincent AM,et al.High glucose-induced oxidative stress and mitochondrial dysfunction in neurons[J].FASEB J,2002,16(13):1738-1748.
[3] Vincent AM,Russell JW,Low P,et al.Oxidative stress in the pathogenesis of diabetic neuropathy[J].Endocrine Reviews,2004,25(4):612-628.
[4] 周晖,高彦彬,刘铜华,等.糖络宁治疗糖尿病性周围神经病变的临床观察[J].北京中医药大学学报,2002,25(4):59-62.
[5] 李步满,高彦彬,夏晶,等.糖络宁治疗糖尿病周围神经病变临床疗效及其对氧化应激反应的影响[J].中国中医药信息杂志,2011,18(8):8-10.
[6] 张涛静,高彦彬,关崧,等.糖络宁对链脲佐菌素诱导糖尿病大鼠的血糖及冷、热刺激反应的影响[J].北京中医药大学学报(中医临床版),2009,16(2):6-8.
[7] 张涛静,高彦彬,周晖,等.糖络宁对STZ诱导糖尿病大鼠坐骨神经传导速度及病理学的影响[J].中华中医药杂志,2009,24(8):1010-1013.
[8] 夏晶.糖络宁治疗糖尿病周围神经病变的临床观察及对氧化应激的影响[D].北京:北京中医药大学,2010.
[9] Huang Y,Sheikh MS.TRAIL death receptors and cancer therapeutics[J].Toxicol Appl Pharmacol,2007,224(3):284-289.
[10] Yuan J,Yankner BA.Apoptosis in the nervous system[J].Nature,2000,407(6805):802-809.
[11] 陈青,陈丽.糖尿病及其慢性并发症与细胞凋亡[J].国外医学.内分泌学分册,2001,21(5):236-239.
[12] Srinivasan S,Stevens M,Wiley JW.Diabetic peripheral neuropathy-evidence for apoptosis and associated mitochondrial dysfunction[J].Diabetes,2000,49(11):1932-1938.
[13] Schmeichel AM,Schmelzer JD,Low PA.Oxidative injury and apoptosis of dorsal root ganglion neurons in chronic experimental diabetic neuropathy[J].Diabetes,2003,52(1):165-171.
[14] Russell JW,Sullivan KA,Windebank AJ,et al.Neurons undergo apoptosis in animal and cell culture models of diabetes[J].Neurobiol Dis,1999,6(5):347-363.

