替米沙坦对高血压大鼠血管ACE2表达及氧化应激水平的影响
金海燕,钟久昌,2,宋 蓓,2,叶佳颖,张丽红,李宇琳,2,于 茜,徐旭东,林国珍
(1.上海交通大学医学院附属瑞金医院临床心理科与医学基因组学国家重点实验室,上海 200025;2.上海市高血压研究所,上海市血管生物学重点实验室,上海 200025;3.宁波大学医学院分子高血压研究室,浙江宁波 315211;4.复旦大学上海医学院解剖与组织胚胎学系上海 200032)
高血压病是危害人类健康的最常见的慢性病,也是心脑血管病最主要的危险因素[1-2]。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)及其新近发现的催化酶血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)是机体内血管一氧化氮(nitric oxide,NO)生成与氧化应激状态的关键调控因子,在高血压病的发生、发展过程中起着重要的作用[3-6]。替米沙坦(telmisartan)为一种新型长效的AngⅡ1型受体(AT1)的拮抗剂(ARB),已广泛应用于临床治疗高血压患者[1,7-8],但其是否通过调控血管 ACE2表达进而在血管氧化应激调控中发挥作用目前尚未见报道。本研究旨在探讨替米沙坦(telmisartan)对自发性高血压大鼠(spontaneously hypertensive rat,SHR)血管ACE2表达的影响及其参与血管保护功效可能的机制。
1 材料与方法
1.1 动物由上海斯莱克实验动物有限责任公司[许可证号 SCXK(沪)2007-0005]提供SHR大鼠24只及同源对照WKY(Wistar-Kyoto rats,WKY)大鼠8只。将大鼠随机分成4组,每组8只:WKY对照组(WKY-C);SHR对照组(SHR-C);低剂量替米沙坦治疗组(SHR-L);高剂量替米沙坦治疗组(SHRH)。大鼠均为♂,9~10周龄,体质量(250±30)g。大鼠适应性饲养1周。替米沙坦由德国Boehringer Ingelheim公司提供,溶解于无菌生理盐水中,配制浓度为1 g·L-1。大鼠每日灌胃给药(telmisartan 5或10 mg·kg-1或安慰剂生理盐水 5 mg·kg-1),为期10周。实验结束后,麻醉处死大鼠,分离胸主动脉迅速置于液氮,后转入-80℃待测。
1.2 Western blot用Bradford法测定大鼠主动脉组织总蛋白浓度。采用常规的Western blot法检测大鼠主动脉组织中ACE2蛋白与eNOS磷酸化水平。取40 μg总蛋白进样于预灌制的8~10%聚丙烯酰胺凝胶中,100伏电泳2 h,然后电转移至PVDF膜。用5%脱脂奶粉室温封闭2 h后,将膜采用抗ACE2、eNOS一抗及抗磷酸化p-eNOS(Ser1177)一抗(美国Santa Cruz及Cell Signaling公司)孵育过夜。洗膜后接着室温下将膜用二抗孵育1 h 30 min,洗膜3次,每次10 min。最后采用ECL试剂盒显影曝光,对特异性条带进行半定量分析,同时采用α-tubulin蛋白作为内对照。
1.3 NO含量测定采用硝酸还原酶比色法检测主动脉组织中硝酸盐(NO3-)和亚硝酸盐(NO2-)含量来间接反映各种条件刺激下大鼠主动脉组织中NO水平。NO检测试剂盒购自南京建成生物有限公司,严格按说明书进行操作。采用Beckman可见光-紫外分光光度仪,在550 nm条件下,0.5 cm光径比色测各管吸光度值,根据标准曲线计算NO含量。同时设立空白对照和阳性对照组,每个样品检测3次,取其平均值。
1.4 丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法测定大鼠主动脉组织MDA含量,其原理是过氧化脂质产物中的MDA可与TBA缩合,形成红色产物,在532 nm处有最大吸收峰。MDA检测试剂盒购自南京建成生物有限公司,采用分光光度计测定收集主动脉组织上清MDA含量,严格按说明书进行操作。
1.5 统计学处理资料数据以±s表示,采用SPSS(16.0)软件进行分析处理。多个样本均数的比较采用单因素方差分析;多个样本均数的两两比较采用t检验。
2 结果
2.1 替米沙坦对SHR大鼠血管ACE2蛋白表达的影响如Fig 1所示,与WKY大鼠相比,SHR大鼠主动脉组织中ACE2蛋白水平明显降低(0.39±0.05 vs 1.00±0.06,P<0.01)。与SHR对照组相比,替米沙坦低、高剂量治疗组SHR大鼠主动脉组织中 ACE2蛋白表达均明显上升(0.62±0.06,0.65±0.07 vs 0.39±0.05,P 值均 <0.05)。
2.2 替米沙坦对SHR大鼠血管eNOS磷酸化表达及NO水平的影响与WKY对照组相比,SHR大鼠主动脉组织中Ser1177-eNOS磷酸化水平明显降低,伴NO水平下调(p-eNOS:0.43±0.06 vs 1.00±0.04;NO mmol·g-1protein:11.5 ± 2.1 vs 27.8 ±4.9;P值均<0.01,Fig 2、3)。而经替米沙坦治疗后,SHR大鼠(SHR-L与SHR-H组)主动脉Ser1177-eNOS磷酸化表达和NO水平则明显增加(p-eNOS:0.68 ±0.07,0.71 ±0.06 vs 0.43 ±0.06;NO mmol·g-1protein:19.2 ±3.3,23.9 ±3.2 vs 11.5 ±2.1;P值均 <0.05,Fig 2、3)。
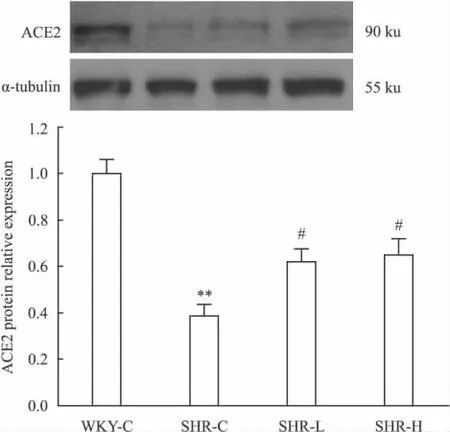
Fig 1 ACE2 protein expression in aortas of WKY rats and SHR

Fig 2 Effects of Telmisartan on Ser1177-eNOS phosphorylation level in rat aortas
2.3 替米沙坦治疗后SHR大鼠血管MDA含量的改变如Fig 4所示,与WKY对照组相比,SHR大鼠主动脉组织 MDA含量上升(393.9±17.9 vs 186.3 ±14.5 nmol·g-1protein;P <0.01)。而经低、高剂量替米沙坦治疗后,SHR主动脉组织MDA含量则明显降低(271.9±16.1,249.2±19.6 vs 393.9±17.9 nmol·g-1protein;P 值均 <0.05)。
3 讨论

Fig 3 Effects of Telmisartan on NO level in rat aortas(mmol·g-1Pro)

Fig 4 Effects of Telmisartan on MDA contents in rat aortas(nmol·g-1Pro)
活性氧族(reactiveoxygenspecies,ROS)增加及氧化应激增强参与高血压病的发生、发展,最终导致高血压内皮功能紊乱和心血管等靶器官损害[3-4,9]。在肾素血管紧张素系统(renin-angiotensin system,RAS)中,AngⅡ是心血管系统中ROS生成和氧化应激的重要激活物[3,5-6,9-11]。ROS 参与多种细胞内信号转导途径,引发血管炎症反应、细胞增殖及血管重塑等过程,最终导致高血压病的发病[2,5-6,9]。NO主要由内皮来源的NO合酶eNOS催化L-精氨酸代谢生成,具有扩张血管、抗炎症、抑制细胞凋亡等作用,对心血管系统具有保护作用。机体内心血管组织ROS的过度生成会降低NO的生物活性,削弱心血管组织的抗氧化能力,从而导致心血管组织损害[9-11]。有趣的是,本研究发现,与 WKY 对照大鼠相比,SHR大鼠血管组织中出现eNOS磷酸化水平下降,同时伴血管NO水平下调及MDA水平增加。MDA是细胞膜氧自由基连锁反应的终产物之一,其含量直接反映细胞脂质过氧化的速率和强度,代表细胞的氧化应激水平。上述提示高血压大鼠主动脉组织中eNOS/NO体系下调可能导致抗氧化能力下调,通过促进MDA生成增加,导致高血压大鼠血管组织氧化应激增强。
ACE2表达或活性异常可能参与高血压病的发生、发展过程,通过调节ACE2的转录与表达为防治高血压病及其并发症的重要手段[1,6,10]。在新的RAS中,ACE2可高效降解 ACE的作用产物 AngⅡ,使之生成Ang-(1-7);还可竞争性地作用于ACE的底物AngⅠ,使之生成Ang-(1-9),后者经ACE作用进一步生成为Ang-(1-7)。Ang-(1-7)为一种较强的舒血管物质肽,主要分布于心脏、血管、肾脏等处和血液中,通过结合Mas受体促进缓激肽、前列腺素和NO的释放,发挥其扩血管、抗氧化及促凋亡等功效[1,4,9-11]。ACE2 基因通过拮抗 AngⅡ的作用减少ROS生成,从而发挥一定的抗氧化功效。新近研究显示,ACE2的过表达能改善小鼠NOS活性且增加NO信号,从而降低机体氧化应激水平,而ACE2基因敲除小鼠出现机体内氧化应激水平增加,造成各组织氧化损伤[6,9]。本研究发现,与WKY对照大鼠相比,SHR大鼠血管组织中出现ACE2蛋白水平降低,同时伴有eNOS/NO体系下调及MDA 增加。Zhong等[5-6]新近研究证实,Ang Ⅱ可以导致小鼠心脏组织ACE2表达下调,而ACE2基因缺失或表达减少可导致心脏和肾脏组织细胞内NADPH氧化酶的活性增加,同时伴有白介素(IL)-1、IL-6、肿瘤坏死因子等炎症介质增加,从而加重AngⅡ介导的心血管及肾脏组织氧化损伤。替米沙坦能通过选择性地、不可逆地阻断AngⅡ与其1型受体AT1结合,减少AT1受体所介导AngⅡ引起心血管的肥大、细胞增殖和血管氧化应激生成,另外还可能反馈性增加AngⅡ与AT2受体的结合,进而抑制心血管增殖及氧化应激损伤,发挥其心血管保护作用[2,7-8,12]。另外,替米沙坦具有特异性的苯丙咪唑环和异芳香基团,具备脂溶性强和组织穿透性高的特性,与AT1受体的亲合力更高,从而对AngⅡ的拮抗作用更强、更持久[2,8,12]。本研究结果显示,长期替米沙坦治疗后,SHR大鼠血管组织中出现ACE2蛋白和eNOS磷酸化水平增加,同时伴血管NO生成增加及MDA水平降低,提示替米沙坦通过调节血管ACE2基因表达及改善eNOS/NO信号,对逆转高血压大鼠血管组织氧化应激损伤中起到一定的作用,从而实现其在高血压治疗中的血管保护功效,但其相关机制有待于深入探讨。ACE2的发现拓展了RAS体系,为深入研究高血压的氧化应激机制及寻求更加符合生理的改善氧化应激治疗策略提供了机遇。通过各种途径干预ACE2表达及活性,可望成为高血压病等氧化应激性疾病防治的新途径。
[1] Zhong J C,Ye J Y,Jin H Y,et al.Telmisartan attenuates aortic hypertrophy in hypertensive rats by the modulation of ACE2 and profilin-1 expression[J].Regulatory Peptides,2011,166(1 - 3):90-7.
[2] 叶佳颖,钟久昌,金海燕,等.替米沙坦对高血压大鼠血管Profilin-1及ERK磷酸化水平的影响[J].心血管康复医学杂志,2010,19(2):166 -9.
[2] Ye J Y,Zhong J C,Jin H Y,et al.Effects of telmisartan on vascular profilin-1 expression and extracellular regulated kinase 1,2 phosphorylation levels in spontaneously hypertensive rats[J].Chin J Cardiovasc Rehabil Med,2010,19(2):166 -9.
[3] Briones A M,Touyz R M.Oxidative stress and hypertension:current concepts[J].Curr Hypertens Rep,2010,12(2):135 -42.
[4] Gwathmey T M,Pendergrass K D,Reid S D,et al.Angiotensin-(1-7)-angiotensin-converting enzyme 2 attenuates reactive oxygen species formation to angiotensin Ⅱ within the cell nucleus[J].Hypertension,2010,55(1):166 -71.
[5] Zhong J C,Guo D,Chen C B,et al.Prevention of angiotensinⅡ-mediated renal oxidative stress,inflammation,and fibrosis by angiotensin-converting enzyme 2[J].Hypertension,2011,57(2):314-22.
[6] Zhong J C,Basu R,Guo D,et al.Angiotensin-converting enzyme 2 suppresses pathological hypertrophy,myocardial fibrosis,and cardiac dysfunction[J].Circulation,2010,122(7):717 -28.
[7] Rizos C V,Elisaf M S,Liberopoulos E N.Are the pleiotropic effects of telmisartan clinically relevant[J].Curr Pharm Des,2009,15(24):2815 -32.
[8] McClellan K J,Markham A.Telmisartan[J].Drugs,1998,56(6):1039-44.
[9] 蒋毅弘,钟久昌.血管紧张素转换酶2、氧化应激与高血压[J].中华高血压杂志,2011,19(6):518 -20.
[9] Jiang Y H,Zhong J C.Angiotensin-converting enzyme 2,oxidative stress and hypertension[J].Chin J Hypert,2011,19(6):518-20.
[10] Zhong J C,Huang D Y,Yang Y M,et al.Upregulation of angiotensin-converting enzyme 2 by all-trans retinoic acid in spontaneously hypertensive rats[J].Hypertension,2004,44(6):907 -12.
[11]廖丽君,郭建荣,贾东林,等.血管紧张素II1型受体拮抗剂用于脓毒症大鼠的实验研究[J].中国药理学通报,2011,27(10):1448-51.
[11] Liao L J,Guo J R,Jia D L,et al.Anti-inflammatory effects of angiotensinⅡtype 1 receptor blocker Losartan on LPS-induced sepsis in rats[J].Chin Pharmacol Bull,2011,27(10):1448 -51.
[12] Fitchett D.Clinical trial update:focus on the ONTARGET study[J].Vasc Health Risk Manag,2007,3(6):901 -8.
- 中国药理学通报的其它文章
- 铜绿假单胞菌上清液诱导J774细胞凋亡过程中Fas蛋白的表达

