外源NO和H2O2诱导不同颜色马铃薯花青素积累
马廷蕊 张金文* 梁慧光* 柳永强
(1 甘肃农业大学农学院,甘肃兰州 730070;2 甘肃省作物遗传改良与种质创新重点实验室,甘肃兰州 730070;3 甘肃省农业科学院马铃薯研究所,甘肃兰州 730070)
花青素(anthocyanin)是一类广泛存在于植物体内的水溶性天然色素,属类黄酮化合物。自然状态下花青素常与各种单糖形成花色苷,因吸光性差异而表现出红、紫和蓝等色彩,其具有抗氧化、抗突变、抗增生等多种生理功能(侯夫云 等,2009;Ma et al.,2012)。NO 作为植物抗逆胁迫和一些生理生化代谢的重要信号分子,在植物次生代谢启动、通过ROS 反应参与植物抗性调控功能方面有重要作用(徐茂军,2007)。H2O2是植物细胞应答逆境产生的重要信号分子,植物通过H2O2过量产生调控一系列胁迫应答和次生代谢合成(李师翁 等,2007),大量研究表明,NO 或H2O2对植物遇到干旱、高温、低温、病害和盐碱等逆境时所产生的很多内源物质有调控作用。近年来研究表明,NO 或H2O2诱导植物次生代谢可以产生紫杉醇(徐茂军 等,2004;徐茂军和董菊芳,2006)、葛根素(徐茂军 等,2006)、金丝桃素(徐茂军 等,2008),而关于其在植物花色素代谢方面的研究很少。本试验采用SNP、H2O2、SNP+ H2O2处理不同块茎颜色的马铃薯(Solanum tuberosumL.),研究其对马铃薯花色素积累及相关酶类的调节,旨在探索NO 和H2O2诱导马铃薯花色素合成反应及调节的机理,为鲜食保健马铃薯品种的选育,马铃薯花青素代谢与调控提供理论依据。
1 材料与方法
1.1 试验材料
供试马铃薯品种陇薯8 号(L8)、陇薯7号(L7)和LC310-2(LC)由甘肃省农业科学院马铃薯研究所提供,山东彩肉(SD)从山东省泰安市农业局引进。其品种特性与主要干物质含量见表1 和图1。
1.2 试验方法
2010年10月中旬采收脱毒微型种薯,3~5 ℃冷藏至2011年4月中旬,试验前取出,选择直径1.5~2.2 cm 的种薯,喷洒40%氯乙醇液催芽6 d(芽长约0.15 cm),置于湿棉布上摊开,在散射光下炼芽7 d,待芽粗壮后整薯盆栽于秦王川试验温室(张和鸣和韩淑蕙,1959;Liu et al.,2011)。现蕾期开始用清水、0.1 mmol·L-1SNP(NO 供体)、0.25 mmol·L-1H2O2、0.1 mmol·L-1SNP+0.25 mmol·L-1H2O2进行处理,每隔7 d 处理1 次,每处理5 株,3 次重复。取样时间按照各品种生育期依次进行,LC 和SD 播种70 d 后取样测定各指标,15 d 后L7 和L8 取样。
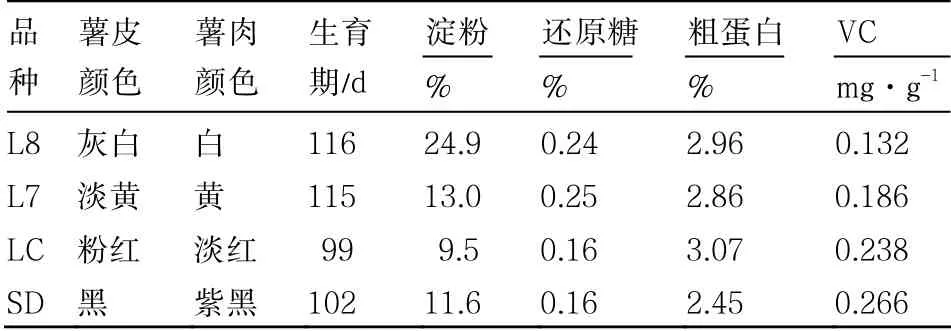
表1 供试马铃薯品种特性和块茎主要干物质含量

图1 供试马铃薯块茎颜色
1.3 测定项目
1.3.1 花青素含量测定 马铃薯块茎去皮后,分别称取薯皮和薯肉薄片2.5 g,室温条件下加石英砂研磨成匀浆,室温下用1%盐酸-甲醇溶液提取,将粗提液暗置24 h,10 000 g 离心5 min,取上清液,测其在530、620 和650 nm 下的吸光值,花青素吸光值按OD530-0.9×OD620-0.1×OD650计算(廉玉姬 等,2009)。
1.3.2 苯丙氨酸裂解酶(PAL)活性测定 马铃薯块茎去皮后,分别称取薯皮和薯肉薄片5 g,加5 mmol·L-1巯基乙醇硼酸缓冲液10 mL、0.5 g PVP,冰浴研磨,匀浆抽气过滤,4 ℃ 10 000 g离心15 min,取上清液1 mL,加0.02 mol·L-1苯丙氨酸1 mL、蒸馏水2 mL;对照为上清液1 mL加入蒸馏水3 mL。30 ℃恒温浴热0.5 h,测其在290 nm 下的吸光值(Liu et al.,2011)。
1.3.3 多酚氧化酶(PPO)活性测定 马铃薯块茎去皮后,分别称取薯皮和薯肉薄片0.5 g,加0.05 mol·L-1磷酸缓冲液(pH 5.5)5 mL,冰浴研磨后加入0.1 mol·L-1邻苯二酚1 mL,混匀后35 ℃恒温浴热15 min,测其在325 nm 下的吸光值(Liu et al.,2011)。
1.3.4 查尔酮异构酶(CHI)活性测定 马铃薯块茎去皮后,分别称取薯皮和薯肉薄片0.5 g,加5 mL 巯基乙醇缓冲液,其中0.05 mol·L-1Na2HPO4(pH 7.0)3 mL、0.05 mol·L-1抗坏血酸0.5 mL、0.018 mol·L-1巯基乙醇1.5 mL,冰浴研磨匀浆,4 ℃ 15 000 g 离心20 min,取上清液1 mL,加0.02 mol·L-1苯丙氨酸1 mL、蒸馏水2 mL;对照为上清液1 mL 加入蒸馏水3 mL。30 ℃恒温浴热0.5 h,测其在290 nm 下的吸光值(Lister & Lancaster,1996)。
试验数据采用SPSS 13.0 软件和Excel 软件进行分析。
2 结果与分析
2.1 SNP 和H2O2处理对不同颜色马铃薯块茎花青素含量的影响
由图2 可知,对于不同块茎颜色的马铃薯,其花青素含量表现为LC﹥SD﹥L7﹥L8,并且SNP 和H2O2处理诱导了马铃薯块茎花青素含量的升高,其效果表现为0.1 mmol·L-1SNP+0.25 mmol·L-1H2O2>0.25 mmol·L-1H2O2>0.1 mmol·L-1SNP>清水(CK)。0.1 mmol·L-1SNP 处理分别使L8、L7、LC 和SD 薯皮花青素含量增加2.13%、3.78%、9.71%、0.47%;H2O2处理分别使L8、L7、LC 和SD 薯皮花青素含量增加5.51%、11.34%、15.77%、18.79%,薯肉花青素含量增加4.91%、13.09%、9.82%、11.57%;SNP+H2O2处理分别使L8、L7、LC 和SD 薯皮花青素含量增加15.75%、13.60%、16.43%、27.77%,薯肉花青素含量增加11.96%、10.37%、25.06%、13.70%。说明NO 和H2O2对马铃薯块茎花青素的合成具有促进作用,且两者均表现为加性效应。
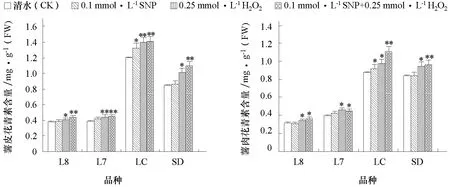
图2 SNP 和H2O2处理对不同颜色马铃薯块茎花青素含量的影响
2.2 SNP 和H2O2处理对不同颜色马铃薯块茎PAL、CHI、PPO活性的影响
由表2 可知,不同颜色马铃薯(薯皮和薯肉)PAL 和CHI 活性LC>SD>L7>L8,且SNP和H2O2处理使PAL 和CHI 活性呈升高趋势,其作用效果表现为0.1 mmol·L-1SNP+0.25 mmol·L-1H2O2>0.25 mmol·L-1H2O2>0.1 mmol·L-1SNP>清水(CK)的趋势。表明NO 和H2O2可以促使马铃薯块茎PAL 和CHI 活性升高,且两者呈加性效应。
不同颜色的马铃薯(薯皮和薯肉)PPO 活性为SD>LC>L7>L8,并且SNP 和H2O2处理使马铃薯块茎PPO 活性升高;除L8 外,其作用效果为0.1 mmol·L-1SNP +0.25 mmol·L-1H2O2>0.25 mmol·L-1H2O2>0.1 mmol·L-1SNP>清水(CK)。同样,NO 和H2O2处理对马铃薯块茎PPO活性的增加具有一定的促进作用,且表现为加性效应。
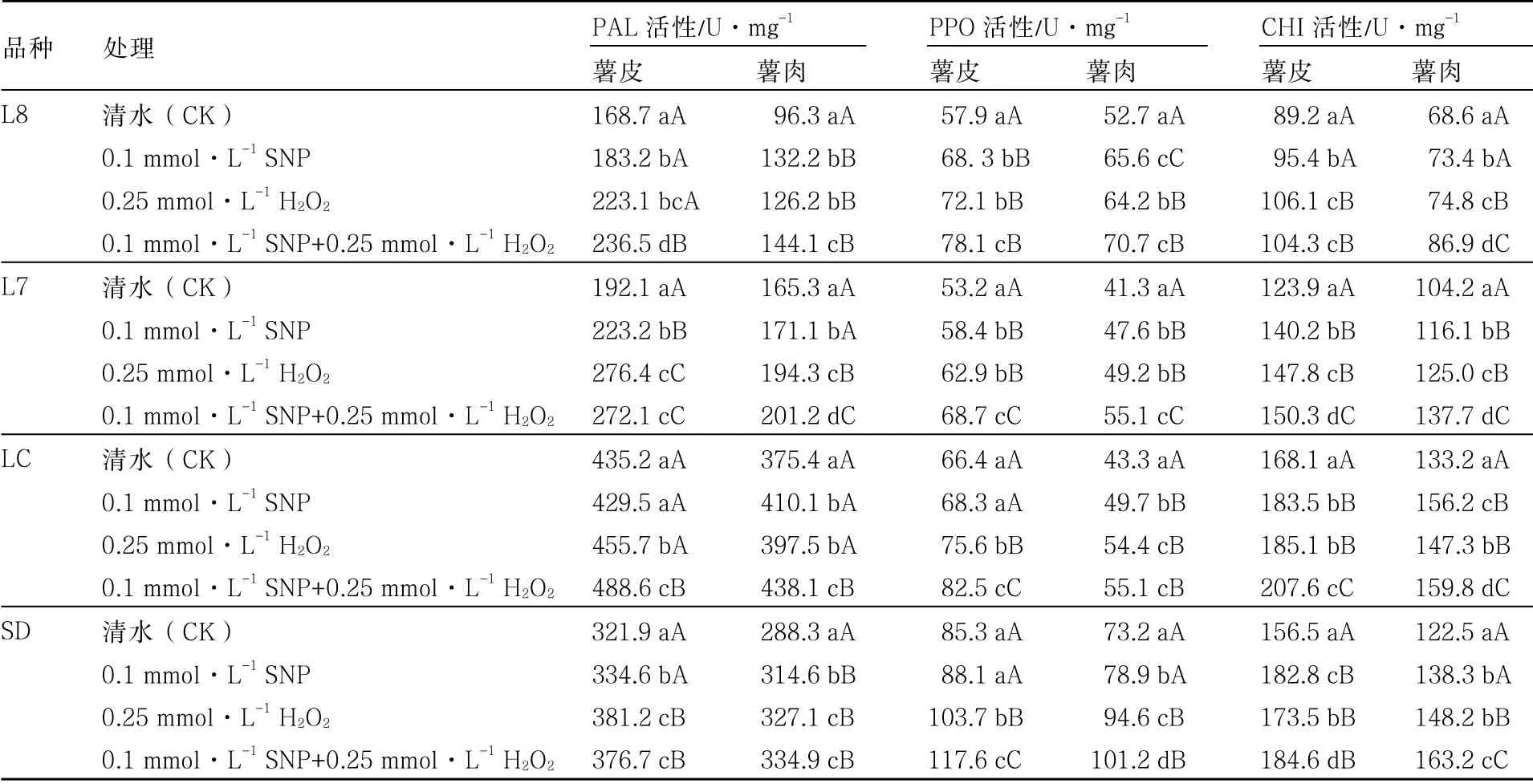
表2 SNP 和H2O2处理对不同颜色马铃薯块茎PAL、PPO 和CHI 活性的影响 FW
3 结论与讨论
在植物次生代谢过程中,很多植物信号物质如MeJa、SA、GA、ABA 和腐胺等对其花色素代谢具有一定的调节作用。GA 通过诱导CHS、CHF、DFR和ANS基因的表达,促进花青素苷合成(Ju et al.,1995;田义 等,2009)。作为植物信号分子的NO 和H2O2,在植物体复杂的次生代谢通路中,通过NOS 依赖途径或相关酶类的激活和诱导调节植物的各种次生代谢进程(徐茂军,2007)。ROS 信号途径作用于NO 的下游并介导NO 诱发植物次生代谢产物合成,但是在不同植物细胞中,NO 对其下游的ROS 等信号途径的调控作用并不完全相同。烟草细胞中PAL活化的诱发作用可以被H2O2淬灭剂CAT 抑制,说明H2O2是烟草等植物细胞中PAL 活化所必需的信号分子,而PAL 活性是植物合成花青素等次生代谢产物的关键酶类;同样,研究证明H2O2是介导橘青霉细胞壁诱导子诱发红豆杉细胞中紫杉醇生物合成所必需的信号分子(徐茂军 等,2004;徐茂军和董菊芳,2006)。以上研究说明,NO 通过NOS 依赖途径诱导植物次生代谢的发生;而H2O2不仅作为NOS 的成员介导了NO 信号的传递,也通过PAL 活性启动调节花青素等次生代谢产物的合成。本试验中,NO 和H2O2均能促进马铃薯薯皮和薯肉花青素合成,H2O2对花青素合成具有较高的作用效果,且两者存在加性效应。一方面可能因为,H2O2对花青素合成有更为直接的促进作用,而NO 可能在NOS(H2O2)上游,通过NOS 反应间接调控了马铃薯花青素的合成,这种解释进一步证明了NO 通过NOS 依赖途径诱导植物次生代谢(徐茂军,2007)的说法的合理性;也可能因为,在花青素代谢调节中,NO 和H2O2作为两种独立的信号途径参与了其代谢调节,只是H2O2相对NO 具有更好的作用效果。
本试验是在大田栽培条件下,用外源SNP 和H2O2溶液处理马铃薯,在终花期测定马铃薯薯皮和薯肉花青素积累量及相关酶活性,阐述了NO 和H2O2对马铃薯花青素积累的诱导作用,但NO 和H2O2是通过何种方式诱导马铃薯花青素的合成及其信号传递还有待进一步深入研究。
侯夫云,王庆美,李爱贤,张海燕,董顺旭,解备涛.2009.植物花青素合成酶的研究进展.中国农学通报,25(21):188-190.
李师翁,薛林贵,冯虎元,徐世键,安黎哲.2007.植物中的H2O2信号及其功能.中国生物化学与分子生物学报,23(10):804-810.
廉玉姬,夏霖,林光哲.2009.紫色马铃薯Bora valley 花青素的提取与含量的测定.临沂师范学院学报,31(6):85-88.
田义,王强,张利义,康国栋,杨玲,郝红梅,杨振英,丛佩华.2009.外源腐胺促进苹果果皮花青苷积累的效应.植物学报,44(3):310-316.
徐茂军,董菊芳,朱睦元.2004.NO 参与真菌诱导子对红豆杉悬浮细胞中PAL 活化和紫杉醇生物合成的促进作用.科学通报,49(2):667-672.
徐茂军,董菊芳.2006.一氧化氮通过依赖和不依赖活性氧的信号途径介导橘青霉细胞壁诱导子促进红豆杉悬浮细胞中紫杉醇生物合成.科学通报,51(14):1675-1682.
徐茂军,董菊芳,朱睦元.2006.NO 可以通过水杨酸(SA)或者茉莉酸(JA)信号途径介导真菌诱导子对粉葛悬浮细胞中葛根素生物合成的促进作用.中国科学C 辑:生命科学,36(1):66-75.
徐茂军.2007.一氧化氮:植物细胞次生代谢信号转导网络可能的关键节点.自然科学进展,17(12):1622-1630.
徐茂军,董菊芳,张新波.2008.NO 和H2O2在介导热激诱发金丝桃细胞合成金丝桃素中的信号互作.中国科学C 辑:生命科学,38(7):643-653.
张和鸣,韩淑蕙.1959.氯乙醇对马铃薯的催芽效果.植物生理学通讯,(5):14-16.
Liu Y Q,Ma T R,Yang M,Liang H G,Li Z.2011.Effect of potato extract on its phenolic metabolism,SAGs accumulation and allelopathic autotoxicity research.Agricultural Science and Technology,12(5):647-650.
Lister C E,Lancaster J E.1996.Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars.J Sci Food Agric,71:313–320.
Ju Z G,Yuan Y B,Liu C L,Xin S H.1995.Relationship among phenylalanine ammonia-lyase activity,simple phenol concen-trations and anthocyanin accumulation in apple.Scientia Horticulturae,61:215-226.
Ma T R,Zhang J W,Liang H G,Liu Y Q.2012.Plant anthocyanin synthesis and gene regulation.Agricultural Science and Technology,13(3):507-511,540.
- 中国蔬菜的其它文章
- 《中国蔬菜》学术论文写作要求

