纳米ZnO粒子的溶胶凝胶制备及抗菌活性研究
胡亚微, 贺惠蓉, 张弘弛, 马养民, 顾 鑫
(1.陕西科技大学 教育部轻化工助剂化学与技术重点实验室,陕西 西安 710021; 2.太仓中化环保化工有限公司, 江苏 太仓 215433)
0 引言
近年来,随着人们对卫生环境的要求日益提高,抗菌材料受到了广泛的关注.抗菌材料是指本身具有杀灭或抑制微生物功能的一类新型功能材料,而抗菌材料可分为无机抗菌剂、有机抗菌剂两大类.常用的无机抗菌剂大部分是利用银、铜、锌等金属本身所具有抗菌能力的材料,通过物理吸附或离子交换等方法,将银、铜、锌等金属(或其离子)固定在沸石、硅胶等多孔材料的表面制成抗菌剂,然后将其加入到制品中获得具有抗菌性的材料[1-3].而TiO2、ZnO、ZnS等则属于另一类新型的无机抗菌剂——即光催化型无机抗菌剂,这一类半导体氧化物需要在光照条件下,吸光后产生大量的活性基团来抑制细菌的生长和繁殖.无机抗菌材料在纺织品、卫生洁具等方面均有很重要的应用,但是目前国内外文献报道的这一系列抗菌材料一般采用共沉淀法或浸渍法制备,且均需经过紫外光照才能发挥其抗菌性能,因而其应用也受到限制[4-6].为了突破这一材料应用的局限,提高这类无机材料的抗菌性能,本文采用溶胶凝胶法制备了ZnO纳米粒子,不需经过紫外光照即可显示优良的抗菌性能.
1 实验部分
1.1 试剂与仪器
(1)制备ZnO化学试剂为:Zn(NO3)2·6H2O(AR,天津市天力化学试剂有限公司);无水乙醇(AR,天津市河东区红岩试剂厂);聚乙烯吡咯烷酮(PVP,AR,天津市科密欧化学试剂厂).
(2)指示菌株及来源:革兰氏阳性菌:金色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis(Ehrenberg)Cohn);革兰氏阴性菌:大肠杆菌(Escherichiacoli)、绿脓杆菌(Pseudomonasaeruginosa).以上菌种由陕西科技大学生命学院微生物实验室提供.
(3)培养基:细菌指示菌培养基为牛肉膏蛋白胨培养基.主要成分为:蛋白胨l0g,牛肉膏5g,氯化钠5g,琼脂10 g,蒸馏水1000 mL,调pH值至7.2~7.4.灭菌条件为121 ℃、30 min.
(4)菌悬液使用试剂:磷酸盐缓冲液[PBS,0.03 mol·L-1,pH(7.2~7.4)]:磷酸氢二钠(Na2HPO4,无水)2.83 g,磷酸二氢钾(KH2PO4)1.85 g,非离子表面活性剂吐温-801.0g、蒸馏水1000 mL,调pH值至7.2~7.4.
(5)样品表征:ZnO粉末的物相组成和晶型结构采用日本Rigaku公司生产的D/Max-3c型X射线粉末衍射仪(XRD)(铜靶,电压40 kV,电流35 mA,扫描范围:30°~75°)进行表征;薄膜的表面形貌通过日本JOEL公司生产的JSM-6700F冷场发射扫描电子显微镜(SEM,加速电压15 kV,电流10μA)进行观察.
1.2 实验方法
1.2.1ZnO的制备
取0.1g PVP溶于8mL无水乙醇中,室温条件下采用磁力搅拌器搅拌1h,得到溶液a.称取2.98 g六水合硝酸锌(Zn(NO3)2·6H2O)溶于2mL去离子水中,待其完全溶解,缓慢加入到溶液a中,室温搅拌8~10 h,得到溶胶b.于120 ℃烘箱干燥后,放入马弗炉中以16 ℃·min-1的升温速度升至500 ℃,并保温2h,自然冷却后取出、研磨,得到ZnO粉体.
1.2.2抗菌实验
(1)菌悬液的制备.无菌条件,取冷冻保藏的各测试菌种各接种于营养琼脂斜面培养基上,于恒温培养箱中,在37 ℃下培养18~24 h后作为活化的供测试用的菌种.用灭菌的竹签将活化的菌种,加入已灭菌的 PBS缓冲液的锥形瓶中,振荡使细菌悬浮均匀,制成菌悬液,菌悬液浓度约为107 cfu·mL-1.
(2)供试样品的制备.取一定量ZnO粉体颗粒,在无菌条件下超声分散于无水乙醇中,将已灭菌滤纸片浸入到样品的悬浮液中,静置.无水乙醇完全挥发后,在滤纸片上自然沉积得到供抗菌试验的ZnO样品.
(3)抗菌性能测试.取配置好的菌悬液0.1mL,用灭菌涂布器反复在已凝固的平面培养基表面推移,使表面菌悬液均匀分布.用镊子轻取制备的ZnO样品,置于上述处理过的平面培养基上,在37 ℃恒温箱中培养18~24 h后,观察ZnO的抗菌效果,测量其抑菌圈的直径.为了保证实验的可重复性,每个样品在相同的条件下做3个平行实验.
2 结果与讨论
2.1 XRD分析

图1 ZnO粉末的XRD图
图1为所得ZnO粉末的XRD图谱.由图看出,所得ZnO粉末的XRD谱图中的峰位与六方晶系纤锌矿结构的ZnO(结构索引卡片No. 65-3411)相吻合,分别对应(100)、(002)、(101)、(102)、(110)、(103)、(200)、(112)、(201)晶面.谱图中没有任何杂质衍射峰出现,且衍射峰尖锐,说明所得产物为纯的纤锌矿ZnO结构.
2.2 SEM分析

图2 ZnO粉末的SEM图
图2为所得ZnO粉末放大30 000倍和5000倍的SEM照片.30 000倍的电镜观察发现,经过500 ℃热处理后的ZnO粉末颗粒大小基本均匀,粒径约为200 nm左右.而从低倍的电镜照片可以看出,ZnO纳米颗粒有明显的团聚现象,团聚颗粒大小约1~3μm.
2.3 抗菌活性分析
经溶胶凝胶法制备ZnO纳米粒子抗菌实验照片如图3,并将抗菌性能结果列于表1.从表中看出,ZnO纳米粒子具有很好的抗菌活性,且对革兰氏阴性菌和革兰氏阳性菌均有抗菌效果.据文献报道,这一类物质在没有掺杂或复合时对大肠杆菌和金黄色葡萄球菌基本上无抗菌活性[7].而紫外光照前后对大肠杆菌和金黄葡萄球菌的透明抑菌圈可达到13~17 mm[8].在本文中,通过对比紫外光照前后的ZnO纳米粒子的抗菌活性,看出样品在未经紫外光照射时的抗菌活性比文献值有所提高,对大肠杆菌的抑菌圈最大可达到21.5mm,且未经过紫外光照的样品的抗菌活性比紫外光照后样品有明显的增强,表明ZnO在可见光照下即可表现优良的抗菌活性,提高了ZnO作为抗菌材料的应用性.
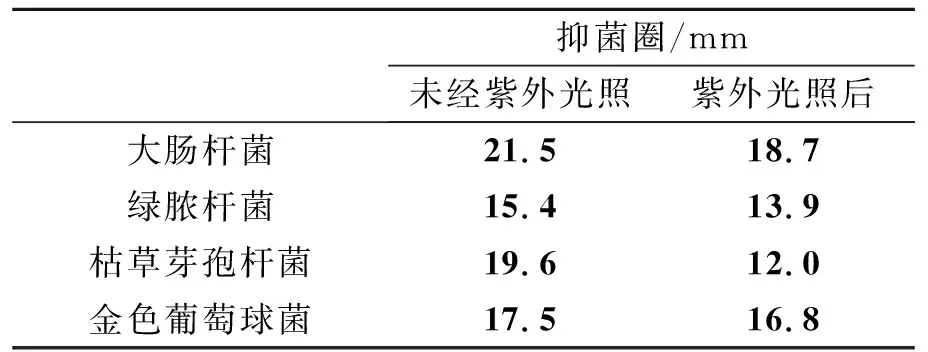
表1 ZnO纳米粒子抗菌性能结果
ZnO性质稳定,不同于溶出型无机抗菌剂通过离子随水扩散与微生物接触发生杀菌作用,但其在光照条件下产生的活性氧类物质已经被证实是一种抗菌物质[9-11].Sawai等人发现H2O2是ZnO产生抗菌性能的主要活性物质[12-14],且H2O2产量对抗菌性能有重要的影响.有文献报道,ZnO体系中H2O2的产生,主要是由于纳米结构的晶格失配合悬空键引起的表面化学吸附,经过多步骤的中间过渡亚稳态结构[15],释放出高活性物质(或基团).可能的产生机理如下[16]:
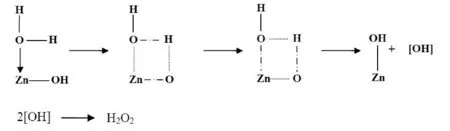
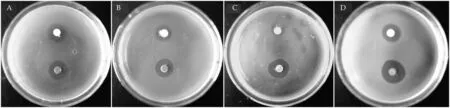
图3 紫外光照前后的ZnO样品对4种细菌的抗菌实验照片培养皿上方样品为经过紫外光照射3 h后的ZnO样品,下方为未经过紫外光照的样品(A:大肠杆菌 B:枯草芽孢杆菌 C:绿脓杆菌 D:金黄色葡萄球菌)
针对紫外光照前后抗菌活性的不同,可能是羟基自由基等活性物质在光照下加速产生,而活性物质之间往往存在相互转化或干扰,导致H2O2产量变化[16].
3 结论
采用溶胶凝胶法制备了ZnO纳米粒子,粒径约为200 nm,所制备的ZnO纳米粒子在抗菌性能测试中显示出特殊的抗菌性.传统方法制备的ZnO粉体颗粒需经过紫外光照才能发挥其抗菌性能,而本实验中采用溶胶凝胶法制备的ZnO纳米粒子,不需紫外光照射就具有较强的抗菌性能(未经过紫外光照的样品对大肠杆菌和枯草芽孢杆菌的抗菌圈均达到19 mm以上),提高了ZnO作为抗菌材料的应用范围.
[1] 周晓谦, 周文淮. 纳米二氧化钛的光催化特性及应用进展[J]. 辽宁化工, 2002, 31(10): 448-451.
[2] 陈仪本, 欧阳友生, 黄小茉. 工业杀菌剂[M]. 北京:化学工业出版社, 2001.
[3] Barringer E A, Bowen H K. Fornation, packing and sintering of monodisperse TiO2Powders[J]. J. Am. Ceram. Soc, 1982, 65(3): 199-201.
[4] 黄岳元, 米 钰, 郭人民, 等. TiO2/Ag抗菌材料[J]. 西北大学学报, 2003, 33(5): 566-568.
[5] 杨 毅, 邓国栋, 尹 强, 等. 纳米TiO2/SiO2复合食品抗菌材料[J]. 精细化工, 2001, 18(12):703-706.
[6] 季君晖, 史维明. 抗菌材料[M]. 北京:化学工业出版社, 2003.
[7] 李艳琼, 余 巍, 张俊敏, 等. Ag/TiO2纳米复合材料的结构及抗菌性能研究[J].贵金属, 2011,4(32), 24-28.
[8] 鞠剑峰, 李澄俊, 徐 铭. 纳米Ag/TiO2复合材料的抗菌性能[J]. 精细化工, 2005, 22(1), 59-61.
[9] 朱文君. ZnO抗菌性能及机理研究[D]. 成都:西南交通大学, 2010.
[10] 罗菊仙, 赵中一. 半导体多相光催化氧化技术在环境保护中的应用研究进展[J]. 中国地质大学学报, 2000, 25(5): 536-541.
[11] Sawai J.Quantitative evaluation of antibacterial activities of metallic oxide powders (ZnO, MgO and CaO) by conductimetric assay[J]. J. Microbiol. Methods , 2003, 54: 177-182.
[12] Sawai J, Igarashi H, Hashimoto A, et al. Evaluation of growth inhibitory effect of ceramics powder slurry on bacteria by conductance method[J]. J. Chem. Eng. Japan, 1995, 25: 288-293.
[13] Sawai J, Kawada E, Kanou F,et al. Detection of active oxygen generated from ceramic powders having antibacterial activity[J]. J. Chem. Eng. Japan, 1996, 29: 627-633.
[14] Sawai J, Kojima H, Igarashi H,et al. Escherichia coli damage by ceramic powder slurries[J]. J. Chem. Eng. Japan, 1997, 30:1034-1039.
[15] 黄开辉, 万惠霖. 催化原理[M]. 北京:科学出版社, 1983.
[16] 朱文君,徐晓玲,周祚万. 不同形貌ZnO悬浮液中H2O2的定量检测[J].功能材料, 2010, 11(41):1970-1973.

