纳豆芽孢杆菌增殖培养的研究
王莹莹王德培,2李可乐魏征刘鹏
(1.天津科技大学生物工程学院,天津300457;2.工业微生物教育部重点实验室,天津300457)
纳豆芽孢杆菌(Bacillus natto)是发酵日本传统食品纳豆的益生菌,属于枯草芽孢杆菌的一个亚种。纳豆芽孢杆菌能分解大分子物质,产生氨基酸、有机酸、寡聚糖等易于吸收的成分,这些成分具有多种保健功能,如抗菌、溶血栓、抗肿瘤、抗氧化、降血压、预防骨质疏松等;另外,纳豆芽孢菌能分泌各种酶和维生素,促进小肠黏膜细胞的增殖,保证肠道功能的正常[1]。因此,纳豆芽孢杆菌广泛用于各领域,对其微生态制剂的开发已成为国内外学者的研究热点。
本研究以实验室保存的一株自日本市售纳豆中分离的纳豆芽孢杆菌为对象,优化其液体发酵条件,为纳豆芽孢杆菌的广泛应用奠定基础。
1 材料与方法
1.1 试验材料
菌种为纳豆芽孢杆菌(Bacillus natto),由天津科技大学生化工程研究室保存。
种子培养基:蛋白胨10 g/l、牛肉膏5.0 g/l、NaCl 5.0 g/l、pH值7.2~7.4,固体培养基需加20 g/l的琼脂。
初始发酵培养基:葡萄糖5.0 g/l、蛋白胨5.0 g/l、柠檬酸钠1.0 g/l、MgSO4·7H2O 0.2 g/l、K2HPO44.0 g/l、KH2PO46.0 g/l,pH值7.0~7.2。
1.2 培养方法
种子培养:将纳豆芽孢杆菌由肉汤斜面接种至种子培养基中(三角瓶,50 ml/250 ml),37℃、200 r/min培养11 h;
发酵培养:发酵培养基成分和发酵条件根据试验进程相应改变。
1.3 测定方法[2]
1.3.1 测定吸光值
利用分光光度计,在波长为600 nm条件下测定菌液的吸光值(OD值),测定时菌液用无菌生理盐水稀释10倍。
1.3.2 生长曲线测定
取培养好的纳豆芽孢杆菌斜面,接种于含50 ml肉汤培养基的250 ml三角瓶中,振荡培养11 h后,按接种量2%转接25瓶50 ml/250 ml肉汤培养基,37℃、200 r/min培养,每1 h取样一次,测定菌液的吸光值,以未接种的培养基作为空白对照。
1.3.3 平板稀释菌落计数
菌液采用10倍梯度稀释,选取3个适当稀释度,用移液枪吸取100 μl菌液,把菌液分散地滴在肉汤平板上,轻轻转动平板,使菌液均匀分布。每个稀释度做3个平行。
1.4 培养基组成的优化
1.4.1 碳源优化试验
以初始发酵培养基为基础,分别以蔗糖、葡萄糖、玉米粉、麸皮、可溶性淀粉作为碳源,添加量为5.0 g/l。在各组发酵培养基中接入纳豆芽孢杆菌种子液,接种量2%,37℃、200 r/min培养11 h,各组分别活菌计数。
1.4.2 氮源优化试验
分别以酵母粉、牛肉膏、蛋白胨、硝酸铵、硝酸钠作为氮源,添加量均为5.0 g/l。在发酵培养基中接入纳豆芽孢杆菌种子液,接种量2%,37℃、200 r/min培养11 h,测定各组吸光值并活菌计数。
1.4.3 初始pH值优化试验
在上述培养基优化的基础上,分别调节发酵培养基初始pH值至6.0、6.5、7.0、7.5、8.0、8.5,接种量2%,37℃、200 r/min发酵培养11 h,测定各组吸光值并活菌计数。
1.4.4 响应面试验
在单因素试验的基础上,确定Box-Behnken设计的自变量及其取值范围,以10倍稀释的发酵液的OD值为响应值,运用Design Expert 7.0软件进行3因素3水平的响应面分析,对纳豆芽孢杆菌发酵培养基进行细致优化[3]。
1.5 培养条件的优化
采用最优培养基配方,对发酵过程中的接种量、装液量和发酵温度进行优化,测定各组吸光值。
1.5.1 接种量的优化
分别选取0.5%、1%、2%、3%、4%和5%6个接种量水平,37℃、200 r/min发酵培养11 h,测定各组吸光值并活菌计数。
1.5.2 装液量的优化
分别选取30、40、50、60、70 ml 5种装液量(250 ml三角瓶)水平,37℃、200 r/min发酵培养11 h,测定各组吸光值并活菌计数。
1.5.3 发酵温度的优化
发酵培养时分别置于30、37、40、42、45℃摇床中,200 r/min发酵培养11 h,测定各组吸光值并活菌计数。
2 结果与分析
2.1 纳豆芽孢杆菌的生长曲线(见图1)
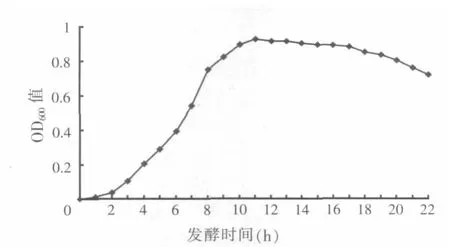
图1 纳豆芽孢杆菌生长曲线
连续测定纳豆芽孢杆菌发酵液的吸光值(5倍稀释),得到纳豆芽孢杆菌的生长曲线。由图1可知,0~3 h为纳豆芽孢杆菌生长延迟期,菌体数量极少;3~11 h为对数期,菌体数量急剧增多;在11 h时达到生长的高峰期,在11~16 h时,为纳豆芽孢杆菌生长的稳定期,菌体生长和死亡保持平衡状态;自16 h后细菌数量开始减少,进入衰亡期。
2.2 碳源优化试验结果
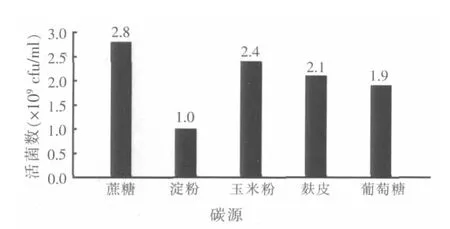
图2 不同碳源对纳豆芽孢杆菌增殖的影响
将菌株置于不同碳源的培养基中发酵培养,进行平板活菌计数,结果如图2。可以看出,蔗糖对纳豆芽孢杆菌增殖最有利,比最初选用的葡萄糖效果更好。以5.0 g/l的蔗糖做碳源,活菌数达到2.8×109cfu/ml,所以选择蔗糖作为最佳碳源。
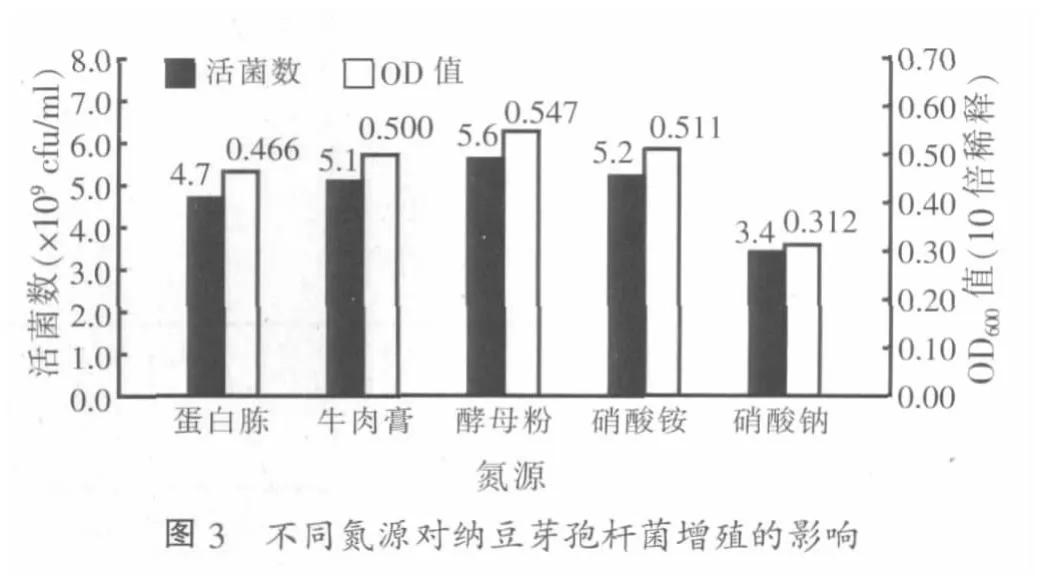
2.3 氮源优化试验结果
将菌株置于不同氮源的培养基中发酵培养,测定各组OD值,同时进行活菌平板计数,结果如图3。可以看出,酵母粉对纳豆芽孢杆菌增殖最有利,比最初选用的蛋白胨效果更好。以5.0 g/l的酵母粉做氮源,活菌数达到5.6×109cfu/ml,所以选择酵母粉作为最佳氮源。
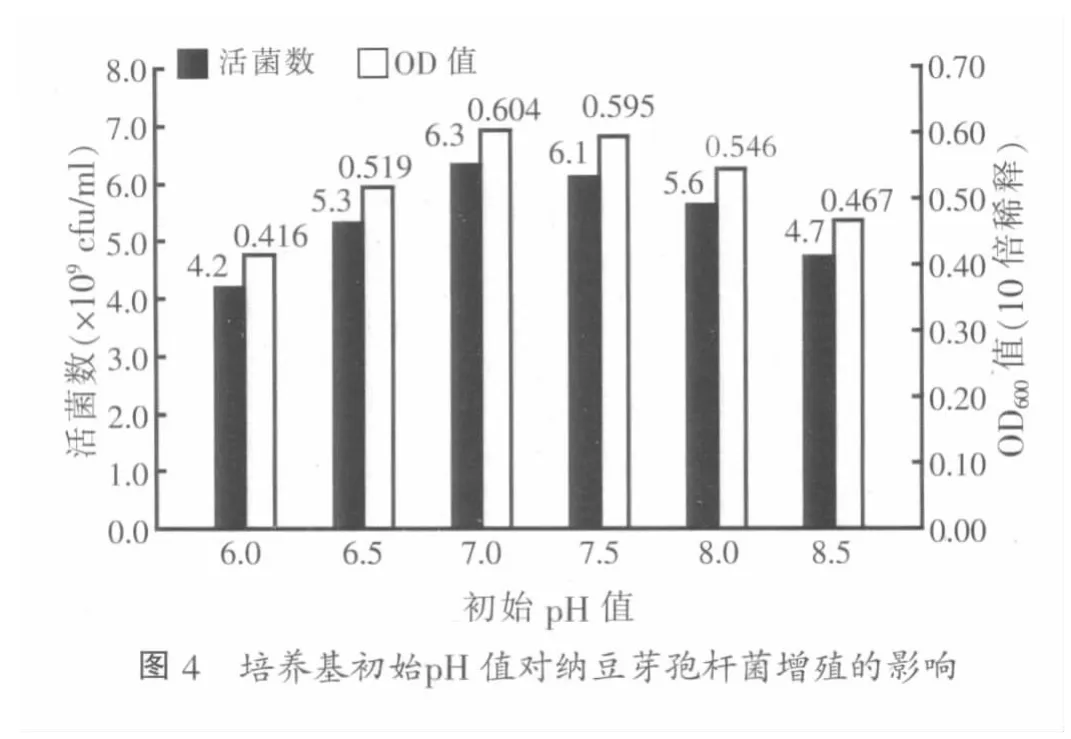
2.4 培养基初始pH值优化试验结果
在不同初始pH值中的培养基中,纳豆芽孢杆菌增殖情况如图4,发现活菌数随着初始pH值的升高先增加后降低,在初始pH值为7.0~7.5时,生长得较好。其中在初始pH值为7.0时,活菌数达到6.3×109cfu/ml。
2.5 Box-Behnken试验结果
以碳源(X1)、氮源(X2)和初始pH值(X3)为自变量,以10倍稀释的发酵液OD值为响应值(Y),进行响应面分析(因素水平见表1,每组2个重复)并建立纳豆芽孢杆菌增殖培养的回归模型[4],试验设计与响应值见表2。
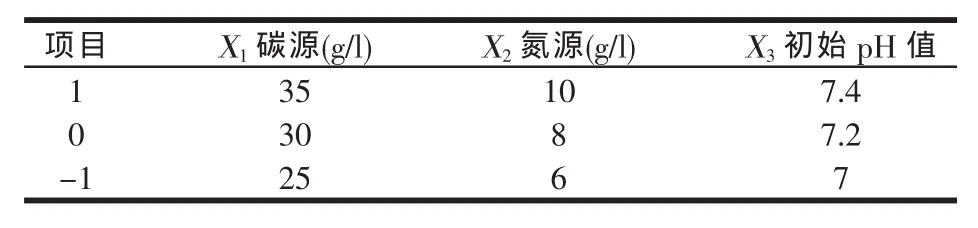
表1 Box-Behnken设计因素水平
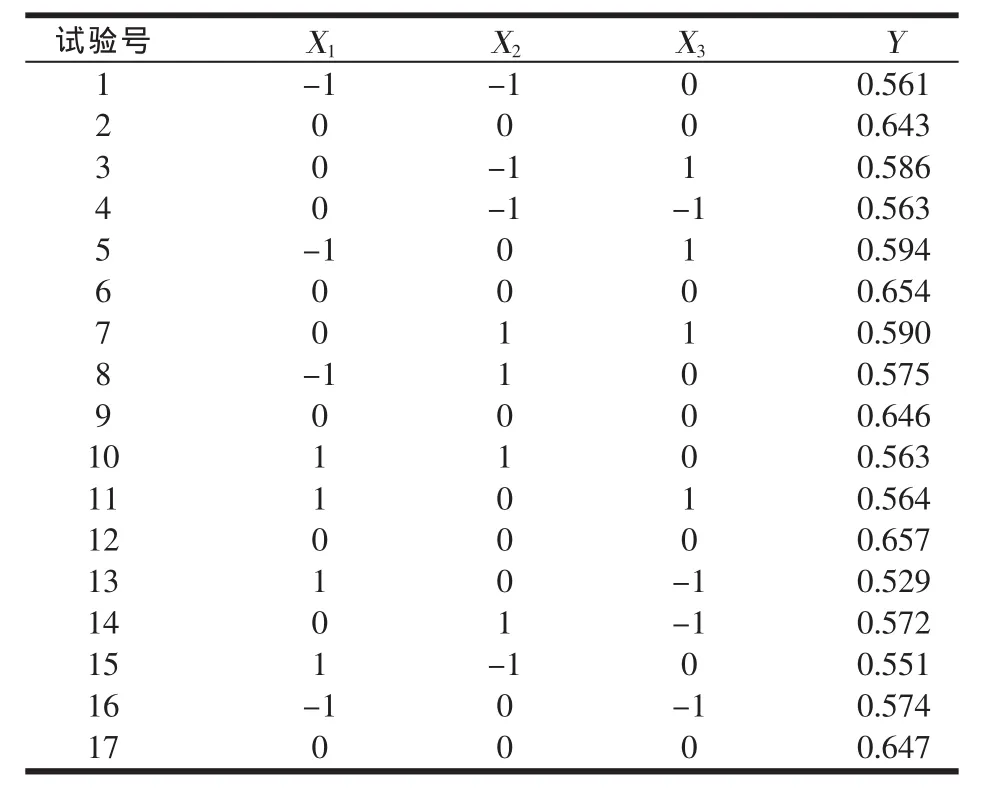
表2 Box-Behnken试验设计及响应值表
运用Design Expert 7.0软件对表2数据进行多元二次回归拟合,回归方程如下:
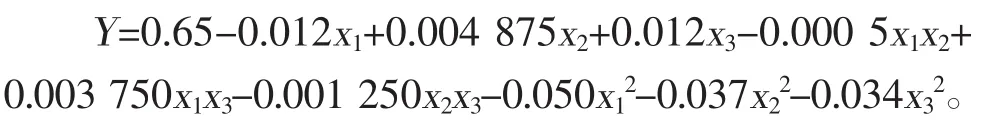
式中:Y——10倍稀释后发酵培养基OD值的预测值;
x1、x2、x3——分别代表碳源、氮源、初始pH值的编码值。
回归方程的方差分析和可信度分析结果见表3和表4。
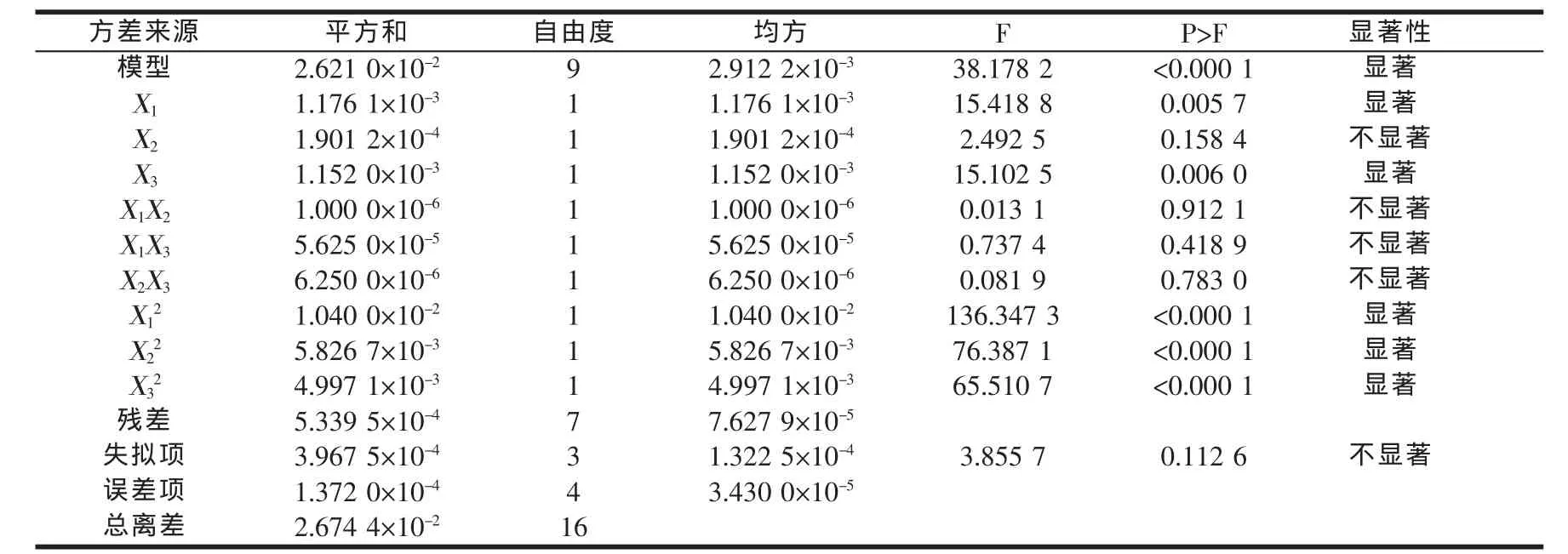
表3 Box-Behnken设计回归分析结果

表4 模型可信度分析
由表3可知,回归模型显著可靠(P<0.000 1);因子X1、X3、、为显著模型项;而失拟项不显著(P>0.05),提示本模型能充分反映实际情况[5]。
由表4可知,模型的决定系数(R-Squared)为0.980 0,说明预测值与实测值之间具有高度的相关性;校正决定系数(Adj R-Squared)为0.954 4,说明该模型能解释95.44%响应值的变化,仅有总变异的4.56%不能用此模型来解释。因此,回归方程的拟合程度很好,预测值和实测值之间具有高度的相关性[6]。模型的信噪比(Adeq Precision)为16.724 0,一般来说,模型的信噪比大于4就是较好的模型,进一步说明本模型设计非常成功,即回归方程给纳豆芽孢杆菌的增殖提供了一个较合适的模型。CV(Y的变异系数)表示试验的精确度,CV值越高,试验的可靠性越低,本设计试验中CV值为1.470 0%,数值较小,说明试验操作可信。
响应面中各因素交互作用的立体图及等高线图见图5,由图5可知,模型存在稳定点,稳定点是极大值点,通过岭脊分析[7],得到极大值所对应的各主要因素的编码值(x1、x2、x3)(-0.116、0.065、0.15)。由公式x1=(X1-30)/5,x2=(X2-8)/2,x3=(X3-7.2)/0.2,得到各主要因素(X1、X2、X3)的实际值为(29.42、8.13、7.23),即碳源添加量29.42 g/l、氮源添加量8.13 g/l、培养基初始pH值7.23。该模型预测的OD值为0.651。
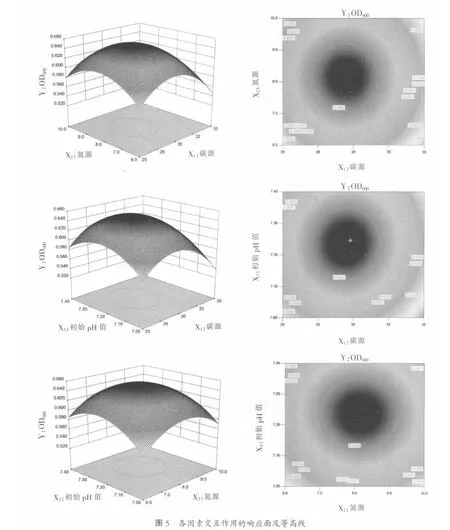
2.6 Box-Behnken回归模型验证试验结果
由于得到的最佳条件未包括在响应面优化的15个试验中,需进一步验证。因此,在优化后的发酵培养基配方下,即碳源添加量29.42 g/l,氮源添加量8.13 g/l,初始pH值为7.23,在37℃、200 r/min条件下发酵11 h,然后测定发酵液OD值和活菌计数。共重复了3次试验,每次试验都设有2组平行,测得发酵液10倍稀释后OD值为0.655(此值为平均值)(相应的活菌数为6.7×109cfu/ml),与试验预测值0.651非常接近,这表明试验值和实际值之间具有良好的拟合性,优化模型可靠。
2.7 接种量优化试验结果
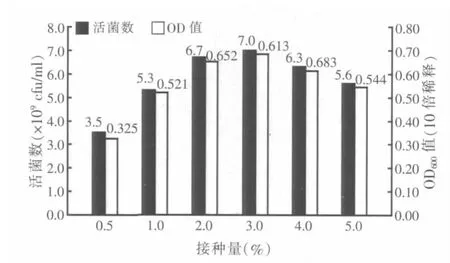
图6 接种量对纳豆芽孢杆菌增殖的影响
在不同接种量的培养基中,纳豆芽孢杆菌增殖情况如图6,发现活菌数随着接种量的升高先增加后降低,在接种量为3%时,纳豆芽孢杆菌数达到7.0×109cfu/ml。
2.8 装液量优化试验结果
在不同装液量的培养基中,纳豆芽孢杆菌增殖情况如图7,发现活菌数随着装液量的增加先升高后降低,在装液量为50 ml时,达到7.0×109cfu/ml。

2.9 培养温度优化试验结果(见图8)

根据试验结果可知,纳豆芽孢杆菌在30~45℃均可生长,但40℃时生长状况最好。选择40℃为最佳发酵温度,在此条件下,纳豆芽孢杆菌活菌数达到7.5×109cfu/ml。
3 结论
采用单因素及响应面试验法,通过测定发酵液吸光值和平皿活菌落计数,对纳豆芽孢杆菌的培养基和培养条件进行了优化,最终确定纳豆芽孢杆菌最佳增殖培养条件:培养基为蔗糖29.42 g/l、酵母粉8.13 g/l、柠檬酸钠1.0 g/l、MgSO4·7H2O 0.2 g/l、K2HPO44.0 g/l、KH2PO46.0 g/l、初始pH值7.23、装液量50 ml/250 ml、接种量3%、发酵温度为40℃、发酵时间11 h。经过一系列优化,纳豆芽孢杆菌的单位活菌数可达到7.5×109cfu/ml,为其在各方面的广泛应用打下良好基础。
[1] 牛丽亚,黄占旺.纳豆芽孢杆菌微生态制剂的研究进展[J].饲料博览,2008(6):24-26.
[2] 袁辉林,康丽华,王胜坤.红树林植物促生菌SZ7-1菌株的培养基优化[J].微生物学通报,2011,38(3):333-340.
[3] 李亚玲,赵玉洁,谢凤行,等.枯草芽孢杆菌H4培养条件的优化[J].天津农业科学,2009,15(4):20-23.
[4] 高梅莹,莫新迎,王宁,等.响应面法优化酒精酵母产海藻糖发酵培养基[J].中国酿造,2009(10):117-120.
[5] 黄金,黄磊,谢希贤,等.利用响应面法优化L-苏氨酸发酵条件[J].食品与发酵工业,2008,34(1):39-42.
[6] Ramkrishna S,T.S wamina than.Response surface modeling and optimization to elucidate and analyze the effects of inoculums age and size on surfactin production[J].Biochemical Engineering Journal,2004,21:141-148.
[7] 曹小红,蔡萍,李凡,等.利用响应面法优化Bacillus natto TK-1产脂肽发酵培养基[J].中国生物工程杂志,2007,27(4):59-65.

