Anti HER2 ScFv-GFP融合抗体靶向检测HER2的表达
高国辉,陈翀,杨艳梅,杨涵,王金丹,郑易,黄奇迪,胡孝渠
1 温州医学院生命科学院 浙江省医学遗传学重点实验室,浙江 温州 325035
2 温州医学院附属第一医院肿瘤外科,浙江 温州 325035
研究表明,30%左右的乳腺癌、胰腺癌等多种癌症病人的癌组织细胞表达人表皮生长因子受体-2即HER2[1-4]。尽管HER2在癌细胞中表达率不高,但阳性的病例大多出现预后差、发展快、易早期转移等特点。此外,HER2过表达的病例对多种化疗、放疗等表现出不敏感。因此,临床上通过检测癌组织中HER2的表达来预测癌病人的预后[5-8]。
目前,检测HER2表达状态的方法为3种:免疫组织化学法 (Immunohistochemistry,IHC)、荧光原位杂交法 (Fluorescence in situ hybridization,FISH) 和显色原位杂交法(Chromogenic in situ hybridization,CISH)。免疫组织化学法将组织经福尔马林固定、石蜡包埋及长时间储存后易导致细胞膜表面蛋白降解。此外,观察结果时观察者之间的差异常常导致检测结果产生误差[9]。而荧光原位杂交法和显色原位杂交法均操作繁琐、耗时,需要配置专业的仪器设备[10-11]。因此,探索一种直观、简便、特异性强且无误差的快速检测方法应用于临床分子实验诊断HER2阳性肿瘤细胞十分必要。
本研究为探索携带绿色荧光的抗HER2单链抗体在 HER2阳性肿瘤的临床诊断中的应用价值,把绿色荧光蛋白 (GFP) 基因与抗 HER2 ScFv基因拼接,利用pFast Bac HT A/sf9真核表达系统制备抗HER2 ScFv-GFP融合抗体,分离纯化含有绿色荧光的抗HER2单链抗体,利用该融合抗体靶向性检测两种已认定的乳腺癌HER2阳性细胞BT474、SKBR3,以HER2阴性的MCF7为对照,比较携带绿色荧光的抗HER2单链抗体在HER2阳性肿瘤细胞检测中的功能,同时,将其应用于临床病理组织靶向检测,探索携带绿色荧光的抗HER2单链抗体在临床分子诊断HER2阳性肿瘤细胞中的可能性。
1 材料与方法
1.1 材料
1.1.1 基因片段、菌种、载体与细胞株
杆状病毒-昆虫细胞表达系统 pFast Bac HT A/sf9由浙江大学张传溪教授提供,鼠源性人抗HER2-ScFv片段由中山大学医学院宋尔卫教授课题组提供,GFP片段由浙江大学生命科学院吴敏教授惠赠,DH10Bac、TG1等菌株由本实验室保存,pGEM T Easy Vector购于Promega公司,肿瘤细胞株BT474、SKBR3、MCF7购于上海生物化学与细胞生物学研究所。乳腺癌临床病理组织由温州医学院附属第一医院肿瘤外科提供。
1.1.2 工具酶及试剂盒
限制性内切酶EcoRⅠ、Hind Ⅲ、BamHⅠ、dNTPs、DNA Marker DL2000、中分子量蛋白Marker、DNA Marker 4500均为TaKaRa公司产品;T4 DNA连接酶、Taq DNA聚合酶、NC膜购于Promega公司;鼠抗GFP-Tag mAb、Goat Anti-Mouse IgG-HRP、DAB为Abmart公司产品;GFP标准品购于上海物竞化学试剂部;DNA胶回收试剂盒、质粒抽提试剂盒购于Omega公司。
1.1.3 细胞培养基、抗生素及其他试剂
氨苄青霉素 (Ampicillin) (100 g/L)、卡那霉素 (Kanamycin) (100 g/L)、四环素 (Tetracyclin) (40 g/L),庆大霉素 (Genlamycin) 35 g/L为国产试剂。DMEM高糖培养基、胎牛血清、RPMI 1640、胰酶培养液购自 GIBCO公司,昆虫细胞培养基NTM-FH insect medium为Sigma公司产品。
1.2 方法
1.2.1 引物的设计与合成
根据Anti HER2 ScFv片段序列和GFP序列设计引物如表1所示。
Anti HER2 ScFv-R引物中抗HER2-ScFv片段的终止密码子TAA被删除掉。
1.2.2 融合基因Anti HER2 ScFv-GFP的构建
将Anti HER2 ScFv的PCR产物进行EcoRⅠ/ BamHⅠ双酶切,GFP的PCR产物进行Hind Ⅲ/ BamHⅠ双酶切,将2条均具有BamHⅠ粘性末端的酶切产物分别进行回收、纯化,然后利用T4 DNA连接酶于16 ℃连接14 h左右,以连接产物为模板,以Anti HER2 ScFv-F为Anti HER2ScFv-GFP的上游引物,以 GFP-R为融合基因Anti HER2 ScFv-GFP的下游引物,PCR扩增,1%琼脂糖凝胶电泳鉴定。获得融合基因,将之克隆到pGEM T Easy载体,EcoRⅠ、Hind Ⅲ双酶切鉴定阳性质粒后测序确认阳性质粒中融合基因序列,Blast比对序列的正确性。

表1 本研究中PCR所用的引物Table 1 PCR primers used in this study
1.2.3 真核表达载体重组子 pFast Bac HT A/Anti HER2 ScFv-GFP的构建
用 EcoRⅠ、Hind Ⅲ分别双酶切 pGEM T Easy Vector/Anti HER2 ScFv-GFP、pFast Bac HT A,用 T4 DNA连接酶将 pFast Bac HT A与Anti HER2 ScFv-GFP在4 ℃连接过夜,连接产物转化 TG1感受态细胞,氨苄青霉素抗性筛选,双酶切鉴定重组子,并对重组子测序确认阅读框的正确性。
1.2.4 重组Bacmid的获得与鉴定
将鉴定好的阳性重组质粒 pFast Bac HT A/Anti HER2 ScFv-GFP转化DH10Bac感受态细胞,37 ℃培养8 h后,涂布含IPTG、X-gal、卡那霉素、庆大霉素及四环素的LB平板,筛选白色菌落,在含有上述3种同样抗生素的液体LB培养基中,37 ℃振荡培养过夜,碱裂解法获得重组病毒DNA,用M13通用引物进行PCR扩增,通过 PCR扩增法确定融合基因 Anti HER2 ScFv-GFP是否重组到Bacmid。
1.2.5 昆虫细胞sf9的培养、转染及重组病毒的感染
在35 mm细胞培养皿中接种1×106sf9细胞,加入2 mL有血清培养基,轻摇培养皿,使细胞分散均匀,27 ℃培养24 h。取两支1.5 mL离心管分别配制溶液A (约2 µg重组杆状病毒DNA溶于100 µL无血清培养基中) 和溶液 B (5 µL Lipoefectin稀释于80 µL无血清培养基中),合并溶液A和溶液B轻轻混匀,室温静置15 min。弃细胞培养液,并用无血清培养基洗 3次,加0.8 mL无血清培养基至Lipoefectin——DNA混合物中,轻轻混匀后,小心滴加到细胞表面,轻轻混匀。27℃培养8 h后,弃转染液,加有血清培养基2 mL继续培养。感染4 d后收集有明显病毒感染症状的细胞上清,再感染sf9细胞3轮进行病毒扩增。荧光显微镜下观察被感染的 sf9的变化。
1.2.6 表达产物的分离纯化与浓度测定
取30 mL含有表达产物的经过第3轮感染的sf9细胞培养液离心后收集细胞,用100 mmol/L Tris-HC1 (pH 8.0) 重悬,在昆虫细胞破碎前按照1∶1 000比例添加胰蛋白酶抑制剂 (Aprotinin)来防止蛋白酶的降解,冰浴中温和超声6次 (每次2 min,间隔10 s) 破碎,4 ℃、10 000×g离心5 min,收集上清,用Ni2+-NTA亲合层析柱室温结合1 h,用洗涤缓冲液 (100 mmol/L Tris-HC1,20 mmol/L咪唑,pH 8.0) 洗涤5次后,分别用含100、200、500 mmol/L的咪唑洗脱缓冲液洗脱,过0.45 µm滤膜除菌待用,考马斯亮蓝法测定收集的融合蛋白的浓度。
1.2.7 Western blotting分析融合抗体 Anti HER2 ScFv-GFP在昆虫细胞中的表达
纯化后的融合抗体样品经SDS-PAGE分析,利用 Bandscan软件计算纯化的目的蛋白纯度,然后电转移至NC膜,以5 g/L脱脂奶粉室温封闭1 h,依次加入鼠抗GFP-Tag mAb (1∶5 000稀释,4 ℃孵育过夜) 为一抗,HRP标记的山羊抗小鼠IgG (1∶5 000稀释,室温2 h) 为二抗用化学发光试剂盒于暗室条件下感光显影。分析蛋白质印迹结果。
1.2.8 Western blotting分析三种待测乳腺癌细胞株HER2表达状态
取待检测的乳腺癌细胞株SKBR3、BT474,MCF7细胞培养液各3 mL,离心后收集细胞,用100 mmol/L Tris-HC1 (pH 8.0) 重悬,冰浴中温和超声6次 (每次2 min,间隔10 s) 破碎,4 ℃、10 000×g离心5 min,收集上清,经SDS-PAGE分离后电转移至NC膜,以5 g/L脱脂奶粉室温封闭1 h,加入一抗鼠抗HER2mAb (1∶5 000稀释),4 ℃过夜,以HRP标记的山羊抗小鼠IgG (1∶5 000稀释,室温2 h) 为二抗用化学发光试剂盒于暗室条件下感光显影,分析蛋白质印迹结果。
1.2.9 融合抗体 Anti HER2 ScFv-GFP不同时间段检测三种乳腺癌细胞株
胰酶消化生长铺满的乳腺癌细胞 SKBR3、BT474和MCF7,重悬于无胎牛血清的RPMI1640培养液,1∶5稀释Anti HER2 ScFv-GFP融合蛋白样品,37 ℃、50 mL/L CO2培养箱中培养2 h,调整细胞密度为5×108个/L,以1 mL/孔加入6孔细胞培养板,每孔 1 mL,设复孔为阴性洗脱对照,Anti HER2 ScFv与乳腺癌细胞SKBR3、BT474和MCF7细胞表面受体充分结合2 h,添加胎牛血清100 mL/L,37 ℃、50 mL/L CO2培养箱中培养,分别经过12、24、48 h混合孵育后,1×PBS洗3~5次。共聚焦显微镜观察绿色荧光在SKBR3、BT474和 MCF7细胞表面受体分布情况,判断携带绿色荧光的抗HER2单链抗体对这两种阳性一种阴性的肿瘤细胞的鉴定能力及不同时间段的结合稳定性。根据检测结果,将所取得的原始抗体溶液倍比稀释后,分别与一定浓度的经过培养24 h HER2阳性肿瘤细胞SKBR3培养液混合孵育,能观察到绿色荧光的最大倍比稀释倍数就是该抗体的滴度。
1.2.10 融合抗体Anti HER2 ScFv-GFP检测病理组织结果与免疫组织化学法检测结果对比
取临床9例标本的石蜡切片放置在60 ℃恒温箱中烘烤2 h,然后置于二甲苯中浸泡10 min,更换二甲苯再次浸泡 10 min,无水乙醇中浸泡5 min,95%乙醇浸泡5 min,70%乙醇浸泡5 min,PBS洗2次,每次5 min,蒸馏水冲洗5 min。在微波炉里加热 0.01 mol/L柠檬酸盐缓冲液(pH 6.0),沸腾后放入石蜡切片,断电,间隔10 min,反复1~2次。蒸馏水洗5 min,PBS洗2次,各5 min,加3% H2O2孵育30 min (室温),PBS洗3次,各5 min,滴加正常山羊血清封闭液,室温20 min,甩去多余液体,根据细胞水平上Anti HER2 ScFv-GFP融合蛋白结合细胞的浓度滴加蛋白样品50 mL于切片上,置于4 ℃过夜,PBS洗3次,各5 min,封片,共聚焦显微镜观察绿色荧光分布情况,分析该融合抗体的工作滴度。用S-P 法免疫组化 (Immunohistochemistry,IHC) 检测HER2蛋白的表达。在光镜下观察时,需注意细胞膜完全着色的肿瘤细胞比例及着色强度,HER2蛋白表现为棕黄色颗粒,定位于细胞膜。根据HER2蛋白表达的强度进行评分,高倍显微镜下观察10个视野,没有染色或小于30 %的肿瘤细胞染色为阴性,大于30%的肿瘤细胞有不完整细胞膜着色为弱阳性 (+),大于30%的肿瘤细胞有较弱但完整的细胞膜着色为阳性(++),大于30%的肿瘤细胞较强完整细胞膜着色为强阳性 (+++)。
2 结果
2.1 融合基因Anti HER2 ScFv-GFP的构建
经PCR扩增获得Anti HER2 ScFv片段在800 bp左右,GFP为700 bp左右 (图1B),将两条同时具有BamHⅠ粘性末端的胶回收片段产物直接连接 (图1A),以连接产物为模板,PCR扩增获得1 500 bp左右的融合基因 (图1B)。融合基因克隆到 T载体后,测序表明整个融合基因为1 539 bp,Blast分析重组子中的融合基因序列与理论序列同源性为100%,表明融合基因构建成功。
2.2 真核表达载体 pFast Bac HT A/Anti HER2 ScFv-GFP的构建与重组Bacmid鉴定
双酶切重组子 pFast Bac HT A/Anti HER2 ScFv-GFP,在1 500 bp有明显条带 (图2A-1),单酶切结果与理论序列长度一致 (图 2A-2),经测序结果完全正确,以M13通用引物进行PCR鉴定阳性Bacmid,结果在3 800 bp左右有明显条带(图2B),与预期相符合,融合基因Anti HER2 ScFv-GFP完全重组到Bacmid上。
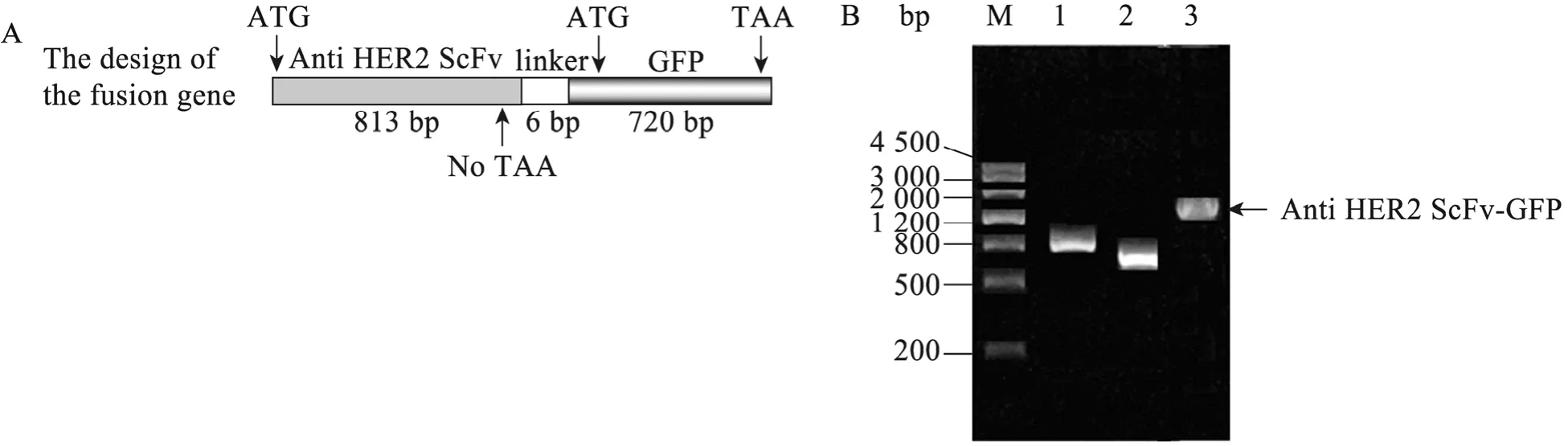
图1 融合基因Anti HER2 ScFv-GFP的构建Fig. 1 Construction of the fusion gene Anti HER2 ScFv-GFP. (A) Schematic diagram of the fusion gene Anti HER2 ScFv-GFP. (B) M: marker; 1: PCR product of Anti HER2 ScFv; 2: PCR product of GFP; 3: PCR product of fusion gene Anti HER2 ScFv-GFP.

图2 pFast Bac HT A/Anti HER2 ScFv-GFP的单、双酶切鉴定与重组Bacmid的PCR鉴定Fig. 2 The restriction enzyme analysis of the recombinant pFast Bac HT A/Anti HER2 ScFv-GFP and the PCR production of positive recombinant bacmid. (A) M: marker; 1: the double digestion product of pFast Bac HT A/Anti HER2 ScFv-GFP positive plasmid; 2: the single digestion product of pFast Bac HT A/Anti HER2 ScFv-GFP positive plasmid. (B) M: marker; 1: the PCR product of the recombinant bacmid containg fusion gene Anti HER2 ScFv-GFP.
2.3 融合基因Anti HER2 ScFv-GFP在sf9中的表达与Western blotting鉴定分析
用Lipoefectin介导转染粉纹夜蛾细胞sf9细胞。5 d后有少量绿色荧光显示 (图3A-b),预示融合基因在sf9细胞成功表达。分离获得血清中的重组病毒颗粒,连续3轮感染昆虫细胞sf9,通过荧光显微镜观察发现在细胞内荧光蛋白越来越多,均匀分布在靠近细胞膜附近(如图3A-c)。细胞破碎后离心的上清液经Ni2+-NTA亲合层析纯化后浓度测定为115.5 mg/L,纯化蛋白样品经 SDS-PAGE分离后结果表明是一条带,Bandscan软件计算纯化的目的蛋白纯度约97%,Western blotting结果表明有特异性条带在60 kDa左右,与预期相符合 (图3B)。
2.4 单克隆抗体Western blotting法检测三种乳腺癌细胞株HER2表达状态
三种乳腺癌细胞破碎物经过Western blotting分析,结果发现细胞株 SKBR3和 BT474在130~250 kDa之间有特异性条带,与报道的HER2蛋白分子量约185 kDa相符合 (图4),表明细胞株SKBR3和BT474为HER2阳性肿瘤细胞株,而 MCF7无特异性条带出现,表明该细胞株为HER2阴性。
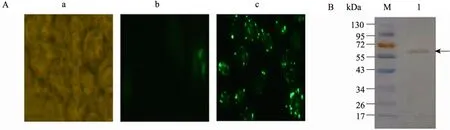
图3 融合基因Anti HER2 ScFv-GFP在sf9中的表达 (200×)Fig. 3 Expression and analysis of the fusion antibody Anti HER2 ScFv-GFP. (A) Expression of fusion protein Anti HER2 ScFv-GFP in insect cells sf9 (200×). A: negative control insect cells sf9 without transfected the recombinant bacmid; b: the result of sf9 cells transfected by the the recombinant bacmid; c: the result of sf9 cells infected by the the recombinant bacmid. (B) Western blotting analysis of the fusion protein Anti HER2 ScFv-GFP. M: marker; 1: the result of Western blotting.
2.5 融合抗体Anti HER2 ScFv-GFP检测3种乳腺癌细胞株HER2表达状态
激光共聚焦显微镜观察发现 12 h后已认定为HER2阳性的乳腺癌细胞BT474、SKBR3表面有明显的绿色荧光出现,并且不能被 PBS洗脱,而已认定为HER2阴性的乳腺癌细胞MCF7经过洗脱后细胞表面无绿色荧光存在 (图5A)。GFP标准品阴性对照表明 GFP本身并没有结合到细胞表面的能力 (图5B)。
融合抗体与 3种乳腺癌细胞混合孵育 24 h后,激光共聚焦显微镜观察发现已认定为HER2阳性的乳腺癌细胞 BT474、SKBR3表面仍然具有明显的绿色荧光出现,并且不能被PBS洗脱,而已认定为HER2阴性的乳腺癌细胞MCF7经过洗脱后细胞表面仍然无绿色荧光存在 (图6A)。 GFP标准品阴性对照表明 GFP本身并没有结合到细胞表面的能力 (图6B)。

图4 Western blotting检测3种乳腺癌细胞株HER2表达状态Fig. 4 Western blotting analysis of the Anti HER2 antibody for HER2 positive cancer cells.
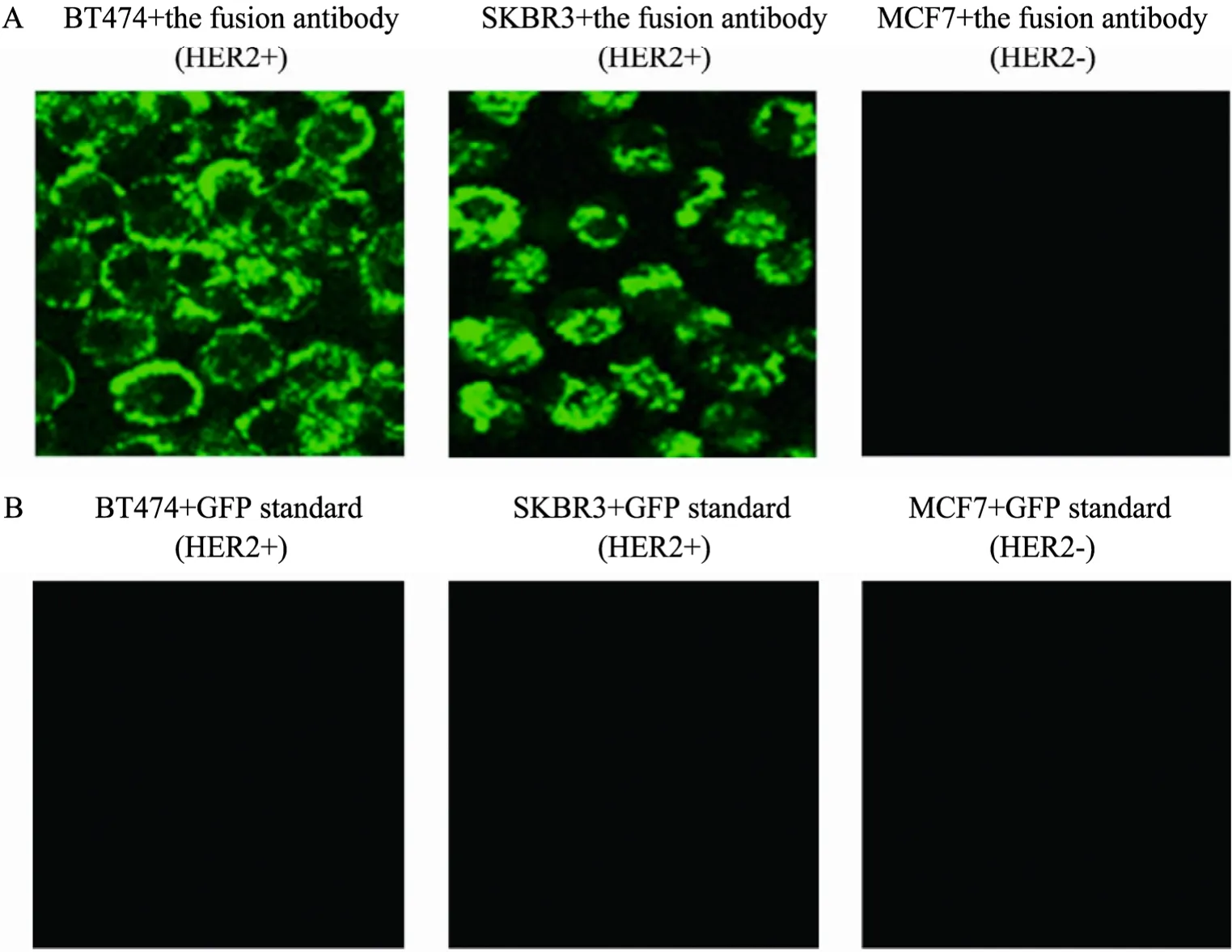
图5 融合抗体在12 h后HER2的检测结果 (200×)Fig. 5 Detection result of the fusion antibody testing HER2 after 12 h (200×).
融合抗体与 3种乳腺癌细胞混合孵育 48 h后,激光共聚焦显微镜观察发现已认定为HER2阳性的乳腺癌细胞 BT474、SKBR3表面具有较弱的绿色荧光出现,也不能被PBS洗脱,而已认定为HER2阴性的乳腺癌细胞MCF7经过洗脱后细胞表面无绿色荧光存在 (图7A)。GFP标准品阴性对照表明GFP本身并没有结合到细胞表面的能力 (图7B所示)。表明纯化后的蛋白溶液在37 ℃细胞培养箱存放48 h仍然具有靶向检测的能力。2倍稀释法测定该纯化的融合抗体滴度约为1∶64。
2.6 融合抗体Anti HER2 ScFv-GFP检测病理组织结果与免疫组织化学法检测结果对比
9例乳腺癌标本的同一组织分别用免疫组织化学法 (IHC) 和携带绿色荧光的融合抗体检测临床HER2的表达状态,结果发现在激光共聚焦显微镜下观察到IHC法检测为CerbB-2(-)阴性的病理组织 3例,用融合抗体观察不到绿色荧光(图8A、B),同理IHC法检测为CerbB-2 (++) 的病理组织3例,用融合抗体检测可以见到不是十分明显的绿色存在 (图8C、D),而CerbB-2 (+++)的病理组织3例,用融合抗体检测到明显的绿色荧光存在 (图8E、F),与预计结果相符合。
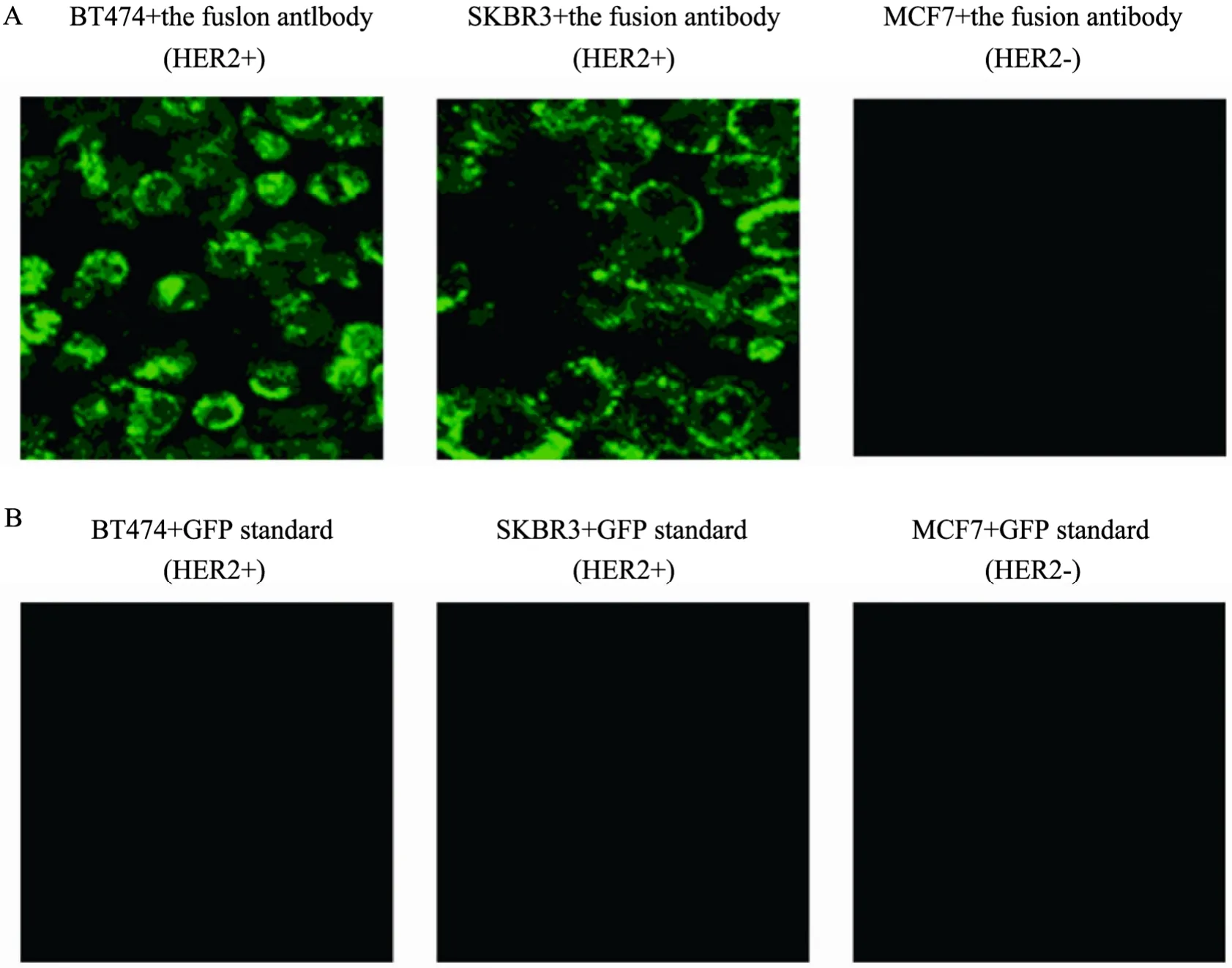
图6 融合抗体在24 h后HER2的检测结果 (200×)Fig. 6 Detection result of the fusion antibody testing HER2 after 24 h (200×).
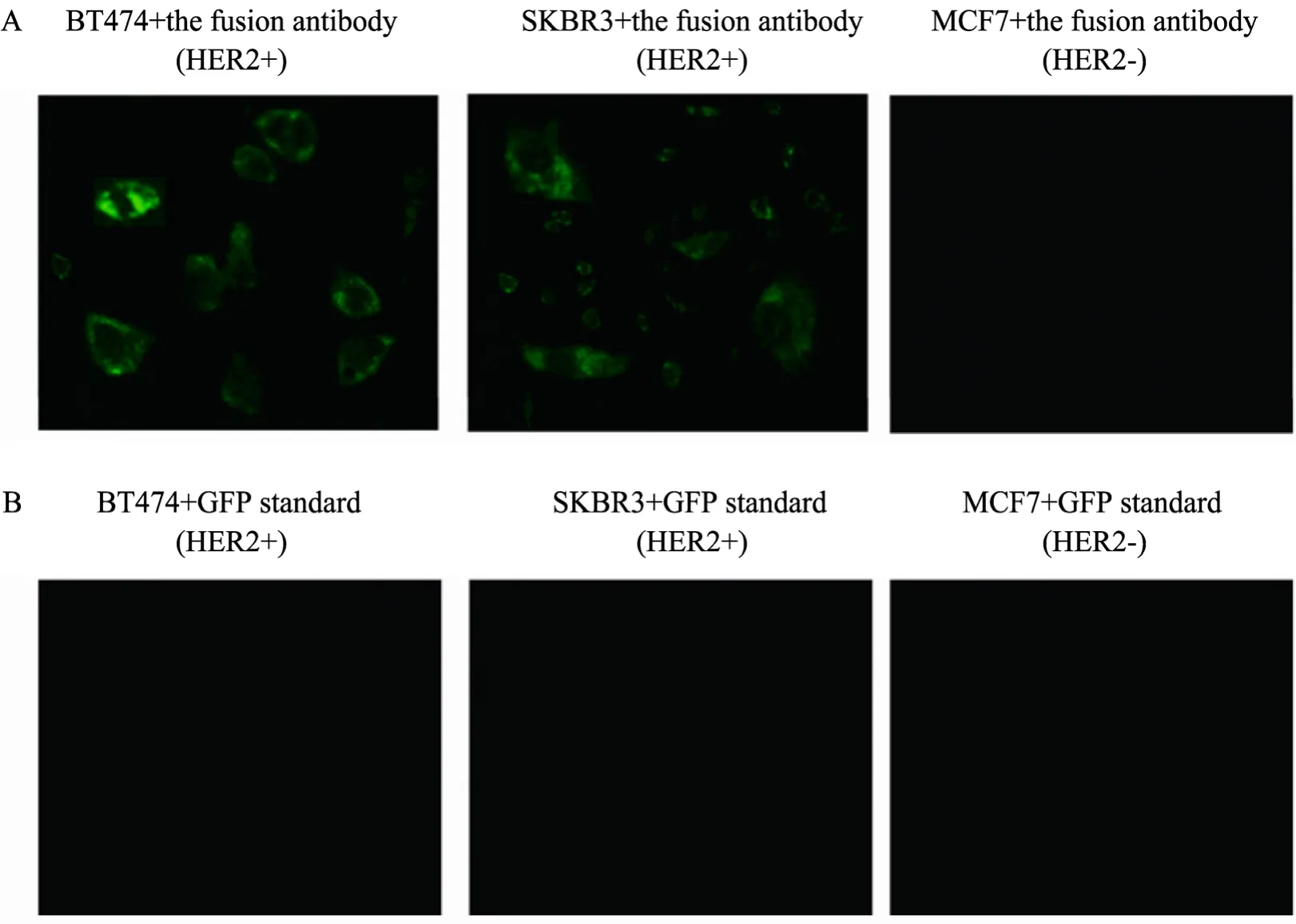
图7 融合抗体在48 h后HER2的检测结果 (200×)Fig. 7 Detection result of the fusion antibody testing HER2 after 48 h (200×).
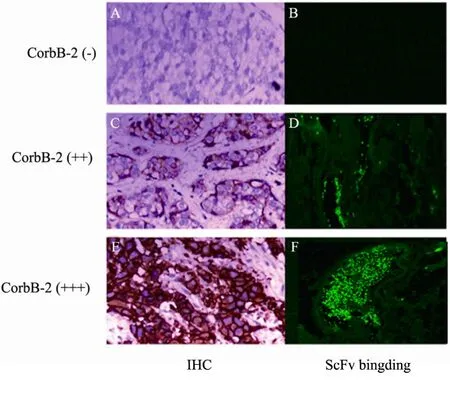
图8 免疫组织化学法检测病理组织结果对比融合抗体Anti HER2 ScFv-GFP检测病理组织结果 (100×)Fig. 8 Comparison of detection HER-2 in the same tumor samples using IHC and ScFv binding technique (100×).
3 讨论
临床上一般先通过检测HER2是否为阳性来判断是否给病人施用单克隆抗体药物[12-14]。因此,创建一种精确度高、误差小且方便的检测HER2的方法对临床治疗措施的确定具有借鉴意义。
目前,HER2检测主要是分析人17号染色体上的癌基因HER2的扩增水平或者肿瘤细胞表面HER2蛋白胞外区的分布量。免疫组化法 (IHC)通过一抗结合HER2蛋白胞外区后二抗结合一抗并激活底物反应显色来观察细胞膜被染色的比例。临床上将HER2蛋白的表达强度进行分级为0、1+、2+、3+,其中2+和3+表示为阳性结果。但是,HER22+和3+的结果中用FISH技术检测发现无HER2基因扩增的现象经常出现[15-16]。研究表明,标本的制备、正常组织上皮着色、细胞质着色、染色记数误差等因素导致 20%左右的IHC检测结果不可靠[17-18]。FISH技术是通过荧光标记的DNA探针与阳性细胞细胞核内的DNA靶序列杂交,在荧光显微镜下观察细胞核内杂交于DNA靶序列的多种彩色信号,以获得多种基因的状态信息。FISH技术中的DNA探针一般将HER2基因和 17号染色体着丝粒序列包括在内构建混合探针,提高精确度。荧光原位杂交法(FISH) 比免疫组化法 (IHC) 明显精确度高[19]。但是,DNA探针的选择、PCR扩增过程的重复性、G2期细胞内的基因拷贝数目特征可能导致的计数误差也会导致结果精确度下降。CISH技术使用地高辛标记的探针在甲醛固定、石蜡包埋组织的切片上进行杂交,然后用鼠抗地高辛抗体和辣根过氧化物酶-抗鼠抗体进行免疫结合、DAB显色,观察杂交结果。但是,也存在着加热时间、消化时间难以控制而造成误差的可能。
抗HER2的单链抗体具有特异性靶向结合肿瘤细胞表面HER2受体的特点,绿色荧光蛋白可作为报告基因来研究基因的表达、细胞分化及蛋白质在生物体内定位和转运等。
本研究在前期工作基础上,利用杆状病毒-昆虫细胞真核表达系统pFast Bac HT A/sf9表达获得携带绿色荧光的抗HER2单链抗体,将该融合抗体应用于已被认定的 HER2阳性肿瘤细胞BT474和SKBR3,12 h和24 h后的检测结果表明同一浓度的不同时间观察,均能看到 BT474和SKBR3表面有强烈的绿色荧光出现,与已认定的结果相符合。而48 h后细胞表面绿色荧光变暗,推测为绿色荧光蛋白的自身弱化原因。张瑰红等[20]在对比CISH和IHC对HER2检测效果的研究中发现两种方法检测的结果符合率只有81.2%,而本研究中,两种HER2阳性肿瘤细胞均能被检出,HER2阴性结果不能被检出,符合率达 100%。国外关于乳腺癌的研究统计 CISH和FISH的结果符合率在90%以上,但是仍然有误差存在[21-24],3种方法产生误差的一个共同影响因素为染色。而利用携带绿色荧光的抗HER2单链抗体靶向结合 HER2阳性的细胞表面检测HER2的表达状态,可避免这个环节的出现从而提高检测的精确度。
此外,检测结果在12 h或24 h左右即可获得,使用普通荧光显微镜或者激光共聚焦显微镜即可观测到检测结果,不需要特殊图象软件或者多种抗体参与检测过程,而其他3种方法均有特殊的要求[25]。
在临床实验中,本研究用几例临床病理组织标本对比检测结果,HER2的存在以及表达量与绿色荧光的分布及强弱有一定的相关性,但是将携带绿色荧光的融合抗体大量应用到临床标本是否具有此规律仍然未知,该融合抗体的结合特异性和亲和能力也需要验证。
本实验采用的肿瘤细胞 BT474、SKBR3和MCF7均为已认定HER2表达状态,且为成熟细胞株,但是临床上各种 HER2表达状态的细胞类型还有很多,临床价值的探索还要进一步深入研究。
REFERENCES
[1] Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science, 1987, 235(4785): 177−182.
[2] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61(2): 69−90.
[3] Parkin DM, Nambooze S, Wabwire-Mangen F, et al. Changing cancer incidence in Kampala, Uganda, 1991-2006. Int J Cancer, 2010, 126(5): 1187−1195.
[4] Parkin DM, Whelan S, Ferlay J, et al. Cancer Incidence in Five Continents.Vol I to VIII. Cancer Base No. 7. Lyon: IARC Press, 2005.
[5] Munro AF, Cameron DA, Bartlett JMS. Targeting anthracyclines in early breast cancer: new candidate predictive biomarkers emerge. Oncogene, 2010, 29(38): 5231−5240.
[6] Wang JZ, Buchholz TA, Middleton LP et al. Assessment of histologic features and expression of biomarkers in predicting pathologic response to anthracycline-based neoadjuvant chemotherapy in patients with breast carcinoma. Cancer, 2002, 94(12): 3107−3114.
[7] Baselga J, Seidman AD, Rosen PP, et al. HER2 overexpression and paclitaxel sensitivity in breast cancer: therapeutic implications. Oncology (Williston Park), 1997, 11(3 Suppl2): 43−48.
[8] Ross JS, Fletcher JA.The HER-2/neu oncogene in breast cancer: prognostic factor, predictive factor, and target for therapy. Stem Cells, 1998, 16(6): 413−428.
[9] Jacobs TW, Gown AM, Yaziji H, et al. HER-2/neu protein expression in breast cancer evaluated by immunohistochemistry: a study of interlaboratory agreement. Am J Clin Pathol, 2000, 113(2): 251−258.
[10] Vinatzer U, Dampier B, Streubel B, et al. Expression of HER2 and the eoamplified genes GRB7 and M LN64 in human breast cancer: quantitative real-time reverse transcription PCR as a diagnostic alternative to immunohistochemistry and fluorescence in situ hybridization. Clin Chem, 2005, 11(23): 8348−8357.
[11] Gutierrez C, Schiff R. HER2: biology, detection, and clinical implications. Arch Pathol Lab Med, 2011, 135(1): 55−62.
[12] Masood S, Bui MM. Prognostic and predictive value of HER2/neu oncogene in breast cancer. Microsc Res Tech, 2002, 59(2): 102–108.
[13] Amodio R, Zarcone M, Cusimano R, et al. Target therapy in HER2-overexpressing breast cancer patients. OMICS, 2011, 15(6): 363−367.
[14] Stackievicz R, Paran H, Bernheim J, et al. Prognostic significance of HER-2/neu expression in patients with ductal carcinoma in situ. Isr Med Assoc J, 2010, 12(5): 290−295.
[15] Shak S. Overview of the trastuzumab (Herceptin) Anti-HER2 monoclonal Antibody clinical program in HER2-overexpressing metastatic breast cancer. Herceptin multinational investigator study group. Semin Oncol, 1999, 26(4 Suppl 12): 71−77.
[16] Hammock L, Lewis M, Phillips C, et al. Strong HER-2/neu protein overexpression by immunohistochemistry often does not predict oncogene amplification by fluorescence in situ hybridization. Hum Pathol, 2003, 34(10): 1043−1047.
[17] Hammond MEH, Hayes DF, Dowsett M, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for Immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Arch Pathol Lab Med, 2010, 134: 907–922.
[18] Lloyd MC, Allam-Nandyala P, Purohit CN, et al. Using image analysis as a tool for assessment of prognostic and predictive biomarkers for breast cancer: how reliable is it? J Pathol Inform, 2010, 23(1): 29.
[19] Ashok M, Griffin P, Halpern M. Impact of clinical and non-clinical factors on the choice of HER2 test for breast cancer. Cancer Invest, 2010, 28(7): 735−742.
[20] Zhang GH, Shi DR, Liang XM, et al. Comparision of HER2/neu oncogene detected by chromogenic in-situ hybridization and immunohistochemistry in breast cancer. Chin J Pathol, 2006, 35(10): 580−583.张瑰红, 施达仁, 梁晓曼, 等. 显色原位杂交和免疫组织化学检测乳腺癌HER2/neu基因状况和蛋白表达的对照性研究. 中华病理学杂志, 2006, 35(10): 580−583.
[21] Isola J, Tanner M, Forsyth A, et al. Interlaboratory comparison of HER-2 oncogene amplification as detected by chromogenic and fluorescence in situ hybridization. Clin Cancer Res, 2004, 10(14): 4793−4798.
[22] Arnould L, Denoux Y, MacGrogan G, et al. Agreement between chromogenic in situ hybridisation (CISH) and FISH in the determination of HER2 status in breast cancer. Br J Cancer, 2003, 88(10): 1587−1591.
[23] Lambros MB, Natrajan R, Reis-Filho JS. Chromogenic and fluorescent in situ hybridization in breast cancer. Hum Pathol, 2007, 38(8): 1105-1122.
[24] Dandachi N, Dietze O, Hauser-Kronberger C. Chromogenic in situ hybridization: a novel approach to a practical and sensitive method for the detection of HER2 oncogene in archival human breast carcinoma. Lab Invest, 2002, 82(8): 1007-1014.
[25] Zeng X, Zhao DC, Zhou WX, et al. Evaluation of HER2 gene expression status in breast cancer by fluorescence in-situ hybridization. Chin J Pathol, 2005, 34(11): 701−705.曾瑄, 赵大春, 周炜洵, 等. 荧光原位杂交检测乳腺癌HER2基因状态. 中华病理学杂志, 2005, 34(11): 701−705.