磺酸基功能化磁性纳米粒子的制备、表征及除去水中Cu(Ⅱ)的研究
王朝辉,杨 芳
(1.甘肃华明电力股份有限公司,甘肃 平凉744000;2.中石油 兰州化工研究中心,甘肃 兰州730060)
众所周知,有毒重金属污染的水已经在全球被发现。将含有重金属离子的废水直接排放到环境中,水生物以及农作物会累积富集这些重金属离子,并通过饮水和食物链等方式对人类健康产生严重的危害。铜是人体所必须的有益元素,它本身毒性比较小,然而当人体摄入过量的铜后就会刺激消化系统,造成腹痛呕吐,长期过量接触便会引起肝硬化[1]。因此,怎样有效除去水体中重金属铜离子已成为目前亟待解决的重要问题。近年来,人们开发了很多种技术用于去除重金属离子,其中包括化学沉淀法、电沉积法、溶剂萃取法、离子交换法以及吸附法。在这些方法中,吸附法越来越受到人们的关注因为它操作起来简单、费用较低而且可以把污水中的重金属离子有效地除去。磁性纳米吸附剂与传统的吸附剂相比较,它们通过外界磁场可以快速地回收磁性纳米粒子以及去除重金属离子。同时,它还具有较大的比表面积以及不存在内扩散阻力现象。因此,它被认为是一种很有潜力的重金属离子吸附剂[1,2]。在实际应用中,由于磁性纳米粒子自身对重金属的吸附效果不够理想,因此,往往需要对其表面进行适当的修饰以便提高其对重金属离子的吸附能力。
本研究采用化学共沉淀法合成疏水性Fe3O4纳米粒子,然后在反相微乳体系中制备出分散性良好、粒径均匀的Fe3O4@SiO2复合磁性纳米粒子。由于Fe3O4@SiO2表面具有大量的羟基,因此,我们在甲苯回流的条件下把2-(4-氯磺酰苯基)乙基三甲氧基硅烷通过共价键的方式接枝到Fe3O4@SiO2纳米粒子表面,该纳米粒子经过1.0MNaCl溶液处理便制备出具有核壳结构的Fe3O4@SiO2-SO3Na磁性纳米吸附剂,吸附剂的制备过程如示意图1。我们将制备的Fe3O4@SiO2-SO3Na磁性纳米吸附剂应用于去除水溶液中的Cu(Ⅱ),结果发现该吸附剂对水溶液中的Cu(Ⅱ)具有很好的吸附效果。从该研究中我们发现:溶液的pH值能显著影响吸附剂对Cu(Ⅱ)离子的吸附效果,其中pH值为5.1时吸附效果最佳,即 Cu(Ⅱ)从初始的 20mg·L-1降低至 0.45mg·L-1意味着97.8%的Cu(Ⅱ)从溶液中除去。更重要的是,通过0.1MHCl洗涤,该吸附剂可以循环使用。这说明Fe3O4@SiO2-SO3Na磁性纳米吸附剂对 Cu(Ⅱ)具有很好的吸附效果,是去除水溶液中Cu(Ⅱ)的优良磁性吸附材料。
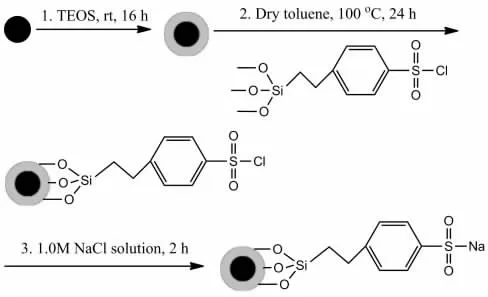
图1 Fe3O4@SiO2-SO3Na磁性纳米吸附剂的合成示意图Fig.1 A scheme for the synthesis of Fe3O4@SiO2-SO3Na magnetic nano-adsorbent
1 实验部分
1.1 原材料
FeCl2·4H2O、FeCl3·6H2O、CuCl2·2H2O、油酸、曲拉通X-100(A.R.天津市光复精细化工研究所);2-(4-氯磺酰苯基)乙基三甲氧基硅烷(50%的CH2Cl2溶液百灵威科技有限公司);本实验所用的水均为高纯水。
1.2 Fe3O4@SiO2-SO3Na复合磁性纳米吸附剂的制备
1.2.1 油酸包裹的Fe3O4纳米粒子的制备 本实验所使用的油酸包裹的Fe3O4纳米粒子通过Fe2+、Fe3+、油酸以及28%的NH3·H2O存在下以共沉淀的方式制备。具体的实验步骤为:4.8gFeCl3·6H2O、2.0g Fe-Cl2·4H2O、1.0mL油酸以及30mL去离子水加入到100mL两口瓶中,然后用N2纯化上述混合溶液15 min以便除去上述混合液体中的空气,紧接着将其加热至90℃并在此温度下剧烈搅拌,15min以后,把10mL 28%的NH3·H2O迅速加入到混合溶液中,烧瓶中溶液的颜色由黄色很快变为黑色。再让其在90℃下恒温搅拌2.5h,随后自然冷却到室温便得到需要的油酸包裹的Fe3O4纳米粒子。通过磁倾析的方法可以将油酸包裹的Fe3O4纳米粒子从反应液中分离出来,最后将其分散在100mL的环己烷中,用于下一步反应。
1.2.2 Fe3O4@SiO2复合纳米粒子的合成 Fe3O4@SiO2复合纳米粒子通过Rossi[3]小组的反相微乳液法制备,我们在此基础上也做了部分的改进工作。首先,在超声的条件下把200mg疏水性的Fe3O4纳米粒子分散在500mL的环己烷中,其次,45.0g的曲拉通Triton-X100在搅拌条件下加入到上述溶液中,形成反相微乳液。15min后10mL 28%NH3·H2O加入到上述混合液并继续机械搅拌15min后6.0mL TEOS慢慢滴加到微乳液中,室温搅拌16h后,然后用甲醇将形成的Fe3O4@SiO2纳米粒子沉淀出来。最后用乙醇和水分别洗涤5次,以便除去黏附的表面活性剂,将得到的产物在80℃下真空干燥24h。
1.2.3 Fe3O4@SiO2复合纳米粒子的合成 在超声的条件下将500mg Fe3O4@SiO2纳米粒子分散在200mL的无水甲苯中,随后10mL 2-(4-氯磺酰苯基)乙基三甲氧基硅烷的无水甲苯溶液慢慢滴加到上述溶液中,该混合溶液在无水甲苯中回流搅拌24h并自然冷却至室温。将制备的磁性纳米粒子分别用甲苯,无水乙醇洗涤数次再将其与1.0 MNaCl溶液搅拌反应2h即可得到Fe3O4@SiO2-SO3Na磁性纳米粒子。
1.2.4 Fe3O4@SiO2-SO3Na纳米粒子的吸附性能研究 称取15mg Fe3O4@SiO2-SO3Na磁性纳米粒子于25mL的反应瓶中,加入15mL 20mg·L-1的Cu(Ⅱ)水溶液于反应瓶中,在不同的吸附剂、pH值下室温搅拌反应一段时间,随后通过磁倾析把反应溶液分离出来并通过原子吸收光谱法分析反应之后Cu(Ⅱ)的含量。在循环实验中,我们将每次使用过的Fe3O4@SiO2-SO3Na复合纳米粒子通过外接磁铁可以很容易从反应液中分离出来,然后分别用去离子水、乙醇洗涤数次,最后在45℃下真空干燥用于下一次循环使用。
1.3 样品的测试
采用G2 F30高分辨透射电子显微镜观测样品的粒径大小、形貌特征以及分散情况。样品的具体制备方法为:用一次性滴管分别吸取适量的分散在乙醇中的Fe3O4@SiO2纳米粒子和Fe3O4@SiO2-SO3Na复合纳米粒子,慢慢滴加在铜网上面并用红外灯烘烤至乙醇蒸发完毕,然后把铜网放在仪器中进行测试;X射线粉末衍射在Rigaku D/max-2400衍射仪上测试,CuKα射线作为X-射线源,扫描角度从10°~80°;采用 KBr压片制样,用 Nicolet Nexus 670傅里叶变换红外光谱仪测定Fe3O4@SiO2-SO3Na复合纳米吸附剂以及Fe3O4@SiO2纳米粒子的特征官能团,用以观察Fe3O4@SiO2纳米粒子功能化前后的变化情况。采用振动样品磁强计测定样品的磁性能,操作条件是在室温下进行并且扫描范围为-15~15Koe,样品制备方法为:称取 20mg的 Fe3O4和Fe3O4@SiO2-SO3Na纳米粒子,加入到胶囊中并置于试样槽中进行测试。
2 结果与讨论
2.1 磁性纳米粒子的透射电镜表征
图1(a)、(b)分别为 Fe3O4@SiO2和 Fe3O4@SiO2-SO3Na纳米粒子的透射电镜图。

图1 (a)Fe3O4@SiO2和(b)Fe3O4@SiO2-SO3Na纳米粒子的透射电镜图Fig.1 TEM images of(a)Fe3O4@SiO2and(b)Fe3O4@SiO2-SO3Na nanoparticles
从图1中可以看出,Fe3O4@SiO2纳米粒子中的Fe3O4均已被SiO2所包裹,复合粒子绝大部分呈球形而且粒径分布较均匀,平均直径约45nm左右,只是Fe3O4@SiO2纳米粒子有些轻微的团聚;我们最终制备的Fe3O4@SiO2-SO3Na纳米粒子与Fe3O4@SiO2相比较,形貌上没有发生明显的变化,证明该吸附剂材料保留了起初的结构。
2.2 磁性纳米粒子的X射线粉末衍射表征
图2(a),(b)分别为油酸包裹的 Fe3O4纳米粒子和Fe3O4@SiO2-SO3Na复合纳米粒子的X射线粉末衍射图。
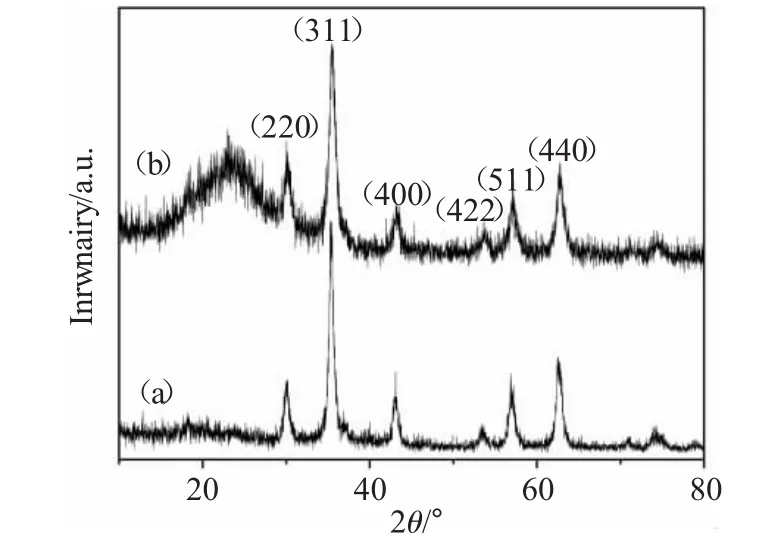
图2 (a)油酸包裹的Fe3O4纳米粒子和(b)Fe3O4@SiO2-SO3Na复合纳米粒子的X射线粉末衍射图Fig.2 Powder X-ray diffractograms of(a)oleic acid-capped Fe3O4nanoparticles and(b)Fe3O4@SiO2-SO3Na nanocomposites
从图2(a)中可以看到 2θ=30.4、35.6、43.3、53.6、57.4、62.6以及74.5出现7个特征衍射峰,它们分别对应于 (220)、(311)、(400)、(422)、(511)、(440)以及(533)晶面;通过与 Fe3O4纳米粒子的标准X射线衍射图谱相比较,可以发现它们的出峰位置完全吻合,证明我们制备的油酸包裹的Fe3O4纳米粒子属于立方尖晶石结构。从图2(b)中我们可以发现,Fe3O4@SiO2-SO3Na复合纳米粒子除了在大约25°的地方出现一个比较凸起的较宽的衍射峰以外,其余衍射峰与油酸包裹的Fe3O4纳米粒子的特征衍射峰出峰位置相一致,说明了SiO2已经成功的包裹在了Fe3O4纳米粒子的表面,从图1的透射电镜中我们可以明显的看到,SiO2包裹在Fe3O4纳米粒子的表面。
2.3 磁性纳米粒子的红外谱图表征
图3(a),(b)分别为 Fe3O4@SiO2和 Fe3O4@SiO2-SO3Na复合纳米粒子的红外光谱图。
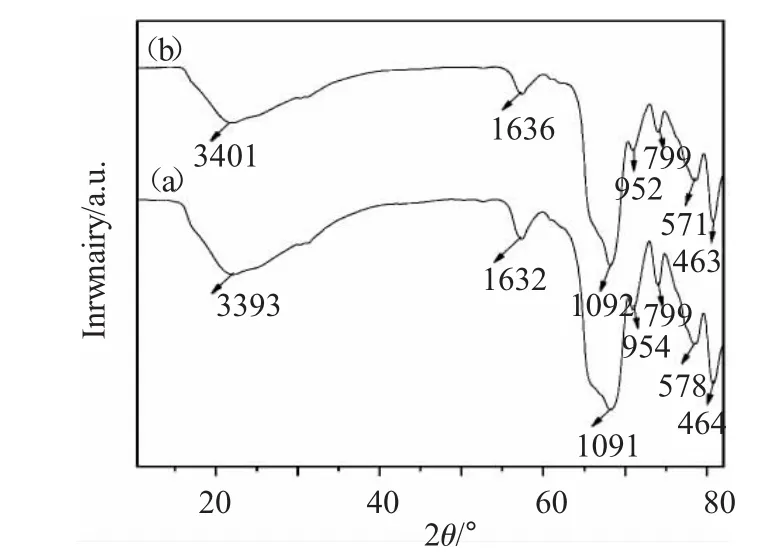
图3 (a)Fe3O4@SiO2和(b)Fe3O4@SiO2-SO3Na纳米粒子的红外光谱图Fig.3 FT-IR spectra of(a)Fe3O4@SiO2and(b)Fe3O4@SiO2-SO3Na nanoparticles
从图3(a)中可以看出,在578cm-1处的吸收峰是Fe3O4纳米粒子中Fe-O的特征伸缩振动峰,799和464cm-1的吸收峰分别对应于Si-O-Si的对称伸缩振动和弯曲振动峰,1091cm-1处的吸收峰为Si-O-Si反对称伸缩振动峰,954cm-1处出现的吸收峰为 Si-OH 的伸缩振动峰[4,5],3393和 1632cm-1处的吸收峰分别对应于-OH的伸缩振动和弯曲振动峰。傅里叶红外光谱充分说明SiO2已经成功的包裹在Fe3O4纳米粒子的表面。然而Fe3O4@SiO2-SO3Na复合纳米粒子与Fe3O4@SiO2相比较红外谱图差别不是很大,而且磺酸基在红外谱图上面也没有显示出来。
2.4 磁性纳米粒子的磁性能测试
图4(a)、(b)分别为疏水性Fe3O4纳米粒子与Fe3O4@SiO2-SO3Na复合磁性纳米吸附剂的磁化曲线结果。
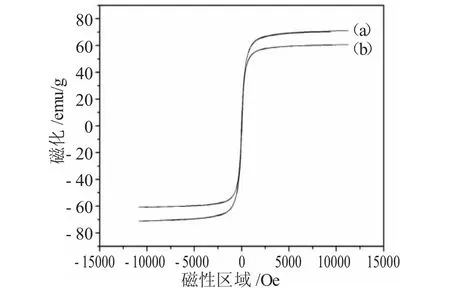
图4 (a)Fe3O4和(b)Fe3O4@SiO2-SO3Na纳米粒子的磁滞曲线Fig.4 Magnetic hysteresis loops of(a)Fe3O4and(b)Fe3O4@SiO2-SO3Na nanoparticles
从图4中我们可以看出,疏水性Fe3O4纳米粒子与Fe3O4@SiO2-SO3Na复合磁性纳米吸附剂的饱和磁化强度值分别为70.8和60.1emu·g-1。经过仔细观察我们还可以看出,疏水性Fe3O4纳米粒子和Fe3O4@SiO2-SO3Na复合磁性纳米吸附剂的矫顽力和剩磁几乎为零,说明二者都具有超顺磁的特性。Fe3O4@SiO2-SO3Na饱和磁化强度降低可能由于SiO2的包覆以及硅烷偶联剂的存在引起的。尽管它的饱和磁化强度有所降低,但是其仍然可以通过磁倾析方便地从反应溶液中分离出来。
2.5 Fe3O4@SiO2-SO3Na复合纳米粒子的吸附性能
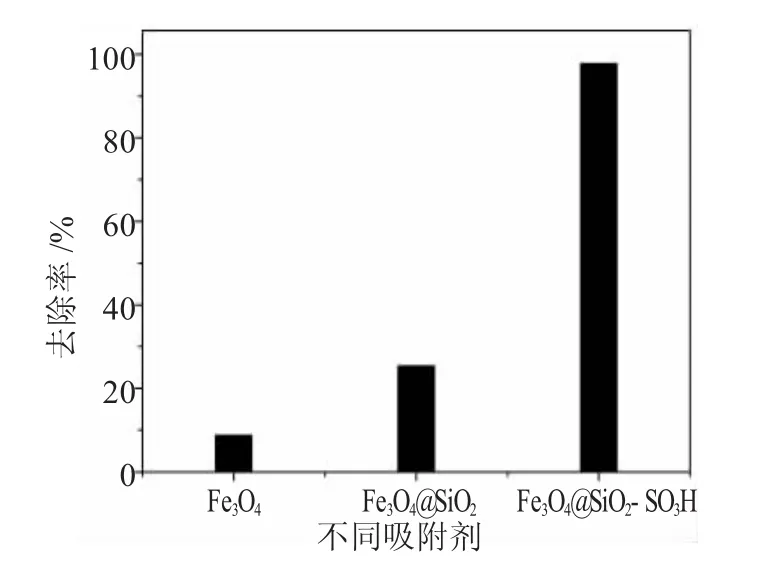
图5 不同吸附剂对Cu(Ⅱ)的去除效果Fig.5 Adsorption of Cu(Ⅱ)by different adsorbents

式中 E:重金属离子的去除率,%;CI:重金属离子初始质量浓度,mg·L-1;CF:重金属离子最终质量浓度,mg·L-1。
我们同样考察了Fe3O4@SiO2-SO3Na复合纳米粒子在不同 pH 值(1.8,3.2,5.1,6.5 以及 7.2)下对 Cu(Ⅱ)的去除效果,见图6。
从图5可以看出,Fe3O4@SiO2-SO3Na的去除率明显比Fe3O4和Fe3O4@SiO2的效果好很多。而且从图中还可以看出,Fe3O4对Cu(Ⅱ)的去除率为8.8%,Fe3O4@SiO2对Cu(Ⅱ)的去除率为25.4%。对于Fe3O4@SiO2-SO3Na复合纳米粒子来说,Cu(Ⅱ)的初始浓度从20mg·L-1降低至最终的0.45mg·L-1,根据公式 (1)我们可以计算出Fe3O4@SiO2-SO3Na对Cu(Ⅱ)的去除率可以达到97.8%。
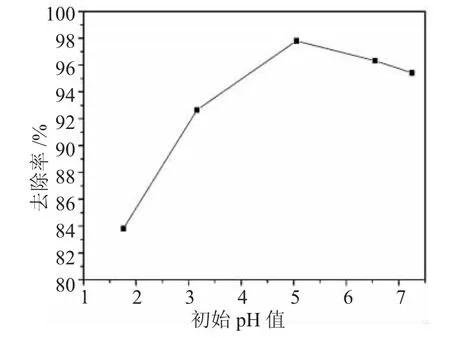
图6 Fe3O4@SiO2-SO3Na复合纳米粒子在不同pH值下对Cu(Ⅱ)的去除效果Fig.6 Effect of initial pH on Fe3O4@SiO2-SO3Na nanocomposites adsorption of Cu(Ⅱ)in aqueous solution
从图6中可以看出,在pH值分别为1.8,3.2,5.1,6.5以及7.2时,Fe3O4@SiO2-SO3Na复合纳米粒子对Cu(Ⅱ)的去除率分别为83.8%,92.3%,97.8%,96.3%以及95.4%。因此,我们认为pH值为5.1时是去除Cu(Ⅱ)的最佳条件。
Fe3O4@SiO2-SO3Na复合纳米粒子的循环使用效果是考察吸附剂的一项关键指标,因为在实际应用中吸附剂材料必须具备可再生性能以及在比较苛刻的条件下不会被分解,否则将不会有很大的应用前景。
图7为Fe3O4@SiO2-SO3Na复合纳米粒子去除Cu(Ⅱ)的循环结果。
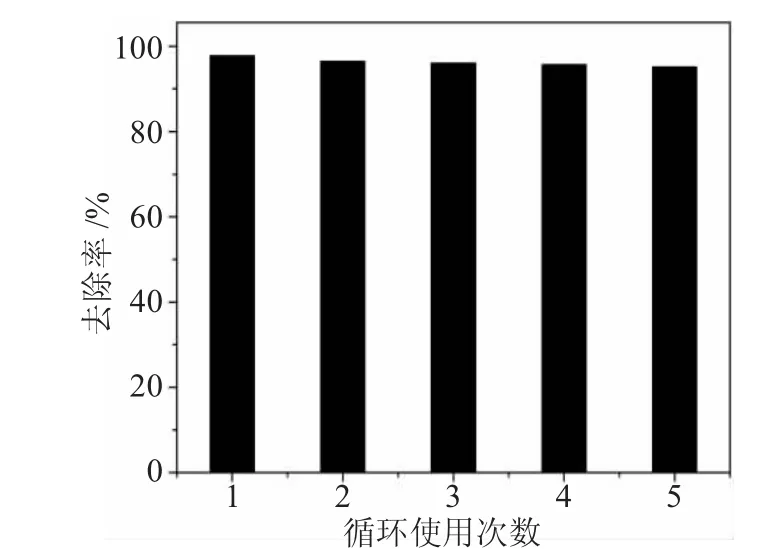
图7 Fe3O4@SiO2-SO3Na复合纳米粒子去除Cu(Ⅱ)的循环效果Fig.7 Effect of different cycles on Fe3O4@SiO2-SO3Na nanocomposites adsorption of Cu(Ⅱ)in aqueous solution
从图7可知,该吸附剂在循环使用5次以后,对Cu(Ⅱ)去除效果几乎没有发生明显的变化,在第5次循环中它对Cu(Ⅱ)去除率仍然可以达到95.2%。以上结果证明,我们所制备的Fe3O4@SiO2-SO3Na复合纳米粒子是一种去除效果很理想的,很有应用前景的吸附剂。
3 结论
本研究成功制备了磺酸基功能化的磁性纳米吸附剂Fe3O4@SiO2-SO3Na,其平均粒径约为45nm而且颗粒分散性良好,平均直径比较均匀;通过FT-IR、TEM、XRD和VSM对其进行了表征,证明了我们成功制备了该复合磁性纳米吸附剂。将制备的磁性纳米吸附剂Fe3O4@SiO2-SO3Na应用于对Cu(Ⅱ)的吸附实验中,结果表明,该吸附剂对Cu(Ⅱ)具有很好的去除效果。而且我们发现溶液的pH值能显著影响吸附剂对Cu(Ⅱ)离子的吸附效果,其中pH为5.1时吸附效果最佳。更重要的是,在5次循环测试之后它对Cu(Ⅱ)去除率仍可达到95.2%,说明所合成的Fe3O4@SiO2-SO3Na复合纳米粒子是一种优良的吸附剂材料。
[1]Hu J,Chen G H,Lo I MC.Selective removal of heavy metals from industrial wastewater using maghemite nanoparticle:Performance and mechanisms[J].Journal of Environmental Engineering,2006,132(7):709-715.
[2]Tuutijärvi T,Lu J,Sillanpää M,Chen G.As(Ⅴ)adsorption on maghemite nanoparticles[J].Journal of Hazardous Materials,2009,166(2-3):1415-1420.
[3]LianeM.Rossi,InnaM.Nangoi,andNatáliaJ.S.Costa,Ligand-Assisted Preparation of Palladium Supported Nanoparticles:a Step toward Size Control[J].Inorganic Chemistry,2009,(48):4640-4642.
[4]王德平,娄敏毅,黄文旵,等.偶联剂修饰纳米磁性粒子红外光谱及相关分析[J].同济大学学报(自然科学版),2005,33(2):201-204.
[5]汪秀全,陈奇,宋鹂,等.多孔SiO2-TiO2块材的结构与性质[J].无机材料学报,2006,21(1):181-186.

