两种基于恒定链活性片段载体在增强抗体分泌中作用的比较①
孟凡涛 陈芳芳 余为一 (安徽农业大学安徽省人兽共患病重点实验室,合肥230036)
两种基于恒定链活性片段载体在增强抗体分泌中作用的比较①
孟凡涛 陈芳芳 余为一 (安徽农业大学安徽省人兽共患病重点实验室,合肥230036)
目的:比较基于恒定链片段的两种载体的免疫效果和作用机理。方法:分别构建了含新城疫病毒抗原表位F306和Ii不同片段的三个嵌合体(Ii-key/F306、Ii-key/F306/ND(两个氨基酸残基)和用抗原表位取代Ii-CLIP的Ii/F306),经纯化后的融合蛋白免疫小鼠,并用ELISA检测其抗体效价。同时嵌合体与Mhc共转染COS7细胞,观察两者的细胞定位与结合。结果:Ii-key/F306免疫组比单独F306抗原肽免疫组的抗体效价提高2倍,Ii-key/F306/ND免疫组增至4倍,而Ii-F306免疫组只增强2.5倍。在与Mhc共转染的COS7细胞和免疫共沉淀中,Ii-key/F306和Ii-key/F306/ND既没有与MHCⅡ分子的膜共定位作用,也不能与后者结合;而Ii-F306却能与MHCⅡ分子在浆膜共定位,并与后者结合。结论:这些结果表明,嵌合体都具有增强免疫效果的作用,并提示Ii片段促进了抗原肽与MHCⅡ分子结合。
恒定链;抗体;共定位;MHCⅡ类分子
MHCⅡ分子在提呈外源性抗原中起重要作用。Ii与MHCⅡ αβ链结合形成αβIi复合物,分布在B细胞表面和树突状细胞表面[1,2]。Ii的 CLIP片段结合MHCⅡ分子的肽结合区(PBR),防止自身多肽结合MHCⅡ分子[3-5]。在未成熟的溶酶体,Ii链被酶解,其CLIP区被外源性抗原肽取代[6]。体外的研究表明,纯化的αβIi经半胱氨酸蛋白酶处理后,组织蛋白酶B可解离Ii,同时形成游离α/β二聚体。这些解离的α/β具有结合多肽的能力[7]。在核磁共振光谱中,MHCⅡ分子与Ii-CLIP的结合是一个从常规到反线性的互变的动态过程。X衍射结晶表明,MHC的保守残基和肽骨架形成以两种形态的氢结合网。酶促反应可加快这种MHC-CLIP结合的两种形态的转变以阻止抗原肽的进入[8]。
近年来,Ii作为免疫载体促进免疫应答[9]。一是将抗原肽取代Ii的CLIP,不仅可增强抗感染免疫,还可以改变异常免疫应答的性质[10,11];二是利用Ii-key结构的免疫活性,即恒定链跨膜区与CLIP区N端相连的四个氨基酸序列(LRMK),与抗原肽连接形成的嵌合体,具有增强免疫效果的功能[12]。Ii-key结构在核酸疫苗和多肽疫苗中得到应用[13,14]。本研究比较了这两种载体的免疫效果,探索了它们在细胞的定位和作用机理。
1 材料与方法
1.1 基因片段的克隆与嵌合体、重组质粒的构建
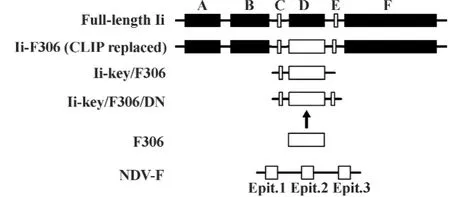
图1 含Ii片段和抗原表位的嵌合体示意图Fig.1 A schematic diagram of the hybrids containing Ii segments and antigen peptides F306
首先,以新城疫病毒(Newcastle disease virus,NDV) F蛋白的cDNA为模板[15],用重叠延伸方法构建了一个含3个表位的抗原表位,命名为F306(图1)。然后以本实验室保存的小鼠Ii链为模板[16],用同样的方法构建含不同Ii功能区域的Ii-F306嵌合体片段(图1)。最后将它们分别克隆到真核表达载体pmCherry-C1中以研究这些表达产物在细胞内的定位。并将H2-Aa和H2-Ab基因(表1)克隆到带有绿色荧光标签蛋白(GFP)的真核载体pEGFP-N1中。同时,为研究其免疫特性将相应嵌合体插入原核表达载体pGEX-4T-1和pET-32a。在免疫共沉淀中,将H2-Ab插入真核载体PCMV-Myc。所有自行设计的引物见表1。构建的质粒(如图1所示)送上海生工测序鉴定。
1.2 细胞培养、转染与激光共聚焦显微镜观察COS7细胞由实验室保存。细胞置含10%新生牛血清的DMEM培养基于37℃、5%CO2培养。用脂质体2000进行细胞转染。转染前24小时用适量的DMEM培养基铺细胞,至转染前达到50% ~80%的铺板量。转染时,先将一定比例的质粒与转染Buffer充分混合,10分钟后加入一定量的脂质体2000,室温放置30分钟后轻轻的滴加到细胞板中。培养4~6小时后弃转染液,换成正常培养基。转染24小时后,把甲醛固定的细胞片放置在倒置显微镜下用油镜观察表达物在细胞内的位置。红色荧光蛋白和绿色荧光蛋白的吸光值分别是488 nm和515 nm。

表1 引物、恒定链片段与重组质粒Tab.1 1 Primers,cloned Ii-segments and recombinants
1.3 免疫共沉淀与免疫印迹 将各种含Ii片段和F306的嵌合体(Ii/GFP,Ii-F306/GFP,Cyt/Tra/Iikey/F306/DN/GFP,Cyt/Tra/Ii-key/F306/GFP or Iikey/F306/DN/GFP)与H2-Aa/AH或者H2-Ab/Myc共转染COS7细胞,铺板和转染方法同上。48小时后进行免疫共沉淀。免疫共沉淀步骤按照试剂盒(Roche公司)说明操作。将最终获得的蛋白样品进行SDS-PAGE电泳后,采用半干转移式将蛋白由PAGE胶转移到NC膜上。结合到膜上的蛋白用10%小牛血清封闭,与Myc单抗进行过夜孵育。洗涤后与标记有辣根过氧化物酶的山羊抗小鼠二抗孵育2小时后再次充分洗涤,最后 ECL发光显色分析。
1.4 嵌合体抗原的表达和纯化 将携带原核表达载体pGEX-4T-1和pET32a的F306和F306嵌合转入到大肠杆菌Rosetta进行IPTG的诱导表达,将表达的蛋白经镍柱纯化。纯化的蛋白经液相色谱(HPLC)纯度检测达到90%以上。以质粒pGEX-4T-1表达的蛋白为免疫蛋白,以质粒pET32a表达的蛋白为ELISA检测蛋白。
1.5小鼠免疫、抗体检测和数据的统计学分析 10周龄BALB/c雌鼠,购自于安徽医科大学,免疫蛋白的剂量为50 μg/只。每个实验组为3只,阴性对照注射生理盐水。常规免疫4周后经眼球采血,收集血清,于 -20℃保存备用。以 F306为抗原,包被ELISA板进行抗体免疫检测,每个样品重复3孔。以辣根过氧化物酶标记的山羊抗小鼠为二抗,最后以邻苯二胺(OPD)显色反应。室温放置15分钟左右后终止反应,在酶标仪在409 nm波段测吸光值。数据进行统计学分析。
2 结果
2.1 活性片段与质粒的构建及其鉴定 首先,分别从鼠外周血单核细胞(Peripheral blood mononuclear cells,PBMC)提取 mRNA,经 RT-PCR 获得 MHCⅡα、β和恒定链基因片段。经测序比对鉴定(图2)后,将MHCⅡ类分子α和β链基因片段分别插入质粒 pEGFP-N1(表1)。
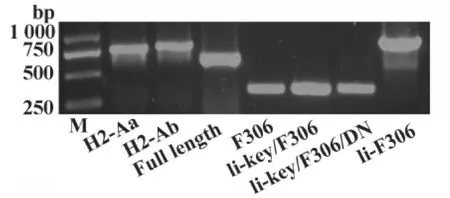
图2 扩增和重组的DNA片段鉴定Fig.2 Identification of the amplified and reconstructed DNA segments
其次,从恒定链全长基因经大引物扩增,将抗原肽基因片段替代CLIP,构建嵌合体Ii/F306(图2)。再用相应引物(表1)获得嵌合体Ii-key/F306和Iikey/F306/DN(图2)。
最后将上述片段分别插入质粒pmCherry-C1,构建真核重组表达质粒(表1),用于转染COS7;插入原核质粒pGEX-4T-1和pET-32a,用于转染大肠杆菌表达。诱导表达的蛋白进行切胶纯化用于免疫动物。GST蛋白的分子量约为26 kD,GST/F306融合蛋白的分子量预期约为35.8 kD;GST/Ii-key/F306为 36.2 kD;GST/Ii-key/F306/DN 为 36.4 kD; GST/Ii/F306(F306替代 CLIP)为 57.9 kD。His/ F306为ELISA检测中包被抗原。SDS-PAGE电泳结果显示在预期大小处有相应的蛋白条带(图3)。2.2 恒定链活性片段诱导的免疫应答分析 检测恒定链活性片段在抗原肽诱导的抗体应答中的作用,发现用F306取代CLIP的Ii-F306免疫组产生的血清抗体效价比单独F306抗原肽免疫组高2.5倍;用Ii-key/F306免疫组增强约2倍,而Ii-key/F306/ DN则增强达4倍(图4),这说明CLIP的C端的残基也具有功能。

图3 纯化的嵌合体蛋白鉴定Fig.3 Identification of the purified hybrid proteins
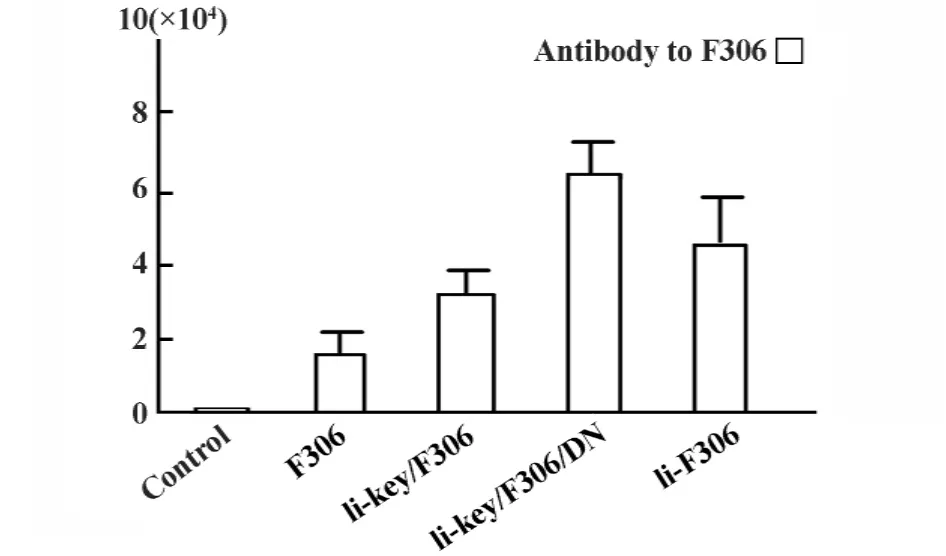
图4 Ii活性片段增强小鼠特异性抗体产生的作用Fig.4 Effect of the Ii active segments on specific antibody production in the BALB/c mice
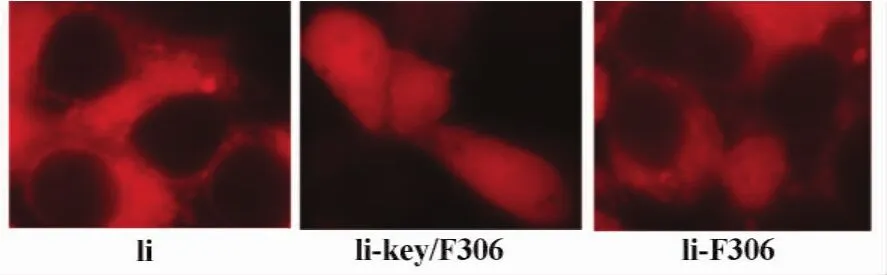
图5 Ii和嵌合体在COS7细胞中的定位(×1 000)Fig.5 The location of Ii and the Ii hybrids in COS7 cells (×1 000)
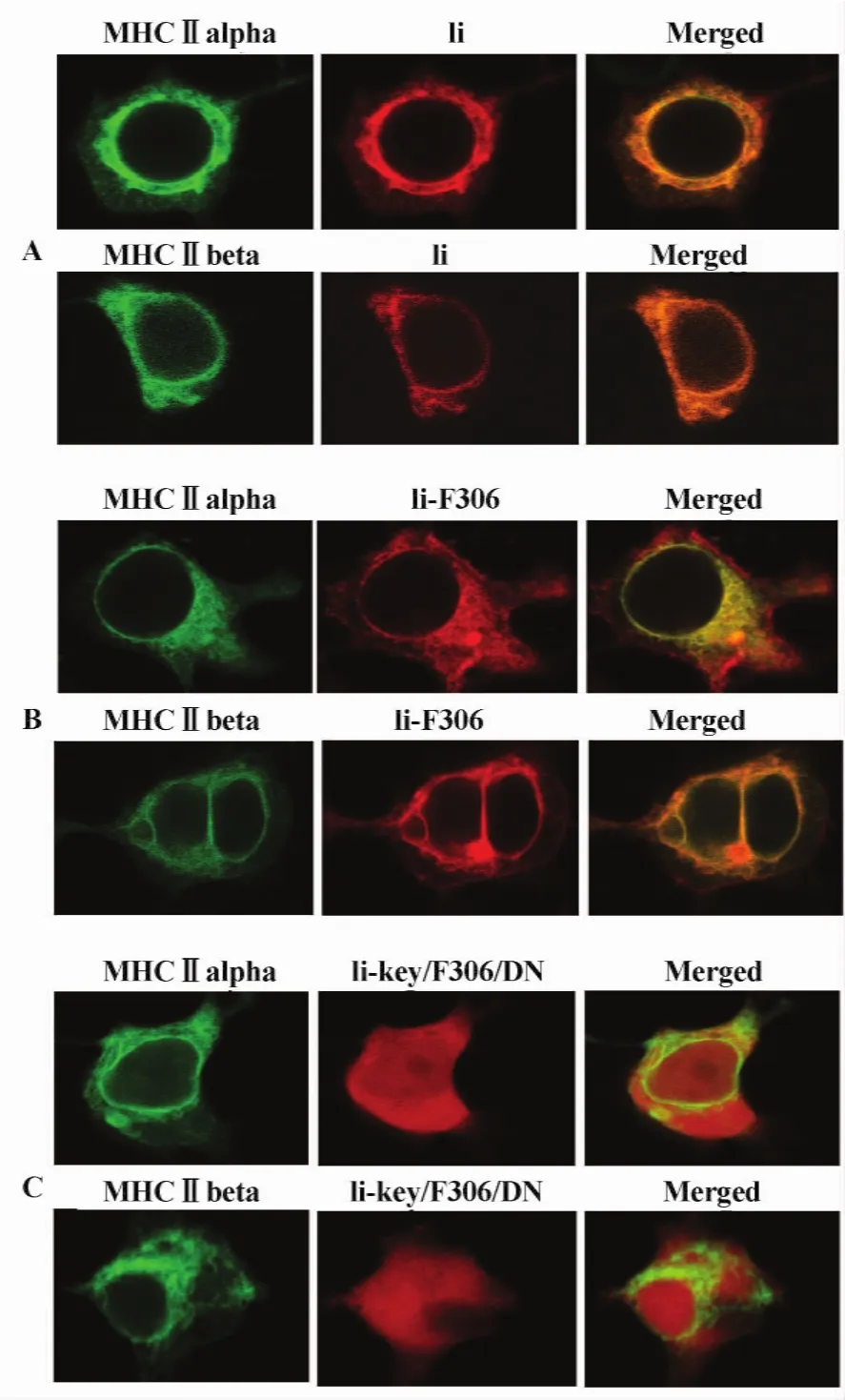
图6 Ii和嵌合体在COS7细胞中与MHCⅡ分子的共定位(×1 000)Fig.6 The co-location of Ii or the Ii hybrids with MHC Ⅱmolecule in COS7 cells(×1 000)
2.3 活性片段在细胞的定位 为明确这两个恒定链活性片段在真核细胞的定位,分别用重组真核表达质粒转染COS7细胞。由图5可见:恒定链作为跨膜蛋白,表达和定位于细胞浆膜(图5,左),用F306替代CLIP的Ii-F306也保持了恒定链的细胞膜定位(图5右);而Ii-key/F306片段则没有胞膜定位的作用(图5,中)。
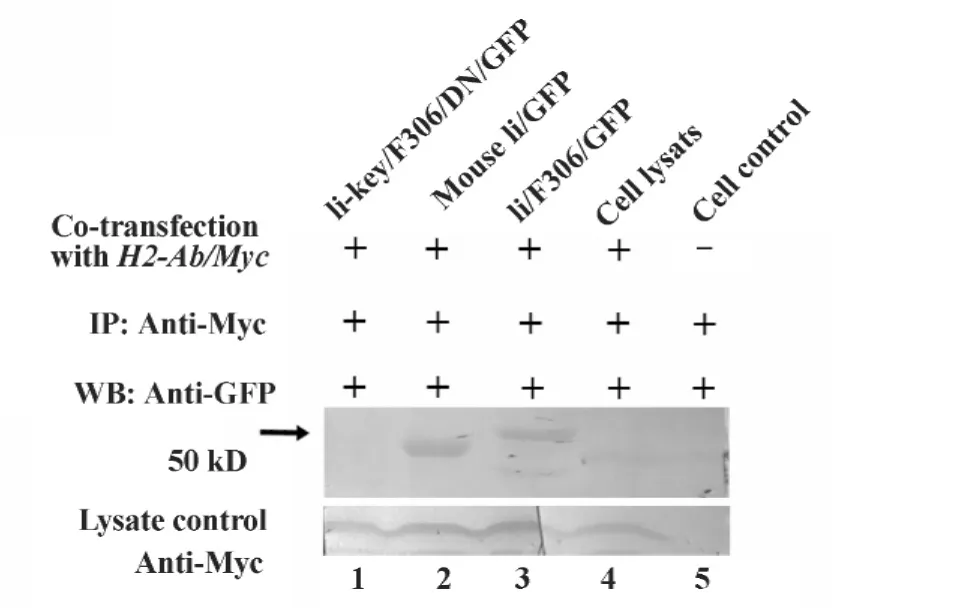
图7 Ii和嵌合体与MHCⅡ β链的结合Fig.7 Binding of Ii or the Ii hybrids to MHC Ⅱ β chain
2.4 活性片段与MHCⅡ分子在细胞的共定位 为了解含恒定链活性片段的嵌合体与MHCⅡ分子的关系,将这些重组质粒共转染COS7细胞,并用激光共聚焦显微镜观察。MHCⅡα/β链和Ii链以及嵌合体分别由GFP和RFP标记,当两种相关蛋白分子在细胞相同部位表达共定位,就会形成橙色荧光,否则仍保持各自荧光颜色。图6的结果表明,MHCⅡα链和β链都能与Ii链或Ii-F306在胞浆膜共定位,而Ii-key/306却不能与胞浆膜上的MHCⅡ共定位。2.5活性片段与MHCⅡ分子的结合特性 为证实胞膜上共定位的MHCⅡ分子与Ii或Ii嵌合体是两者稳定结合形成复合体的结果,进一步用共转染的产物进行免疫共沉淀和免疫印迹。结果如图7所示,Ii链和Ii-F306能够与MHCⅡ结合形成稳定的复合物,而Ii-key/F306则不能与MHCⅡ分子结合。
3 讨论
首先,Ii-key和用抗原肽取代CLIP的Ii都具有明显的增强小鼠产生特异性抗体水平的作用。抗原肽与MHCⅡ分子不是特异性的结合,而是基于异体识别的兼容性的结合。MHCⅡ分子的肽结合槽是与抗原肽结合的部位。研究表明,MHCⅡ构象是重要的决定因素[17],而抗原肽也是决定MHCⅡ构象改变的因素[18]。在初始条件下,MHCⅡ以“松弛性”构象增加抗原肽进入能力;而一旦抗原肽进入MHCⅡ,则形成“紧密性”构象[19]。由于 Ii链具有结合MHCⅡ分子的结构特性,而CLIP区正是进入肽结合凹槽的区段,所以不仅用抗原肽取代CLIP的Ii链嵌合体,而且与CLIP的N端连接Ii-key四个氨基酸,都可以易化抗原肽进入凹槽而改变MHCⅡ的构象。基于这种可能,本研究除了将抗原肽与Iikey连接外,还连接了CLIP的C端两个氨基酸DN (Asn-Asp),以进一步增强这种作用。结果表明与CLIP的N端和C端连接的片段均具有明显增强抗原刺激机体产生抗体的作用,其机理可以推测为促进了抗原肽进入和结合MHCⅡ分子凹槽。然而,由于Ii-key/F306和Ii-key/F306/ND均不能与MHCⅡ分子结合(图7),提示它们仍不足以与MHCⅡ分子形成稳定的复合物。总而言之,本研究结果表明,CLIP的C端两个氨基酸DN与Ii-key四个氨基酸残基一样,也可以作为增强免疫的功能基团。
其次,Ii链的跨膜区和胞浆区具有膜定位的功能,而且完整的Ii链还含有与MHCⅡ结合的三聚体区。所以,Ii链和用抗原取代CLIP的Ii-F306嵌合体,都能与MHCⅡ分子的α或β链在细胞膜共定位,而含有Ii-key结构的嵌合体却没此有功能(图7)。尽管Ii-key/F306/DN和Ii-F306都有增强机体产生抗体的功能,但是,推断这两者的作用主要通过协助MHCⅡ分子,通过结合MHCⅡ结合槽的可变构象外的位点,构象的改变使之更易于抗原表位的进入[20],而与在细胞膜的定位无关。
1 Lindner R.Transient surface delivery of invariant chain-MHC II complexes via endosomes:a quantitative study[J].Traffic,2002;3: 133-146.
2 Saudrais C,Spehner D,de la Salle H et al.Intracellular pathway for the generation of functional MHC class II peptide complexes in immature human dendritic cells[J].J Immunol,1998;160:2597-2607.
3 Romagnoli P,Germain R N.The CLIP region of invariant chain plays a critical role in regulating major histocompatibility complex class II folding,transport,and peptide occupancy[J].J Exp Med,1994; 180:1107-1113.
4 Jasanoff A,Wagner G,Wiley D C.Structure of a trimeric domain of the MHC class II-associated chaperonin and targeting protein Ii[J].EMBO J,1998;17:6812-6818.
5 Stumptner P,Benaroch P.Interaction of MHC class II molecules with the invariant chain:role of the invariant chain(81-90)region[J].EMBO J,1997;16:5807-5818.
6 Busch R,Rinderknecht C H,Roh S et al.Achieving stability through editing and chaperoning:regulation of MHC class II peptide binding and expression[J].Immunol Rev,2005;207:242-260.
7 Roche P A,Cresswell P.Proteolysis of the class II-associated invariant chain generates a peptide binding site in intracellular HLA-DR molecules[J].J Immunol,2011;187:1076-1080.
8 Günther S,Schlundt A,Sticht J et al.Bidirectional binding of invariant chain peptides to an MHC class II molecule[J].Proc Natl Acad Sci USA,2010;107:22219-22224.
9 Mikkelsen M,Holst P J,Bukh J et al.Enhanced and sustained CD8+T cell responses with an adenoviral vector-based hepatitis C virus vaccine encoding NS3 linked to the MHC class II chaperone protein invariant chain[J].J Immunol,2011;186:2355-2364.
10 Kim D,Hoory T,Monie A et al.Enhancement of DNA vaccine potency through coadministration of CIITA DNA with DNA vaccines via gene gun[J].J Immunol,2008;180:7019-7027.
11 Gao M,Wang H P,Wang Y N et al.HCV-NS3 Th1 minigene vaccine based on invariant chain CLIP genetic substitution enhances CD4(+)Th1 cell responses in vivo[J].Vaccine,2006;24: 5491-5497.
12 Adams S,Albericio F,Alsina J et al.Biological activity and therapeutic potential of homologs of an Ii peptide which regulates antigenic peptide binding to cell surface MHC class II molecules[J].Arzneimittel-forschung,1997;47:1069-1077.
13 Kallinteris N L,Wu S,Lu X et al.Linkage of Ii-key segment to gp100(46-58)epitope enhances the production of epitope-specific antibodies[J].Vaccine,2005;23:2336-2338.
14 Erskine C L,Krco C J,Hedin K E et al.MHC class II epitope nesting modulates dendritic cell function and improves generation of antigen-specific CD4 helper T cells[J].J Immunol,2011;187: 316-324.
15 许发芝,吴胜国,余为一.新城疫病毒(NDV)-F基因(NDV-F)稳定表达P815细胞株的建立[J].农业生物技术学报,2009;17 (4):567-570.
16 董林,余为一,许发芝et al.小鼠恒定链基因的克隆及鉴定[J].安徽农业科学,2007;35(25):7856,7861.
17 Sato A K,Zarutskie J A,Rushe M M et al.Determinants of the peptide-induced conformational change in the human class II major histocompatibility complex protein HLA-DR1[J].J Biol Chem,2000;275(3):2165-2173.
18 Sadegh-Nasseri S,Germain R N.A role for peptide in determining MHC class II structure[J].Nature,1991;353:167-170.
19 Germain R N,Hendrix L R.MHC class II structure,occupancy and surface expression determined by post-endoplasmic reticulum antigen binding[J].Nature,1991;353:134-139.
20 Sotiriadou N N,Kallinteris N L,Gritzapis A D et al.Ii-key/HER-2/neu(776-790)hybrid peptides induce more effective immunological responses over the native peptide in lymphocyte cultures from patients with HER-2/neu+tumors[J].Cancer Immunol Immunother,2007;56:601-613.
[收稿2012-03-03 修回2012-05-14]
(编辑 张晓舟)
Comparison of effect of two vector based on invariant chain segments on the increasing antibody production
MENG Fan-Tao,CHEN Fang-Fang,YU Wei-Yi.Key Laboratory of Zoonoses of Anhui Province,Anhui Agricultural University,Hefei 230036,China
Objective:To compare the effects of two vectors based on invariant chain(Ii)segments on the immune response.MethodsThree hybrids containing NDV epitope F306 and Ii segments,Ii-key/F306,Ii-key/F306/ND(two residues)and Ii/F306 in which CLIP was replaced by epitope F306,were reconstructed respectively.BALB/c mice were immunized with the purified fusion proteins and the antibody titers were detected with ELISA respectively.Meanwhile the hybrids and Mhc were co-transfected in COS7 cells to observe their location and binding.ResultsThe groups immunized with Ii-key/F306 or Ii-key/F306/DN had two-fold or four-fold higher antibody titers than that immunized with F306 alone respectively,but the group immunezed with Ii-F306 enhanced only two and a half-fold higher antibody titers.In the co-transfected COS7 cells,neither Ii-key/F306 nor Ii-key/F306/DN could co-locate on the plasma membrane or bind with MHC classⅡ molecule.However,Ii-F306 could co-locate and bind with MHC classⅡ molecule.ConclusionThese results showed that these hybrids could increase the immune response and suggested that Ii segments improved binding of the epitope to MHC classⅡ molecule.
Invariant chain(Ii);Antibody;Co-location;MHC classⅡ molecule
S855.3
A
1000-484X(2012)08-0728-05
10.3969/j.issn.1000-484X.2012.08.012
①本文为国家自然科学基金资助项目(No.31172306)
孟凡涛(1988年-),男,在读硕士,主要从事微生物与免疫学方面研究;
及指导教师:余为一(1952年-),男,教授,博士生导师,主要从事微生物与免疫学方面研究,E-mail: yuweiyi@ahau.edu.cn。

