黄芩苷对人淋巴细胞Toll样受体的调节①
孙 午 熊 莺 王 敏 姜青龙 龚淑琪 傅颖媛 (南昌大学免疫学教研室,南昌330000)
黄芩苷对人淋巴细胞Toll样受体的调节①
孙 午②熊 莺②王 敏 姜青龙 龚淑琪 傅颖媛 (南昌大学免疫学教研室,南昌330000)
目的:研究黄芩苷对人淋巴细胞Toll样受体(TLR)的调节,探讨其在免疫调节方面的作用。方法:1.尼龙毛分离法分离人外周血T和B细胞后使用UF-50流式分析寻找最佳黄芩苷作用浓度;2.采用实时定量荧光RT-PCR,分析在最佳黄芩苷作用浓度处理前后TLRs的表达情况;3.通过加入鼠抗人TLR4单抗进行受体抑制实验并应用实时定量荧光RT-PCR探讨黄芩苷对TLRs的调节位点。结果:1.1 mg/ml的黄芩苷在体外可以显著促进人T、B淋巴细胞增殖(P<0.05);2.使用1 mg/ml黄芩苷相对于未用黄芩苷处理的T、B细胞,其TLR3、TLR7、TLR8及TLR9 mRNA的表达均有显著增加(P<0.05),T细胞增加倍数分别为21、15、57和 66倍,B细胞增加的倍数分别为 24、20、61和 63倍,而 TLR1、TLR2、TLR4、TLR5、TLR6及TLR10 mRNAs表达变化不显著(P>0.05);3.在1 mg/ml黄芩苷作用下人T、B细胞TLR3、7、8和9 mRNA在12小时时表达已开始增加,除T细胞的TLR7 mRNA表达在48小时时略有下降外,其余表达基本一直持续增加,至48小时到达峰值;4.人T、B细胞在被黄芩苷作用前使用鼠抗人TLR4单克隆抗体封闭,会显著降低黄芩苷对TLR3、7、8和9 mRNA表达的诱导作用(P<0.05),T 细胞下降比率分别为 47.6%、66.7%、50.9% 和 45.5%;B 细胞下降比率分别为 50.0%、45.0%、50.8% 和 50.8%。结论:1.黄芩苷在体外能显著促进T、B淋巴细胞增殖;2.人外周血T、B细胞组成性表达含量差异较大的TLR1-10 mRNA,黄芩苷在体外可以显著上调人 T、B 淋巴细胞 TLR3、TLR7、TLR8及 TLR9 mRNAs的表达,但对 TLR1、TLR2、TLR4、TLR5、TLR6及TLR10 mRNAs未见明显影响;3.黄芩苷可能通过TLR4发挥对人天然免疫能力的调节。
黄芩苷;T淋巴细胞;B淋巴细胞;Toll样受体;RT-PCR
随着全球疾病谱和医疗模式改变,合成药所带来的不良反应,利用中药、天然药物治疗、预防疾病成了人们的追求。黄芩为唇形科植物黄芩的干燥根,主要成分以黄芩苷为主,是一种相当古老的中药,在我国已使用了上千年,安全无害,最早记载在《神农本草经》中并列为中品。近年来,国内外对其进行了大量的研究,且达到了较高的水平,其中较大比例的研究是黄芩中有效成分黄酮类化合物,并从多个角度进行了探讨,已有很多文献报道黄芩苷在体外具有很好的抗真菌感染和抗肿瘤等作用[1],但尚未报道黄芩苷免疫调节及受体研究。
宿主的防御机制包括非特异性免疫和特异性免疫,Toll样受体(TLR)广泛表达在天然免疫系统,是一类Ⅰ型跨膜糖蛋白,由胞外区、跨膜区和胞质区组成。它们通过识别保守的病原体相关的分子位点(PAMPS),例如细菌的脂多糖、脂肽,或者是细菌和病毒的 DNA、RNA等,来识别大量的异己抗原。TLRs在固有免疫和引导适应性免疫中扮演着重要的角色,国内外均有不少关于TLRs的报道。
本研究拟通过黄芩苷在体外对人T、B淋巴细胞Toll样受体表达的影响,探讨该药物可能作用的位点,为黄芩苷的进一步广泛应用提供依据。
1 材料与方法
1.1 主要试剂和抗体 黄芩苷由江西省中药研究所提供,纯度达99.9%。新鲜人血购自江西省血站。DMEM、TRIzol试剂购自Transgen公司。UCG、cDNA第一链合成试剂盒购自 Fermentas公司。SYBR Green实时定量PCR试剂盒购自Tiangen公司。鼠抗人TLR4、CD3单克隆抗体购自eBioscience公司。流式细胞分析使用仪器配套试剂。淋巴细胞分离液购自天津中科院。SPA和ConA购自Sigma公司。RPMI1640购自美国Gibco公司。
1.2 制备高纯度和高活性的T、B细胞
1.2.1 尼龙毛柱的制备 尼龙毛用0.2 mol/L盐酸浸湿数小时,后用双蒸水冲洗3遍。再将尼龙毛置入烧杯中,加双蒸水煮沸10分钟,将尼龙毛置漏斗内滴干。重复上述过程6次,最后两次用去离子水。称取尼龙毛5克,将其仔细撕开,梳整,使其松散均匀,装入50 ml注射器内,高压灭菌。将柱内尼龙毛用预温的RPMI1640浸润,关闭阀门。37℃静止30分钟。用Hank液和RPMI1640细胞培养基各5 ml洗柱,流速 0.2 ml/s。
1.2.2 人外周血淋巴细胞的分离 静脉血用pH7.2~7.6的Hank液2倍稀释,加入到等量淋巴细胞分离液面上,用水平离心机以2 000 r/min离心30分钟,收获单个核细胞,采用贴壁法去除单核细胞,最后获得淋巴细胞备用。
1.2.3 T、B淋巴细胞分离 将细胞悬液装入尼龙毛柱,关闭阀门,置37℃孵育60分钟。然后用37℃预温20%FCS RPMI1640培养液40 ml洗脱柱2次,流速1滴/秒;洗脱液中富含T细胞;将装载尼龙毛柱的注射器放置4℃冰箱30分钟,再用玻棒轻轻挤压尼龙毛柱,再用预冷的RPMI1640培养液反复冲洗挤压几次,这样收集的液体中富含B细胞;对分离的 T、B细胞用 CDC鉴定纯度(>90%),用0.25%台盼蓝染色,鉴定活性(>95%);调整细胞浓度为1×107ml-1备用。
1.3 采用UF-50流式分析寻找最佳的黄芩苷作用浓度
1.3.1 将黄芩苷配成8 mg/ml溶液,再倍比稀释,制成4、2、1和 0.5 mg/ml的黄芩苷溶液,分别取 1 ml与制备好的1 ml细胞悬液混合,同时设置阴性和阳性对照,置于CO2温箱孵育48小时。
1.3.2 UF-50开机自检通过后,将黄芩苷和细胞作用的溶液轻轻混匀后,上机测试,结果以散点图表示,根据散点图判断黄芩苷最佳作用浓度。
1.4 采用实时定量荧光RT-PCR分析在最佳黄芩苷作用浓度处理前后TLRs的表达情况
1.4.1 将黄芩苷最佳作用浓度处理的细胞用RNA提取和逆转录试剂盒制成cDNA备用,同时设置阴性对照。
1.4.2 结合文献和自己设计TLRs受体及β-actin的引物备用(见表1)。
1.4.3 实时定量荧光 RT-PCR使用25 μl体系: 12.5 μl的 2 × SYBR Green PCR Master Mix,1 μl的cDNA,引物的终浓度为 0.3 μmol/L,余量用蒸馏水补足。反应条件:95℃15分钟,接着是40个循环: 95℃变性15秒,58℃退火15秒,72℃延伸30秒。
1.4.4 采用相对定量标准曲线法进行定量,以βactin标准化加入的样本量,最终结果表示为经药物处理前后基因表达的差异。
1.5 通过受体抑制实验应用实时定量荧光 RTPCR探讨黄芩苷对TLRs的调节机制
1.5.1 根据文献和已经了解的TLRs识别的位点,设计受体抑制实验。
1.5.2 按照抗体试剂盒说明书将抗体和制备好的细胞悬液在4℃作用30分钟后,再用最佳浓度黄芩苷处理,然后用RNA提取和逆转录试剂盒制成cDNA备用,同时设置抗体阴性对照。
1.5.3 同 1.4.3。
1.5.4 定量方法同 1.4.4。
1.5.5 根据抗体加入与否,TLRs表达的差异,探讨黄芩苷对TLRs的调节位点。
2 结果
2.1 流式分析确定最佳黄芩苷作用浓度 细胞流式分析结果见图1、2及表2:从散点图、细胞计数和统计分析的结果可发现低浓度黄芩苷对T、B细胞增殖有促进作用,1 mg/ml黄芩苷为最佳浓度,而高浓度黄芩苷对T、B细胞有一定毒性。
2.2 荧光定量RT-PCR的熔解曲线和扩增曲线直接对未经黄芩苷处理的 T、B细胞进行 TLR1-TLR10表达的荧光定量RT-PCR分析,其熔解曲线和扩增曲线见图3、4,可以观察到在75℃至85℃之间存在特异性的峰,证明PCR反应存在特异性的扩增产物,扩增曲线平滑,具有较典型的S形,证明PCR反应体系设计合理,结果可靠。也表明人T、B细胞组成性的表达含量差异较大的TLR1-TLR10 mRNA。

表1 引物列表Tab.1 Primer list

图1 流式分析散点图(n=5)Fig.1 Streaming scatterplot chart analysis(n=5)

表2 不同浓度黄芩苷对淋巴细胞转化影响的结果(x ± s,n=5,个/μl)Tab.2 The lymphocyte transformation effect by different concentrations of baicalin(x ±s,n=5,/μl)
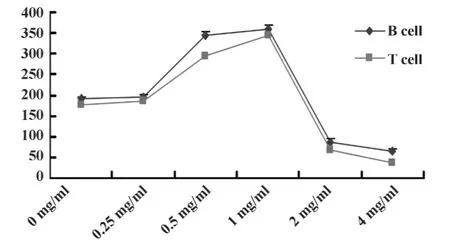
图2 不同浓度黄芩苷对淋巴细胞转化影响的结果(x ± s,n=5,个/μl)Fig.2 The lymphocyte transformation effect by different concentrations of baicalin(x ±s,n=5,/μl)

图3 熔解曲线Fig.3 Melted curve
2.3 黄芩苷对人T、B细胞TLR1-TLR10 mRNA表达的影响 图5显示了人T、B细胞经黄芩苷处理后TLR1-TLR10 mRNA表达量相对于基础表达量的比值。1 mg/ml黄芩苷能显著上调人T、B细胞表面TLR3、7、8、和9 mRNA 表达量(P <0.05),但是对其他TLRs mRNA表达无影响。
图4 扩增曲线Fig.4 Amplification curve

图5 黄芩苷对TLRs mRNA表达的调节Fig.5 The adjustment of the TLRs mRNA expression by baicalin
2.4 不同黄芩苷作用时间对人T、B细胞TLR3、7、8和9 mRNA表达的影响 从图6和7中可以发现在黄芩苷作用下人T、B细胞TLR3、7、8和9 mRNA在12小时时表达已开始增加,除T细胞的TLR7 mRNA表达在48小时时略有下降外,其余表达基本一直持续增加,至48小时到达峰值。
2.5 抗TLR4单克隆抗体对黄芩苷作用人T、B细胞TLR3、7、8和9 mRNA表达的抑制 人T、B细胞在被黄芩苷作用前使用鼠抗人TLR4单克隆抗体封闭,会显著降低黄芩苷对TLR3、7、8和9 mRNA表
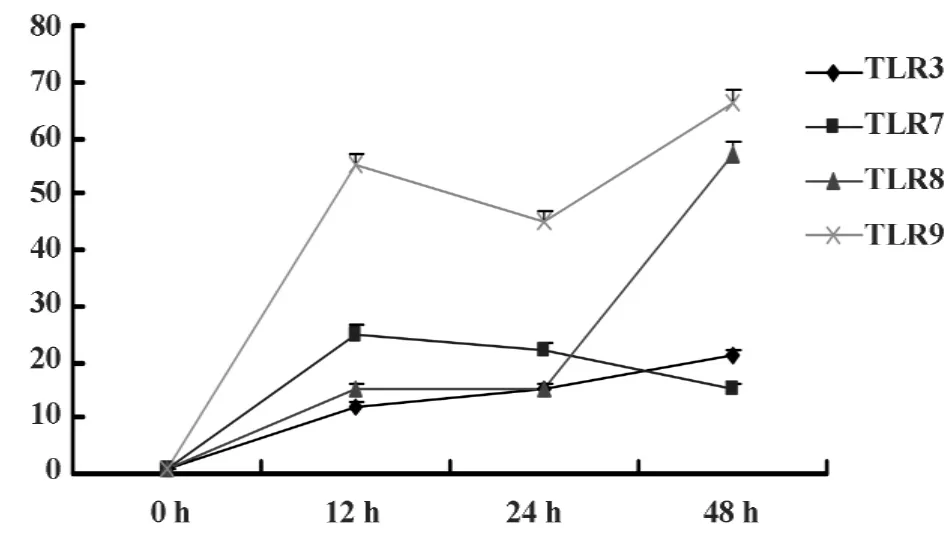
图6 不同黄芩苷作用时间对T细胞TLR3、7、8和9 mRNA表达的影响(n=3)Fig.6 The influence of T cell’s TLR3,7,8 and 9 mRNA expression by different baicilin effect time(n=3)

图7 不同黄芩苷作用时间对B细胞TLR3、7、8和9 mRNA表达的影响(n=3)Fig.7 The influence of B cell’s TLR3,7,8 and 9 mRNA expression by different baicilin effect time(n=3)
达的诱导作用(P<0.05),如图8和9所示。
3 讨论
TLRs家族主要分布于免疫细胞以及同外界相通的腔道上皮细胞表面,在巨噬细胞和树突状细胞等专职抗原提呈细胞表面的表达尤其丰富。TLRs对于外源性配体和内源性配体的识别作用无论在固有免疫和获得性免疫中都起关键作用。在系统性红斑(SLE)的病人中,TLR7和TLR9在活化自身反应性B细胞中扮演重要角色,活化的B细胞再通过分泌自身抗体、活化自身反应性T细胞和分泌细胞因子来加速SLE疾病进程,在这个包括B细胞、T细胞、树突状细胞和可溶性介质组成的正反馈网络中,TLRs发挥着主要作用[2]。
本研究揭示了黄芩苷能诱导人T、B细胞上调TLR3、7、8和9 mRNA的表达,并且这种上调可以部分被鼠抗人TLR4单克隆抗体抑制,提示黄芩苷可以通过调节TLRs的表达影响天然免疫。

图8 T细胞在抗体封闭前后差异(*.P<0.05,n=5)Fig.8 The difference of T cell before and after withantibody closed(* .P <0.05,n=5)

图9 B细胞在抗体封闭前后差异(*.P<0.05,n=5)Fig.9 The difference of B cell before and after with antibody closed(* .P <0.05,n=5)
TLR3、TLR7、TLR8和TLR9识别的病原体相关的分子位点(PAMPS)是病毒和细菌的核酸,TLR3识别在大多数病毒感染过程中产生的双链RNA,TLR9识别细菌DNA所特有的非甲基化DNA二核苷酸—CPG,TLR7和TLR8可以识别单链RNA,并且TLR7和TLR8还可以识别小分子干扰RNA(siRNA)。通过给卵清蛋白致敏的小鼠注射 TLR2、TLR3、TLR4、TLR7和TLR9增强剂,发现激活TLR7和TLR9后能有效降低气道过敏反应,尤其是激活TLR7的作用更加显著[3]。TLR信号传导能调节人类骨髓细胞的发育,人类骨髓CD34+祖细胞可以持续表达功能性的TLR8和TLR9,TLR8和TLR9的配体能诱导白细胞生成,而不产生任何外源性的细胞因子[4]。在正常情况下,对TLR刺激会引起免疫系统各种细胞的活化,能引起和增强保护性的Th1型免疫应答,然而在某些易感基因的遗传背景下,TLR的刺激可以诱导自身免疫病,在对系统性红斑狼疮模型小鼠的研究中发现,TLR9缺失会导致自身抗体从抗核抗体向TLR7依赖的抗核糖体抗体IgG2a和IgG2b转变,加快了疾病进程和致死性,因此TLR的信号传导不仅能诱导自身免疫,而且能调节耐受[5]。
同样在对患狼疮的小鼠研究中,发现TLR9的缺失会加重病情,而 TLR-7的缺失却会改善病情[6]。这些结果给了我们在自身免疫病中可采用TLR直接治疗的重要提示。通过对TLR7主链上腺嘌呤的置换,可以诱导产生调节性细胞因子,使变应原特异性Th2细胞向Th1/Th0型转换,合适的修改就可以作为治疗变态反应性疾病的免疫疗法的有效佐剂[7]。TLR9的胞内定位对于它的自身-非自身的DNA识别非常重要,但是其机制还不清楚,我们发现TLR9的跨膜区指向CD25,也是一种Ⅰ型跨膜蛋白,其胞内隔间包含TLR9,我们还发现TLR9是和TLR3共定位的,虽然不是通过TLR3的跨膜区,而是TLR3的胞内定位区,这些数据表明TLR9的跨膜区是重要的调节因素,直接指向TLR9的胞内定位[8]。有研究已证实 TLR2、TLR4、TLR9 可能与类风湿关节炎(RA)的发病有关[9]。TLR3、TLR4配体和TLR7、TLR8配体对某些细胞因子如IFN的基因表达有协同刺激作用[10]。
由此推测黄芩苷同时对 TLR3、TLR7、TLR8和TLR9 mRNA表达的上调有可能提高人的抗病毒、抗感染的能力,亦可能对于自身免疫病及变态反应存在一定作用。不过值得注意的是,黄芩苷的上调幅度比较大,需要控制好剂量,避免易感性增加所带来的不利影响。
在抗原依赖或非依赖应答中,T细胞表达的TLRs对于保存和活化长寿命记忆T细胞有一定作用[11],近期有证据表明TLR信号对于影响未致敏T细胞向Th1或Th2型应答转化非常重要,同时也直接或间接的影响调节性T细胞的功能[12],调节性T细胞在维持外周耐受、限制过度免疫应答对组织的损伤和肿瘤的免疫治疗等多方面发挥作用,B细胞的增殖、分化和抗体的类别转化都和TLRs存在联系[13],有研究表明在慢性丙肝患者的治疗中可以发现TLR2、TLR4和 TLR9表达的增加[14]。黄芩苷对人T、B细胞TLRs表达的调节可以证实其间接参与抗炎、抗肿瘤和免疫调节等作用。
黄芩苷是一种黄酮类的糖缀物,我们的研究结果表明它同灵芝多糖一样可以通过TLR4发挥调节作用[15],从受体抑制实验的结果分析,TLR4抑制后黄芩苷诱导的TLR3、7、8和9 mRNA的上调幅度下降50%左右,证明TLR4是黄芩苷的主要作用位点。
综上,黄芩苷不仅仅是单纯调节T、B细胞TLRs mRNA的表达变化,而是通过对TLKs表达的调节间接参与抗炎、抗肿瘤和免疫调节作用,在固有免疫和引导适应性免疫中扮演着重要的角色,更详细的机制我们将继续深入研究。
1 熊 英,傅颖媛,况南珍et al.黄芩苷抗白念珠菌作用及机制研究[J].中国药理学通报,2004;20(12):1404-1407.
2 Christensen Sean R,Shlomchik Mark J.Regulation of lupus-related autoantibody production and clinical disease by Toll-like receptors[J].Semin Immunol,2007;19(1):11-23.
3 Duechs Matthias J,Hahn Christian,Benediktus Ewald et al.TLR agonist mediated suppression of allergic responses is associated with increased innate inflammation in the airways[J].Pulmonary Pharmacology,2011;24(2):203-214.
4 Sioud Mouldy,Floisand Yngvar, Forfang Lise et al. Signaling through Toll-like receptor 7/8 induces the differentiation of human bone marrow CD34+progenitor cells along the myeloid lineage[J].Molecular Biology,2006;364(5):945-954.
5 Ehlers Marc,Ravetch Jeffrey V.Opposing effects of Toll-like receptor stimulation induce autoimmunity or tolerance[J].Trends in Immunology,2007;28(2):74-79.
6 Christensen Sean R,Shupe Jonathan,Nickerson Kevin et al.Tolllike receptor 7 and TLR9 dictate autoantibody specificity and have opposing inflammatory and regulatory roles in a murine model of lupus[J].Immunity,2006;25(3):417-428.
7 Fili Lucia,Ferri Simona,Guarna Francesco et al.Redirection of allergen-specific TH2 responses by a modified adenine through Toll-like receptor 7 interaction and IL-12/IFN release[J].Allergy and Clinical Immunology,2006;118(2):511-517.
8 Kajita Emi,Nishiya Tadashi,Miwa Soichi.The transmembrane domain directs TLR9 to intracellular compartments that contain TLR3[J].Biochemical and Biophysical Research Communications,2006; 343(2):578-584.
9 涂丽娜,傅颖媛,龚淑琪.瑞香素对CIA鼠TLR2、TLR4、TLR9 mRNA 表达的影响[J].免疫学杂志,2010;28(10):63-65,76.
10 Sanna M M ,Pamela sterlund,Ilkka Julkunen et al.TLR ligands induce synergistic interferon-β and interferon-1 gene expression in human monocyte-derived dendritic cells[J].Molecular Immunology,2011;48(4):505-515.
11 Xu Damo,Komai-Koma Mousa,Liew Foo Y.Expression and function of Toll-like receptor on T cells[J].Cell Immunol,2005;233 (2):85-89.
12 DamoXu,HaiyingLiu,MousaKomai-Koma.Direct and indirect role of Toll-like receptors in T cell mediated immunity[J].Cellular &Molecular Immunology,2004;1(4):239-246.
13 Peng Stanford L.Signaling in B cells via Toll-like receptors[J].Current Opinion in Immunology,2005;17(3):230-236.
14 Hammond Talia,Lee Silvia,Watson Mark W et al.Toll-like receptor(TLR)expression on CD4+and CD8+T-cells in patients chronically infected with hepatitis C virus[J].Cellular Immunology,2010;264(2):150-155.
15 Shao Bao-Mei,Dai Hui,Xu Wen et al.Immune receptors for polysaccharides from Ganoderma lucidum[J].Biochemical and Biophysical Research Communications,2004;323(1):133-141.
[收稿2012-03-21 修回2012-05-08]
(编辑 张晓舟)
Regulation of baicalin on TLRs of the lymphocytes in human
SUN Wu,XIONG Ying,WANG Min,JIANG Qing-Long,GONG Shu-Qi,FU Ying-Yuan.The Immune Laboratory of Medical College of Nanchang University,Nanchang 330000,China
Objective:To study the effect of baicalin on TLRs of the lymphocyte and function of immune regulation.Methods1.After T and B lymphoytes were separated by nylon wool cotton column,we used UF-50 to test the optimum concentrations of baicalin to the proliferation of T,B lymphocytes.2.The different expression of TLRs mRNA before procession and after procession was analyzed by the real-time fluorescence quantitative polymerase chain reaction.3.The regulation point of baicalin for TLRs was studied by the receptor inhibition test using monoclonal antibodies rat against human TLR4 and the real-time fluorescence quantitative polymerase chain reaction.Results1.Baicalin could significantly promote the proliferation of T and B lymphocytes of human in vitro at the concentration of 1 mg/ml(P <0.05);2.The mRNA of TLR3,TLR7,TLR8 and TLR9 on the lymphocyte was up-regulate by 1 mg/ml baicalin in vitro(P <0.05),the increased fold was 21,15,57 and 66 respectively in T lymphocytes,the increased fold was 24,20,61 and 63 respectively in T lymphocytes;3.The expression of mRNA of TLR3,TLR7,TLR8 and TLR9 on the T,B lymphocytes began to increase at 12 h,and kept increasing,nearly reached peak levels at 48 h,except TLR7 mRNA of T lymphocytes decreased slightly at 48 h;4.When T and B lymphocytes was inhibited by using monoclonal antibodies rat against human TLR4 before treated by baicalin,the up-regulation of mRNA of TLR3,TLR7,TLR8 and TLR9 was significantly decreased(P < 0.05),which made the decrease rate was 47.6%,66.7%,50.9%,45.5%respectively in T lymphocytes and the decrease rate was 50.0%,45.0%,50.8%,50.8%respectively in B lymphocytes.Conclusion1.To confirm that baicalin could significantly promote the proliferation of T and B lymphocytes of human in vitro;2.To confirm that T and B lymphocytes constitutively expressed different quantity of mRNAs for TLR1-10,the expression of mRNA of TLR3,TLR7,TLR8 and TLR9 on the lymphocyte was significantly up-regulate by baicalin in vitro,but baicalin had no influence for other TLRs;3.To confirm that Baicalin may regulate innate immunity of human through TLR4.
Baicalin;T lymphocyte;B lymphocyte;TLR;RT-PCR
R363
A
1000-484X(2012)08-0706-06
10.3969/j.issn.1000-484X.2012.08.007
①本文为江西省自然科学基金资助项目(No.2007GZY0991)
②九江市第一人民医院检验科,九江 332000
孙 午(1974年-),男,医学硕士,副主任技师,主要从事抗感染免疫方面的研究,E-mail:sunwujj@163.com;
及指导教师:傅颖媛(1953年-),女,教授,主要从事免疫学方面的研究,E-mail:hqfyy@126.com。
·临床实验免疫学·

