免疫磁分离技术在电化学测菌法特异检测牙龈卟啉单胞菌中的应用
裴振华,施生根,牛忠英,史 亮,汤楚华
(解放军第306医院全军口腔疾病中心,北京100101)
菌斑微生物是引发牙周病的始动因子[1-2]。牙周患部优势菌的数量变化是评价牙周状况的重要指标,便捷、可靠的细菌检测信息不仅能辅助诊断牙周炎的活动性,还能提高牙周炎药物辅助治疗的针对性,对实现有效控制牙周病的发生、发展进而促进全身健康具有重要意义。
但目前牙周细菌检测仍未成为牙周常规检查的一部分,其原因主要是目前的细菌检测方法如:细菌培养不仅需要厌氧等特殊条件,并且检测周期长,过程较繁琐;分子生物学技术如聚合酶链反应虽灵敏度高、特异性强,但样本检测前后步骤较繁琐,且需特殊而昂贵的试剂和设备等,从而限制了它们的临床应用[3-4],使之不能满足椅旁诊断的需求。基于此,本课题组在前期研究中,利用细菌胞膜和胞内离子的带电性,提出了基于液体电极微流芯片和电化学阻抗谱方法的电化学测菌法,通过细菌样本的阻抗值推算出待检样品内细菌的浓度,检测迅速、所需设备简单,试剂需求量低,实验成本相对低廉,为牙周致病菌的快速量化提供了新的思路[5-6]。
目前电化学测菌法只是进行了实验室原理验证,尚未涉及特异性分析。针对一种检测方法,具备高度特异性是其能够真正用于疾病过程中细菌监测诊断的前提。考虑到液体电极无法实现抗体的固定修饰,而免疫磁分离技术则能够利用特异性抗体修饰的超顺磁颗粒,在外加磁场的作用下,特异性捕获分离并富集目的菌,与流式细胞术结合能实现特定细菌的量化[7]。因此,本研究旨在选择能够赋予流体特异性的免疫磁分离技术,以期实现电化学测菌法的细菌特异检测。
1 材料和方法
1.1 主要材料和仪器
牙龈卟啉单胞菌 ATCC33277、中间普氏菌ATCC25611(北京口腔医院研究提供);胰蛋白胨、大豆蛋白胨、酵母浸出物(Oxoid,英国);Trypticase soy broth培养基(BD,美国);细菌DNA提取试剂盒(O-mega,美国);引物设计和合成由北京赛百盛基因技术有限公司提供;蛋白A纳米磁珠(直径50 nm,Miltenyi Biotec,德国);牙龈卟啉单胞菌ATCC33277牙龈素K抗血清(北京口腔医院牙周科张凤秋惠赠);阻抗分析仪(Agilent Technologies Inc,美国); Anoxomat MarkⅡ厌氧培养系统(Mart,荷兰)。
1.2 细菌培养
取牙龈卟啉单胞菌ATCC33277和中间普氏菌ATCC25611分别用含5%羊血的CDC固体培养基复苏,37℃厌氧培养(800 mL/L N2、100 mL/L CO2、100 mL/L H2)5 d。然后增菌 2 d,获得109cells/mL浓度的菌液,再用TS液体培养基10倍稀释,共获得109~103cells/mL系列不同浓度的菌液。
1.3 牙龈卟啉单胞菌的免疫磁分离
①取1 mL牙龈卟啉单胞菌牙龈素K抗血清稀释液与100 μL蛋白A纳米磁珠混合均匀,4℃孵育30 min,应用配套分选系统(美天旎公司)获得抗体包被的纳米磁珠,4℃保存备用;②取1 mL牙龈卟啉单胞菌悬液中加入50 μL抗体包被的纳米磁珠,混合均匀后室温孵育30 min,再用配套分选系统分离与抗体包被纳米磁珠结合的牙龈卟啉单胞菌,0.1 mol/L甘露醇洗两遍;③最后用去离子水洗脱收集与抗体包被纳米磁珠结合的牙龈卟啉单胞菌,室温平衡20 min待测。
1.4 牙龈卟啉单胞菌的阻抗测量
分别将不同初始浓度的牙龈卟啉单胞菌菌悬液和免疫磁分离后的免疫磁珠-细菌水溶液通入液体电极微流芯片,待细菌样本、氯化钾液体电极三层流动稳定后,设定频率为1.2千赫,记录阻抗分析仪的阻抗数据。芯片制作以及电阻抗测量设备和方法同前期研究[5-6]。
1.5 杂菌对牙龈卟啉单胞菌免疫磁分离的影响
以中间普氏菌ATCC25611作为杂菌,将其与牙龈卟啉单胞菌溶液混合后,调整两菌终末浓度分别为2.13×108cells/mL(牙龈卟啉单胞菌)和1.96×108cells/mL(中间普氏菌),然后用牙龈卟啉单胞菌牙龈素K抗血清包被纳米磁珠进行细菌免疫磁分离,获得与抗体包被纳米磁珠结合的细菌溶液,按1.4的方法分别对单一牙龈卟啉单胞菌免疫磁珠-细菌溶液和混合菌免疫磁珠-细菌溶液进行电阻抗测量。同时,采用PCR进一步验证免疫磁分离的特异性。具体步骤如下:
按DNA提取试剂盒说明,提取免疫磁珠捕获分离的细菌模板DNA,并根据两种菌的16S rRNA设计并合成引物,引物序列分别为:P.gingivalis上游引物5’-CTG GCT CAG GAT GAA CGC GTA-3’,下游引物5’-TCG CCC GTT ATT CCC-3’;P.intermedia上游引物 5’-TTT GTT GGG GAG TAA AGC GGG-3’,下游引物5’-TCA ACA TCT CTG TAT CCT GCG T-3’。
PCR扩增反应体系为:1 μL DNA模板,1 μL引物(10 μmol/L),1.6 μL dNTPs(2.5 mmol/L),2.0 μL 10×PCR缓冲液,0.2 μL TaqDNA聚合酶(5 U/μL),14.2 μL去离子水。PCR扩增循环参数:95℃预变性5 min,95℃变性30 s,55℃复性1 min,72℃延伸40 s,35个循环,72℃终延伸8 min。10 g/L琼脂糖凝胶电泳检测。牙龈卟啉单胞菌ATCC33277为阳性对照,以不加任何模板的体系为空白对照,稳压120 V,凝胶成像仪采图。
1.6 不同抗体浓度以及不同免疫反应时间、温度、pH对细菌电阻抗测量的影响
P.gingivalis浓度选择2.13×108cells/mL。将牙龈素K抗血清用pH 7.2的0.1 mol/L PBS稀释成不同浓度(1∶5、1∶10、1∶20、1∶100),免疫反应时间选择10、20、30、40、50、60 min),免疫反应温度选择25~40℃,免疫反应pH值选择6.0~9.0,按上述方法进行免疫磁分离和电阻抗值测量,以去离子水作对照,并按以下公式计算电阻抗值的相对变化(Normalized impedance change,NIC)。
NIC =(Zsample- Zcontrol)/Zcontrol× 100
1.7 统计学分析
用SPSS 17.0统计软件进行统计分析,组间比较用秩和检验,检验水准α=0.05。
2 结果
2.1 免疫磁分离前后牙龈卟啉单胞菌的电化学阻抗谱
将免疫磁分离前、后的牙龈卟啉单胞菌液进行阻抗测量,结果显示两者的电化学阻抗谱型一致,免疫磁分离后的细菌溶液阻抗值虽有所增加,但与分离前相比差异无统计学意义(P>0.05)(图1)。
2.2 杂菌对牙龈卟啉单胞菌免疫磁分离的影响
对牙龈卟啉单胞菌和中间普氏菌混合菌液免疫磁分离后的样本进行阻抗测量,结果显示与单一牙龈卟啉单胞菌磁分离后相比,阻抗值未见明显改变(P>0.05)(图2a)。分别用两种细菌的特异性引物对混合菌液免疫磁分离后的样本进行PCR扩增,结果显示牙龈卟啉单胞菌阳性(图2b)。
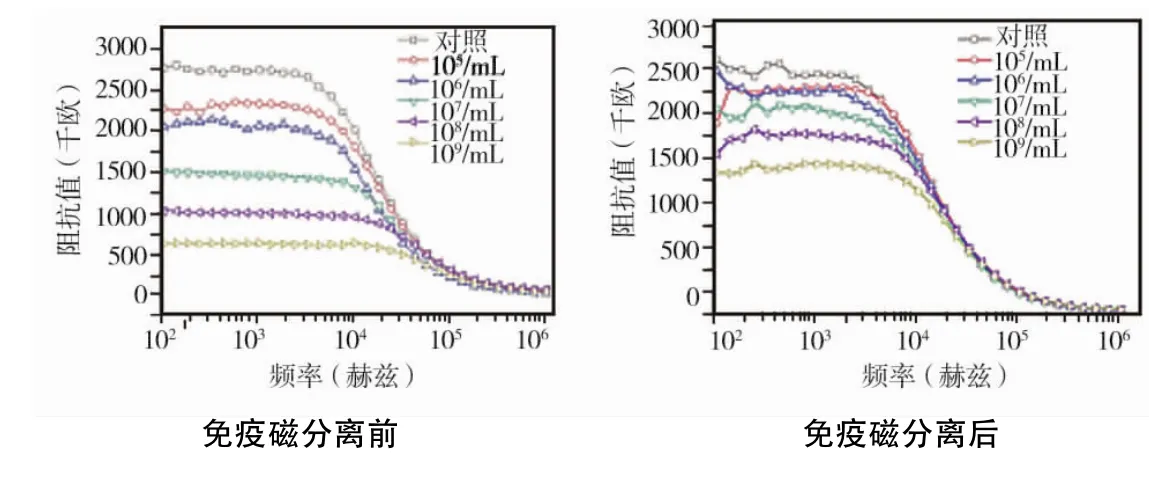
图1 免疫磁分离前后牙龈卟啉单胞菌的电化学阻抗谱
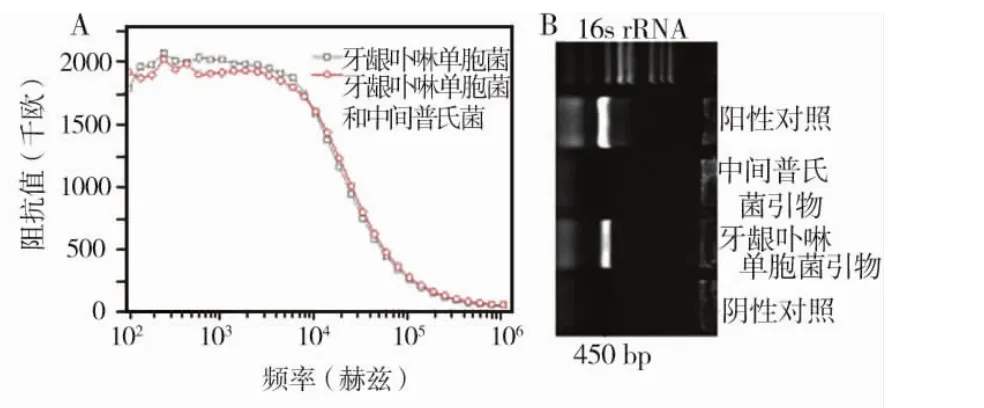
图2 杂菌对牙龈卟啉单胞菌免疫磁分离的影响结果
2.3 抗体浓度对牙龈卟啉单胞菌电阻抗测量的影响
设定在pH 7.2环境中,抗原抗体室温反应30 min,不同抗体浓度免疫磁分离后的细菌电阻抗测量结果显示,当抗血清稀释1∶10时,系统电阻抗值相对变化值最大,与其他浓度相比,差异均有统计学意义(P<0.05)(图3)。
2.4 不同免疫反应时间下牙龈卟啉单胞菌的电阻抗改变
设定在pH 7.2环境中,抗血清1∶10稀释,室温下免疫反应不同时间,免疫磁分离后的细菌电阻抗测量结果显示:当免疫反应10 min时,即可观察到系统阻抗有变化,30 min时系统相对阻抗变化值达到最大,与10、20 min相比差异有统计学意义(P<0.05);延长免疫反应时间,系统阻抗变化未见增加,各时间点之间差异无统计学意义(P>0.05)(图4)。
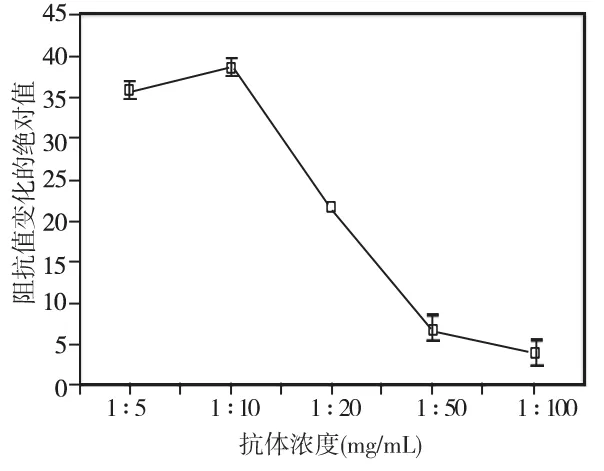
图3 不同抗体浓度下牙龈卟啉单胞菌的电阻抗的改变(n=3)

图4 不同免疫反应时间下牙龈卟啉单胞菌的电阻抗改变(n=3)
2.5 不同免疫反应温度下牙龈卟啉单胞菌的电阻抗改变
设定在pH 7.2环境中,抗血清1∶10稀释,不同环境温度下抗原抗体反应30 min,免疫磁分离后的细菌电阻抗测量结果显示:环境温度在25~37℃范围内,系统阻抗虽有变化但较平稳,各温度间差异无统计学意义(P>0.05);超过37℃后,系统阻抗出现下降,且随着温度升高,下降越来越大,37~40℃各温度之间差异均有统计学意义(P<0.05)(图5)。

图5 不同免疫反应温度下牙龈卟啉单胞菌的电阻抗改变(n=3)
2.6 环境pH对牙龈卟啉单胞菌电阻抗测量的影响
设定不同环境pH,抗血清1∶10稀释,室温下抗原抗体反应30 min,免疫磁分离后的细菌电阻抗测量结果显示,pH<7.0时,系统阻抗值随pH增加而增加;pH值>7.5时,系统阻抗值则随pH值增加而下降,各组间差异均有统计学意义(P<0.05)(图6)。
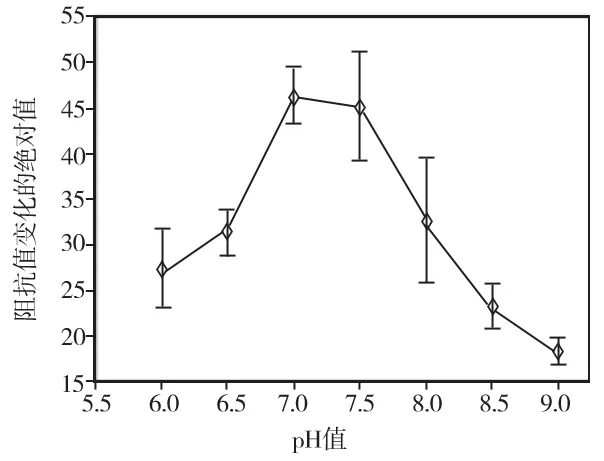
图6 pH对牙龈卟啉单胞菌电阻抗测量的影响(n=3)
3 讨论
免疫磁分离技术是通过特异性抗体修饰超顺磁珠或者磁颗粒,利用抗体抗原反应,在外加磁场的作用下,凝集分离靶细胞或生物活性物质,实现对特定病原菌特异性捕获分离与富集的新技术。国内外已有学者利用免疫磁分离技术成功进行细胞或细菌的分离和定量检测[8-9]。
本研究应用免疫磁分离技术赋予电化学测菌法特异性,结果显示免疫磁分离前、后的系统电化学阻抗谱型一致,且免疫磁分离前、后阻抗变化无统计学差异,表明磁颗粒本身不会对阻抗测量系统产生明显干扰。另外,对掺杂杂菌的混合菌液进行磁分离后阻抗测量,结果显示阻抗谱与磁分离后牙龈卟啉单胞菌纯菌液基本一致,阻抗值无明显差异;PCR特异性扩增进一步表明实验用免疫磁分离技术具有良好的特异性。但与初始菌液相比,免疫磁分离后的阻抗值有所增加,表明样本导电性减小,样本中细菌浓度降低,推测是由于磁分离过程中只有部分细菌被捕获所致。该结果会导致最低检测限升高,不易区分细菌初始浓度较低的不同样本,降低电化学测菌法的检测性能,需进一步优化抗体捕获效率而加以改善。
由于抗体浓度、反应时间等是公认影响抗原抗体结合的重要因素,因此本研究中观察了不同免疫因素对细菌电阻抗测量的影响。结果显示当牙龈卟啉单胞菌抗血清稀释10倍时,系统阻抗变化值最大,表明抗原抗体比例比较合适,因此,我们认为检测用最适抗体浓度为抗体原液的10倍稀释液。反应时间的观察结果显示当抗原抗体结合30 min时,系统相对阻抗变化值达到最大,进一步延长反应时间,系统阻抗变化值未出现明显改变,表明在30 min时抗原抗体结合基本达到稳定,因此,我们认为检测用免疫反应时间为30 min。
另外,环境温度和pH值同样可以显著影响抗原抗体的结合。本研究在设定抗体浓度和反应时间的基础上,观察不同环境温度时系统相对阻抗值变化,结果显示当免疫反应温度在25~37℃范围内,系统阻抗变化较明显,但此温度范围内阻抗无明显增加或者减少,进一步升高温度,系统阻抗变化反而减少,因此,为便于操作,我们认为检测用免疫反应温度以室温为好。
本研究pH值范围的设定参照文献数据,如健康龈沟中的pH值接近中性,为6.90,而牙周病变部位pH值常升高,有的部位可高达8.66[10]。实验结果显示pH值在7.0~7.5之间时,可获得较好的抗原抗体结合,这一结果也为临床实际样本检测时的样本处理方法提供了实验参考。
通过上述实验结果,可以证实免疫磁分离技术能够与电化学测菌法整合,实现牙龈卟啉单胞菌的特异性检测,但细菌捕获率影响免疫磁分离结果,进而影响电化学测菌法的实用价值,如何提高免疫磁分离效率,降低最低检测限仍是进一步需要解决的重要问题。
[1] 曹采方.临床牙周病学[M].北京:北京大学医学出版,2006:44,59.
[2] Sugano N.Biological plaque control:novel therapeutic approach to periodontal disease[J].J Oral Sci,2012,54(1):1-5.
[3] Suchett-Kaye G,Morrier JJ,Barsotti O.Clinical usefulness of microbiological diagnostic tools in the management of periodontal disease[J].Res Microbiol,2001,152(7):631-639.
[4] Shaddox LM,Walker C.Microbial testing in periodontics:value,limitations and future directions[J].Periodontol,2000,2009,50(1):25-38.
[5] Zhu T,Pei ZH,Huang JY,et al.Detection of bacterial cells by impedance spectra via fluidic electrodes in microfluidic device[J].Lab Chip,2011,21(5):249-252.
[6] 裴振华,朱涛,施生根,等.应用电化学测菌法检测牙龈卟啉单胞菌的初步研究[J].牙体牙髓牙周病学杂志,2011,21(5):249-252.
[7] Hibi K,Abe A,Ohashi E,et al.Combination of immunomagnetic separation with flow cytometry for detection of Listeria monocytogenes[J].Anal Chim Acta,2006,28(573-574): 158-163.
[8] Varshney M,Li Y.Interdigitated array microelectrode based impedance biosensor coupled with magnetic nanoparticle-antibody conjugates for detection of Escherichia coli O157:H7 in food samples[J].Biosens Bioelectron,2007,11(22):2408-2414.
[9] 解宇.特定细菌的磁性凝集分离法[J].微生物学报,2004,44(1):119-121.
[10] 周村,章锦才.牙周微生态研究进展[J].中国微生态学杂志,1998,10(4):236-238.

