Lumican蛋白多糖在正常SD大鼠牙胚发育中时间和空间的表达
汪 凤,黄瑞哲,田剑刚,曹峻岭
(1.西安交通大学口腔医院预防科,陕西西安710004; 2.乌鲁木齐口腔医院儿童牙病科,新疆乌鲁木齐830000; 3.西安交通大学医学院地方病研究所、教育部环境与疾病相关基因重点实验室,陕西西安710061)
Lumican蛋白聚糖是富含亮氨酸的细胞外蛋白多糖中的一种,这类蛋白多糖与胚胎发育,组织修复和肿瘤生长过程中的细胞迁移和增殖有关,并参与组织活动的调节,国内外学者对它的研究多集中在口腔医学以外的领域[1-2],在牙齿发育方面未见报道。
Lumican蛋白多糖是一种小的、富含亮氨酸的细胞外基质蛋白多糖,能粘结TGF-β[3],可以控制细胞的生长、粘附和移行;并能粘附生长因子到细胞外基质,从而调节生长因子的活性[4]。牙胚发育的形态发生和细胞分化是上皮细胞和间充质相互作用的结果,其调控的途径主要有3条:细胞与细胞的直接接触;细胞外基质分子及其受体的相互作用;生长因子等可弥散信号分子的相互作用[5]。从分子水平看,这种相互作用包括着多种信号分子、受体、细胞内的转导途径以及相关基因的转录、表达,形成既相互协同又相互拮抗的网络调节机制,共同完成牙胚的生长发育[6]。TGF-β作为上皮-间充质细胞的信号调控分子,对牙胚发育有重要作用[7-8],本研究利用动物实验和免疫组化手段对Lumican蛋白多糖在牙胚中的分布状况进行观察,以期初步揭示Lumican蛋白多糖在牙胚发育过程中的作用。
1 材料和方法
1.1 主要材料和仪器
80 d龄雌性SD大鼠、90 d龄雄性SD大鼠(西安交通大学医学院实验动物中心);兔抗大鼠lumican蛋白多糖一抗(1-C-3)(西安交通大学医学院地方病研究所曹峻岭教授惠赠);即用型SABC (过氧化物酶)试剂盒、DAB显色试剂盒(博士德生物工程有限公司);旋转式生物组织切片机(YGQ-2,江苏);光学显微镜(OLYMPUS,日本)。
1.2 方法
1.2.1 标本采集和切片
取雌、雄SD大鼠各15只,在发情期间,以雌∶雄=1∶1的比例在晚8∶00时同笼。次日晨6∶00时取走雄鼠,用生理盐水充分浸湿的棉签采集各母鼠的阴道内容物并涂于载玻片,用光学显微镜在10×15倍下检查,发现精子者记为阳性(+),表明已受孕,并以当日中午定为胚胎发育的第0.5 d。然后分别取妊娠17.5 d(E17.5组)、妊娠19.5 d (E19.5组)的孕鼠,处死后取出胎鼠并分离出下颌骨;再取出生后1.5 d(P1.5组)、3.5 d(P3.5组)、5.5 d(P5.5组)的新生鼠并分离出下颌骨。分别从上述所有下颌骨中分离出双侧第一磨牙牙胚,置碘酸盐-赖氨酸-多聚甲醛固定液中固定后,脱水、石蜡包埋、5 μm切片,多聚赖氨酸包被的玻片捞片,60℃烤片2 h贴片。
1.2.2 HE染色
上述切片常规HE染色,光学显微镜观察,确定SD大鼠牙胚发育时期。
1.2.3 SABC法免疫组化染色
切片脱蜡至水(依次浸入二甲苯Ⅰ、Ⅱ、Ⅲ各10 min;梯度乙醇 1 000、950、850、750 mL/L各2 min),蒸馏水洗;用新鲜配置的30 mL/L的过氧化氢液中,室温30 min以封闭内源性过氧化物酶;蒸馏水洗3次,每次5 min;热抗原修复,即将切片浸泡于0.01 mol/L的枸橼酸缓冲液中,电炉上加热直至沸腾,断电,静置10 min,再加热至沸腾,室温冷却,0.02 mol/L的 PBS洗5 min,3次;滴加50 g/L BSA封闭液60 μL封闭,置湿盒内,室温孵育40 min,甩去多余液体,不洗;滴加1∶100比例稀释的一抗60 μL,在湿盒内4℃过夜孵育;从4℃冰箱中取出湿盒,在37℃恒温箱内复温1 h后取出切片,用0.02 mol/L的PBS洗5 min,3次;滴加生物素化山羊抗兔IgG(二抗)60 μL,湿盒内37℃孵育1 h后,0.02 mol/L的PBS洗5 min,3次;滴加即用型SABC,室温孵育40 min,0.02 mol/L的PBS洗5 min,4次;去离子蒸馏水1 mL加DAB试剂盒中A、B、C试剂各1滴混匀,每张切片滴加60 μL,显色3~10 min,显微镜下控制反应时间,蒸馏水洗;Harris苏木素轻度复染胞核;脱水透明中性树胶封片;镜下观察并照相。染色中同时设阴性对照片,滴加PBS代替一抗。
结果判定标准:①阴性表达(-):组织内无淡黄色或棕黄色颗粒,苏木素复染后呈蓝色;②弱阳性表达(±):淡黄色,或阳性着色低于该组织结构的10%;③阳性表达(+):淡黄色或棕黄色颗粒占该组织结构的10%~60%,染色清晰;④强阳性表达(++):淡黄色或棕黄色颗粒占该组织结构的60%以上,染色强。
1.2.4 图像分析
打开Image-Pro Plus 6.0图像分析软件,插入待分析图片。定义灰度值大的白色为光密度值= 0,灰度值最小的黑色光密度值为无穷大,进行光密度值较正;分别测量累积光密度IOD(Integrated option density)和有效目标分布区域的面积area,以IOD/area计算平均光密度(Mean density),取同一实验组切片各照片的平均值。
1.2.5 统计学处理
2 结果
2.1 大鼠牙胚发育过程中Lumican蛋白的时、空表达
2.1.1 E17.5牙胚
第一磨牙牙胚处于帽状期(增殖期),分为成釉器、牙乳头和牙囊3个部分。成釉器分化为3层:外釉上皮层、内釉上皮层和星网状层,牙板与外釉上皮层相连。此时内釉上皮、牙乳头、牙囊呈棕黄色,颜色深度与阳性对照相似;外釉上皮、牙板棕黄色略浅,星网状层染色深度与背景色相似(图1a)。
2.1.2 E19.5牙胚
第一磨牙牙胚处于钟状早期,成釉器由3层分化为4层,出现了中间层细胞,位于内釉上皮层和星网状层之间,内釉上皮为单层细胞排列,在牙尖部呈高柱状而在牙颈部颈环处呈矮柱状。镜下可见外釉上皮层、内釉上皮、牙囊、牙乳头黄染,颜色深度与阳性对照类似,颈环处黄染颜色明显加深,而牙板上皮棕黄色较浅,星网状层中染色深度与背景色相似(图1b)。
2.1.3 PN1.5牙胚
第一磨牙牙胚处于钟状期(组织分化和形态分化期),牙胚部位的成釉细胞已开始分泌少量釉基质蛋白。牙乳头靠近内釉上皮的一层分化出现成牙本质细胞,呈单层排列,并也已开始分泌少量基质。此时成釉细胞黄染,颜色与阳性对照类似;成牙本质细胞黄染略浅;而星网状层、牙髓细胞中染色深度与背景色相似(图2a)。
2.1.4 PN5.5牙胚
第一磨牙牙胚处于钟状末期,已分泌较多釉基质蛋白。此时成釉细胞、成牙本质细胞黄染程度基本与阳性对照片中的背景色相似,星网状层、外釉上皮、牙髓细胞中染色深度与背景色相似(图2b)。
2.1.5 PN9.5牙胚
此时第一磨牙牙胚釉基质蛋白分泌基本结束,但尚未矿化,牙冠基本形成,牙根开始发育。成釉细胞和成牙本质细胞中的染色程度基本与阳性对照片中的背景色相似,牙髓细胞中染色深度与背景色相似(图2c)。
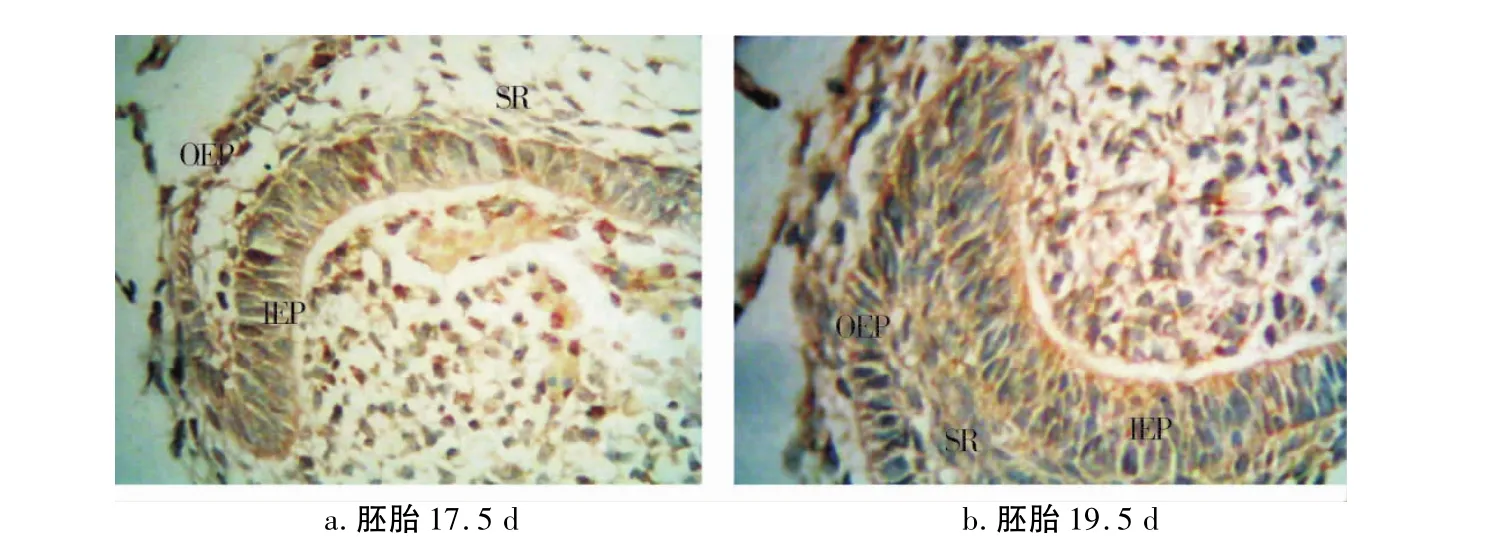
图1 胚胎牙胚Lumican蛋白多糖的表达(400×)
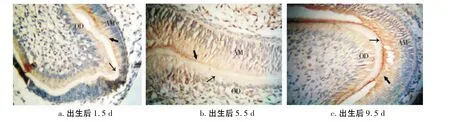
图2 出生后成釉细胞和成牙本质细胞中Lumican蛋白多糖的表达(400×)
根据以上观察,将各发育时期牙胚中不同细胞的Lumican蛋白多糖表达情况归纳于表1。
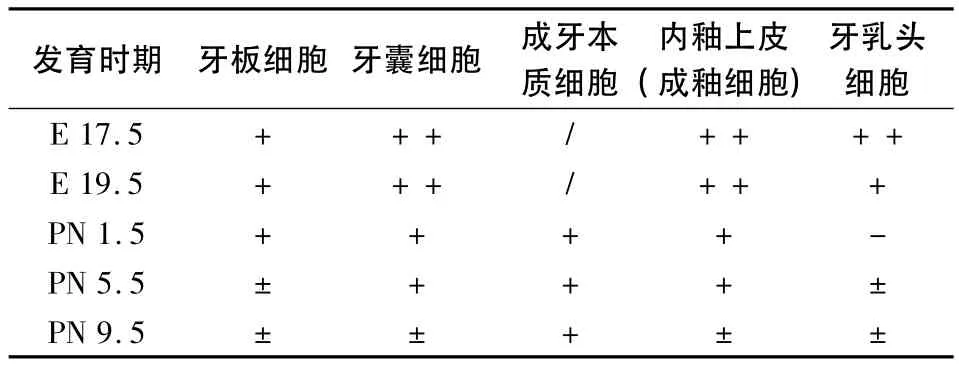
表1 各发育时期牙胚中不同细胞Lumican蛋白多糖表达情况
2.2 图像分析结果
单因素方差分析显示:总体存在显著性差异(P<0.05),因此可以认为5组Lumican蛋白多糖表达不全相同。进一步组间两两比较发现,各组间差异均有统计学意义(P<0.05)(表2)。
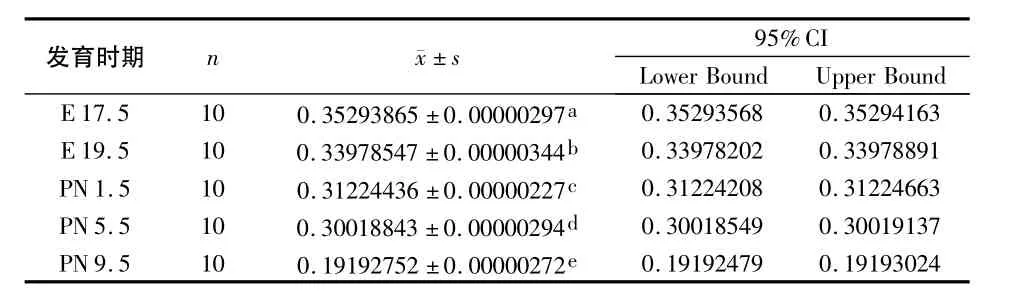
表2 Lumican蛋白多糖在各组中表达的光密度值分析结果
3 讨论
牙胚发育过程中,各类细胞的生长、增殖、分化、凋亡均受到细胞外信号分子的诱导和多种基因的调控。目前研究认为:牙胚的发育是上皮-间充质相互诱导、相互作用的结果[9]。转化生长因子β (transformation growth factors,TGF-β)家族是其中主要的信号分子[10],研究表明:这种细胞因子与细胞膜受体结合后,在细胞内通过信号转导分子将信号传导至核内,调节相应的基因表达,促进细胞的分化和各种功能的正常进行[11]。Lumican蛋白多糖是一种小的、富含亮氨酸的细胞外基质蛋白多糖,Lumican蛋白多糖能粘结TGF-β,并通过控制释放到细胞外基质中TGF-β的数量来调节TGF-β的活性。Lumican蛋白多糖可以控制细胞生长、粘附和移行,并能粘附生长因子到细胞外基质,从而调节生长因子的活性。
在牙胚发育过程中,内釉上皮产生的信号分子作用于牙乳头细胞,这些信号分子受上皮-间充质细胞共同调控。TGF-β在上皮-间充质细胞相互作用起信号分子作用,参与调控牙胚发育和细胞分化,而Lumican蛋白多糖可以调节TGF-β的活性,因而推断Lumican蛋白多糖在发育中呈一定的时空分布可能与调控TGF-β的活性有关,在牙胚正常的发育中起到重要的作用。
在本研究中,E17.5组胎鼠牙胚处于帽状期,此时成釉器上皮向外胚间充质中生长,体积增大,基底部向内凹陷,成釉器分化为3层,并形成牙囊包绕成釉器与牙乳头。免疫组化染色结果显示,此时Lumican蛋白多糖主要分布于牙板、成釉器的外釉上皮、内釉上皮、牙囊、牙乳头细胞,而星网状层细胞中则为阴性表达;E19.5组胎鼠牙胚处于钟状早期,内釉上皮细胞处于向成釉细胞分化的阶段,细胞增殖分化功能活跃,此时外釉上皮层、内釉上皮、牙囊细胞、牙乳头细胞的Lumican蛋白多糖表达呈阳性,而牙板上皮细胞中的表达减弱;PN1.5组牙胚的成釉细胞开始分泌釉基质蛋白,分泌功能旺盛,此时成釉细胞中的Lumican蛋白多糖表达呈阳性,同时牙乳头中分化出的成牙本质细胞的胞浆中也有表达。随着釉基质分泌的结束,成釉细胞分泌功能减退,形态有所变化,开始进入釉基质矿化期,此时可以观察到PN9.5组中Lumican蛋白多糖在成釉器和牙本质细胞中呈弱阳性表达,上述阳性表达区主要分布在细胞周围的基质中。
本研究中还观察到自出生0.5 d起,在牙齿发育的整个过程中,Lumican蛋白多糖在成釉器、牙囊中持续表达,提示Lumican蛋白多糖参与成釉器的分化和成熟。牙齿发育过程中,成牙本质细胞和牙髓细胞都由起源于外胚层间充质的牙乳头细胞分化而来,二者因为在胚胎发生和功能上相互关系密切,因此又称为牙本质-牙髓复合体。成牙本质细胞和牙髓细胞都有丰富的合成胶原的能力,而Lumican蛋白多糖在牙乳头细胞中一直是阳性表达,提示Lumican蛋白多糖也与胶原基质(即前期牙本质)的形成有关。
Lumican蛋白多糖在发育中的必须作用,目前尚不明确,有研究表明:Lumican蛋白多糖可以结合TGF-β,而TGF-β与牙胚发育有关,从而提示Lumican蛋白多糖在大鼠牙胚的发育过程中的作用,可能与介导TGF-β等生长因子有关。Lumican蛋白多糖作为一种重要的细胞外基质蛋白,与机体多种器官的发育密切相关。本研究观察Lumican蛋白多糖在牙胚的发育过程中的时空表达,表明其在牙胚的发育中主要起着调节和介导作用,而Lumican蛋白多糖在牙胚发育过程中更详细的机制还有待于进一步实验证明。
[1] Baba H,Ishiwata T,Takashi E,et al.Expression and localization of lumican in the ischemic and reperfused rat heart[J].Jpn Circ,2001,65:445-450.
[2] Afshin R,Bernhard G,Chris M,et al.Lumican is a major proteoglycan component of the bone matrix[J].Matrix Biol,2005,(14):361-367.
[3] Hildebrand A,Romaris M,Rasmussen LM,et al.Interaction of the samll interstitial proteoglycans biglycan,decorin and fibromodulin with transforming growth factor β[J].Biochem,1994,302(Pt 2):527-534.
[4] James L,Martha L,Mary M,et al.Proteoglycan expression during transforming growth factor β-induced keratocyte-myofibroblast transdifferentiation[J].Biol Chem,2001,276(47): 44173-44178.
[5] Cobourne MT,Miletich I,Sharpe PT.Restriction of sonic hedgehog signalling during early tooth development[J].Development,2004,131:2875-2885.
[6] 钱虹,樊明文.富含亮氨酸的间质蛋白多糖及其在牙和牙周组织中作用的研究[J].国外医学口腔医学分册,2004,31 (3):107-109.
[7] Heikinheimo K.Transforming growth factor beta 2 in epithelial differentiation of developing teeth and odongenic tumors[J].ClinInvest,1993,91(3):1019-1027.
[8] 苏凌云,吴补领,史俊南.TGF-β1、TGF-β2、TGF-β3蛋白在人牙胚表达的免疫组化研究[J].牙体牙髓牙周病学杂志,2000,10(6):307-309.
[9] Heikinheimo K.Stage-specific expression of decapenta-plegicvg-relatedgenes2,4,and 6(bonemorpho-genetic proteins2,4,and6)during human tooth morpho genesis[J].Dent Res,1994,73(3):590-591.
[10] Kawabata M,Miyazono K.Signal transduction of the TGF-bata super family by smad proteins[J].J Bio Chem,2001,125 (1):9.
[11] Vincze C,Pal G,Wappler EA,et al.Distribution of mRNAs encoding transforming growth factors-beta 1,-2,and-3 in the intact rat brain and after experimentally induced focal ischemia[J].Comp Neurol,2010,518:3752-3770.

