舒芬太尼预先给药对脑缺血再灌注损伤大鼠海马CA1区形态学和脑组织总钙的影响
王美芳,魏 华,孟尽海,王淑静
(1宁夏医科大学,银川750004;2唐山市人民医院;3宁夏医科大学总医院)
舒芬太尼是芬太尼N-4位取代的衍生物,是一种新型特异性μ阿片受体激动剂[1],本实验通过观察舒芬太尼预先给药后光镜和电镜下海马CA1区形态学以及脑组织总钙含量的变化,观察舒芬太尼预先给药对脑的影响。
1 材料与方法
1.1 动物及分组 雄性SD大鼠70只,体质量280~320 g(宁夏医科大学动物实验中心提供),随机分为5组,每组14只:假手术组(S组)既不烧灼双侧椎动脉,也不夹闭双侧颈总动脉;缺血再灌注组(I/ R组):烧灼双侧椎动脉,缺血前模拟Schultz等[2]预处理的方式泵入生理盐水,即持续输注5 min,暂停5 min,重复3次(容积1 mL/5 min,预先给药过程30 min),然后夹闭双侧颈总动脉15 min,再灌注24 h;舒芬太尼不同剂量预先给药组(L组、M组、H组):烧灼双侧椎动脉,缺血前以I/R组同样的方式分别泵入舒芬太尼0.5、1.5和4.5 μg/kg,然后夹闭双侧颈总动脉15 min,再灌注24 h。所有大鼠术前均禁食12 h,自由饮水。
1.2 全脑缺血再灌注损伤模型
1.2.1 模型的制备 采用大鼠四动脉阻断法(pulsinelli-4vo法)[3]:SD大鼠3%水合氯醛(300 mg/kg)腹腔注射麻醉后,俯卧位固定于手术台上,于颈后正中1、2颈椎处切一长约1.5 cm切口,分离颈部肌肉暴露第1颈椎双侧翼小孔,用灼热的大头针烧灼闭塞双侧椎动脉,缝合伤口。改为仰卧位,备皮,消毒表面皮肤,颈前正中切口,分离双侧颈总动脉并挂线,缝合伤口,正常喂养。24 h后清醒状态下将大鼠装入鼠盒,行尾静脉穿刺并留置静脉套管针。给予肝素(50 IU/kg)抗凝,并接微量泵以备输入生理盐水和舒芬太尼。30 min预先给药后将大鼠仰卧位固定,颈前正中行0.25%的布比卡因局部浸润麻醉,剪开缝线,提出挂线,暴露双侧颈总动脉,用微型动脉夹同时夹闭双侧颈总动脉,造成全脑缺血,15 min后松开动脉夹,恢复脑血流灌注,缝合伤口。归笼正常喂养。
1.2.2 造模成功的标准 造模鼠于缺血开始后30~60 s内意识丧失,翻正反射消失,嚼金属反射消失,自主呼吸存在,眼球变白,松开动脉夹后1~2 min以上症状消失,造模成功。
1.3 观察指标 再灌注24 h后。每组随机取6只大鼠3%水合氯醛(450 mg/kg)腹腔注射麻醉后,4%多聚甲醛行心内前灌注,断头取脑,将左侧大脑放入中性4%多聚甲醛行后固定。每组随机选取2只右侧海马经固定、漂洗等步骤醋酸铀染色—柠檬酸铅染色电镜下观察海马CA1区变化,其余8只同样麻醉下断头处死,取左侧大脑,吸水纸吸干表面水分和血液,放入冷冻管,-80℃冷冻保存,样本收齐后一并测脑组织总钙含量。①中性4%多聚甲醛后固定24 h的标本,依次经过脱水、透明、浸蜡、包埋等包成蜡块。再经组织切片、捞片、HE染色后光镜下观察海马CA1区形态学变化,参照Kitagawa等[4]提供的方法确定海马CA1区的组织学分级(HG)。按以下标准分为4级:0级:无神经元死亡;Ⅰ级:散在的神经元死亡;Ⅱ级:大量的神经元死亡;Ⅲ级:几乎全部的神经元死亡。②2只右侧的海马组织经过固定、漂洗、四氧化锇后固定、脱水、浸透等步骤后,再经醋酸铀—柠檬酸铅染色,电镜下观察。③取左侧脑组织,电子天平称重后,加入硝酸与高氯酸(容积比4∶1)的混合酸4 mL将组织消解过夜,60~120℃梯度温度排酸,去离子水定容至7 mL。采用湿法消解法用电感耦合等离子体发射光谱仪测脑组织总钙含量[5]。
1.4 统计学方法 采用SPSS11.5统计分析软件,计量资料采用±s表示,组间比较采用单因素方差分析。病理学分级(HG)采用Kruskal-Wallis秩检验分析,Mann-Whitney U检验作两两比较。以 P≤0.05为差异有统计学意义。
2 结果
2.1 海马CA1区形态学变化 S组:细胞形态结构完整,胞核无固缩,无淋巴细胞浸润;I/R组:核固缩严重,神经细胞变性坏死多见,有少量淋巴细胞浸润;L组:核固缩和神经细胞变性坏死较I/R组少见,有少量淋巴细胞浸润;M组:无明显的核固缩,神经细胞变性坏死较I/R组少见,可见淋巴细胞浸润;H组:核固缩较I/R组少见,可见淋巴细胞浸润,神经细胞有水肿。舒芬太尼预先给药各组核固缩和神经细胞变性坏死M组最少见。见插页Ⅰ图5。
2.2 海马CA1区病理学分级 见表1。
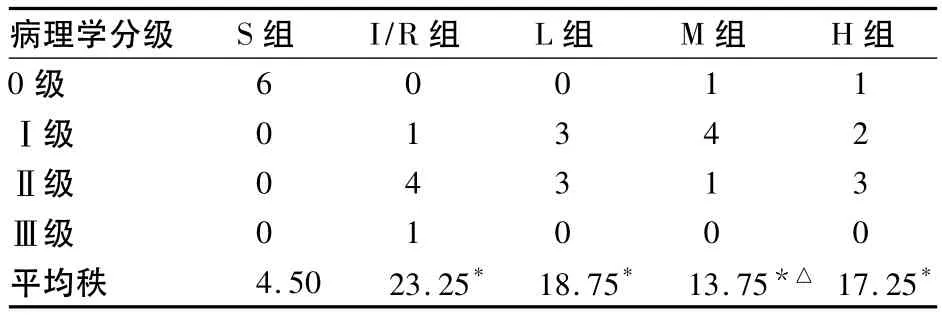
表1 5组大鼠再灌注24 h后海马CA1区病理学分级比较(n=6)
2.3 海马CA1区电镜结果 S组:核膜规整,核仁均匀;粗面内质网无肿胀,无脱颗粒;突触前、后膜,突触间隙清晰;I/R组:核膜不规整,严重内陷,核固缩,核仁不均匀;粗面内质网扩张,数目减少,脱颗粒严重,出现大量溶酶体;突触前、后膜不清晰,多数有融合,突触间隙模糊不清;L组:核膜欠规整,内陷不严重,轻度核固缩;粗面内质网轻度扩张,个别正常,轻度脱颗粒,未见溶酶体;突触前、后膜尚清晰,突触间隙大致正常,少数有融合,突触小泡增多;M组:核膜较规整,无明显的内陷,偶见核固缩;粗面内质网轻度扩张,数目增多,大多正常;偶见溶酶体;突触前、后膜清晰,突触间隙大致正常,未见有融合,突触小泡增多不明显;H组:核膜较完整,内陷不明显,轻度核固缩;粗面内质网轻度扩张,轻度脱颗粒;偶见溶酶体;突触前、后膜尚清晰,突触间隙大致正常,少数有融合,突触小泡增多不明显。见插页Ⅰ图6。2.4 脑组织总钙含量 S、I/R、L、M及H组总钙含量(μg/g湿重)分别为63.00±13.25、111.83± 10.81、96.79±15.40、76.00±13.31、82.89± 10.39。与S组比较,I/R组和舒芬太尼不同剂量预先给药组总钙含量均明显升高(P<0.05);与I/R组比较,舒芬太尼预先给药组钙总量均明显降低(P<0.05);不同剂量预先给药组之间比较,M组和H组明显低于L组(P<0.05);M组和H组无统计学意义(P>0.05)。舒芬太尼预先给药可以减少脑组织总钙含量,以1.5和4.5 μg/kg显著。
3 讨论
舒芬太尼是一种强效镇痛药,药理研究认为[6]其ED50是0.2 μg/鼠,大鼠甩尾法测得静注舒芬太尼的镇痛ED50为0.71 μg/kg,当给予10 mg/kg后产生紧张症、翻正反射消失、耳廓反射和角膜反射阻滞,并呈剂量依赖性(1.25~5.00 mg/kg)出现震颤、阵挛性发作、呼吸困难等。本实验在预先给予舒芬太尼的过程中所有实验鼠均未出现呼吸困难等缺氧表现。
pulsinelli-4vo法所致的全脑缺血主要发生在海马、纹状体和大脑皮层等[3],因此本实验选取海马CA1区进行形态学观察及病理组织学分级(HG)。变性坏死、核固缩是细胞损伤的标志,淋巴细胞浸润是抗损伤的表现。本实验缺血再灌注组海马CA1区核固缩严重,神经细胞变性坏死多见,病理学分级以Ⅱ级为主(66.7%),电镜下细胞核膜内陷、粗面内质网脱颗粒严重,突触间隙模糊甚至融合,说明缺血再灌注可以导致海马CA1区的损伤。有研究[7]认为pulsinelli-4vo法所致的全脑缺血再灌注损伤从再灌注的24 h开始,呈时间依赖性,72 h达高峰,与本实验中观察再灌注24 h的病理学分级以Ⅱ级为主一致。舒芬太尼预先给药各组光镜下核固缩严重程度和神经细胞变性坏死均较缺血再灌注组减轻,电镜下核膜较完整,粗面内质网脱颗粒现象较轻,突触间隙大致正常。尤其M组CA1区的病理学以Ⅰ级为主,损伤的程度最轻。表明1.5 μg/kg舒芬太尼预先给药能够有效减轻缺血再灌注所致的组织形态学变化。
脑缺血再灌注损伤的机制目前尚不清楚,但钙超载是近几年研究的热点[8~11],其发生机制主要表现在:脑缺血再灌注后能量缺乏,导致Na+-Ca2+-ATP酶失活,细胞膜去极化,导致大量的Glu释放,NMDA受体激活,Ca2+大量内流。细胞内Ca2+大量蓄积可以通过以下途径损伤细胞:① Ca2+激活Ca2+依赖性蛋白,使细胞内无害的黄嘌呤脱氢酶转变为黄嘌呤氧化酶,诱导细胞死亡;②Ca2+通过激活蛋白酶NOS产生自由基,损伤线粒体,激活钙激活的中性蛋白酶破坏细胞骨架;③Ca2+活化磷脂酶C和磷脂酶A2等Ca2+依赖性磷脂酶促进膜磷脂分解,并且在膜磷脂分解过程中产生大量的细胞毒性物质。
本实验通过测定脑组织总钙来间接反映细胞内钙。缺血再灌注组的脑组织总钙含量明显高于假手术组,结合两组海马CA1区形态学的变化,表明脑组织总钙含量与脑损伤的程度有关。不同剂量舒芬太尼预先给药组脑组织总钙含量明显低于缺血再灌注组,说明舒芬太尼预先给药能够有效地减轻脑组织总钙含量,从而减轻脑损伤,本实验结果表明1.5 μg/kg较为显著。马锐等[7]的研究认为,舒芬太尼3 μg/kg腹腔预适应可以使局灶性脑缺血再灌注大鼠的神经功能障碍症状得到明显改善,脑梗死面积减小,具有脑保护作用,与本试验结果相似。关于舒芬太尼的脑保护作用机制尚不清楚,有研究认为阿片类药物通过抑制FADD蛋白,促进抗凋亡。抗凋亡可能是舒芬太尼预先给药脑保护机制之一[12,13]。
[1]Hocker J,Weber B,Tonner PH,et al.Meperidine,remifentanil and tramadol but not sufentanil interact with alpha(2)-adrenoceptors in alpha(2A)-,alpha(2B)-,alpha(2C)-adrenoceptor knock out mice brain[J].Eur J Pharmacol,2008,58(2):70-77.
[2]Schultz JE,Hsu AK,Gross GJ.Morphine mimics the cardioprotective effect of ischemic preconditioning via a glibenclamide-sensitive mechanism in the rat heart[J].Circ Res,1996,78(6): 1100-1104.
[3]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10(3): 267-272.
[4]Kitagawa K,MatsumotoM,Tagaya M,et al.Ischemic tolerance’phenomenon found in the brain[J].Brain Res,1990,5(28):212-224.
[5]宋娟娥,于水.电感耦合等离子质谱法在临床样品分析中的应用[J].质谱学报,2006,27(3):182-192.
[6]Monk JP,Beresford R,Ward A,et al.Sufentanil.A review of its pharmaeological propertics and therapeutic use[J].Drugs,1988,36(3):286-313.
[7]马锐,路志红,熊利泽,等.舒芬太尼预先给药对大鼠急性局灶性脑缺血-再灌注损伤的保护作用[J].临床麻醉学杂志,2009,25 (11):978-979.
[8]Dugan LL,Sensi SL,Canzoniero CMT,et al.Mitochondrial production of reactive oxygen species in cortical neurons following exposure to N-methyl-D-Aspartate[J].Neurochem,1995,15(10): 6377-6388.
[9]王琳,朱庆磊.脑缺血耐受机制及药物预处理研究进展[J].卒中与神经疾病,2008,15(4):246-248.
[10]Li XM,Yang JM,Hu DH,et al.Contribution of downregulation of L-type calcium currents to delayed neuronal death in rat hippocampus after global cerebral ischemia and reperfusion[J].J Neurosci,2007,27(19):5249-5259.
[12]刘启锋,刘明.脑缺血再灌注损伤机制研究进展[J].中华神经外科疾病研究杂志,2006,5(6):566-568.
[13]García-Fuster MJ,Miralles A,García-Sevilla JA.Effects of opiate drugs on Fas-associated protein with death domain(FADD)and effector caspases in the rat brain:regulation by the ERK1/2 MAP kinase pathway[J].Neuropsychopharmacology,2007,32(2): 399-411.

