胃癌腹膜转移中survivin的表达及意义
殷 舞,韦海明,莫祥兰,钟晓刚
(广西壮族自治区人民医院,南宁530021)
进展期胃癌根治术后易发生腹膜转移,最终导致癌性腹水、肠道梗阻、恶病质,成为胃癌死亡的主要原因。对于胃癌腹膜转移,尤其是腹膜亚临床转移的早期预测与及时阻断是当前胃癌治疗领域的研究热点[1],而关于胃癌腹膜种植转移的机制尚无定论,多数学者倾向于“种子—土壤”学说。但是,正常上皮细胞和不具备转移特性的实体瘤细胞进入体腔后会因失去基质的支持而发生失巢凋亡[2]。然而,发生转移的胃癌“种子”从瘤体上脱落后并不发生凋亡,而是迁徙到腹膜继续生长。因此,可推断这些发生腹膜转移的癌细胞具有独特的抗凋亡能力。survivin基因是凋亡抑制因子(IAP)家族中的主要成员,一直受到研究者的关注。文献报道survivin蛋白表达可发生在胃腺体恶性转化的早期和进展期[3],而关于survivin在胃癌腹膜转移中作用的研究在国内外仍较少,本课题对此进行初步研究。
1 资料与方法
1.1 临床资料 48例进展期胃癌组织均来自2008年1月~2010年12月广西壮族自治区人民医院外科手术标本,其中伴腹膜转移胃癌标本24例。随机选取同期进展期胃癌根治标本24例作为对照组。年龄30~84岁、平均55岁,其中男36例、女12例。胃癌伴腹膜转移组24例中22例接受外科手术切除,术后病理均存在淋巴结和腹膜转移;2例仅腹腔镜腹膜活检,淋巴结状态无法评估。全部标本均经10%甲醛固定,普通石蜡包埋,5 μm连续切片。
1.2 survivin蛋白检测方法 采用免疫组化SP法染色,操作步骤按说明书进行,DAB显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。用已知染色阳性的结肠癌组织切片作为阳性对照,用PBS代替一抗作为阴性对照。结果判定:癌细胞胞质内浅/棕黄色颗粒为survivin阳性信号,计分采用染色强度和阳性细胞百分率相结合的半定量分析的判断标准[3]:a.染色强度:0分为阴性,1分为淡黄色,2分为棕黄色,3分为棕褐色;b.阳性细胞的百分率:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。a和b的乘积作为表达强度的总分:0分为(-),1~4分为(+),5~8分为(++),9~12分为(+++)。
1.3 统计学方法 实验数据采用SPSS13.0统计软件分析处理,列联表资料采用χ2检验,多个相关样本等级资料表达差异采用等级资料的秩和检验(Kruskal-WalliS H),以P≤0.05为差异有统计学意义。
2 结果
2.1 无腹膜转移组胃癌原发灶、淋巴转移灶survivin的表达 原发灶与淋巴转移灶间survivin表达强度有差异,P=0.044。见表1。

表1 无腹膜转移组胃癌原发灶、淋巴转移灶survivin的表达[例(%)]
2.2 腹膜转移组胃癌原发灶、淋巴转移灶、腹膜转移灶survivin的表达 原发灶与淋巴转移灶比较组间survivin表达强度有差异,P=0.001;原发灶与腹膜转移灶比较组间survivin表达强度有差异,P= 0.000;腹膜转移灶与淋巴转移灶比较组间survivin表达强度也有差异,P=0.035。见表2。

表2 腹膜转移组胃癌原发灶、淋巴转移灶、腹膜转移灶survivin的表达[例(%)]
2.3 腹膜转移组与无腹膜转移组survivin的表达比较 腹膜转移组与无腹膜转移组胃癌原发灶比较survivin表达强度无差异,P=0.312;淋巴转移灶比较survivin表达强度也无差异,P=0.423;腹膜转移灶中survivin表达强度高于无腹膜转移组的原发灶及淋巴转移灶,P=0.000及0.013。见表3。
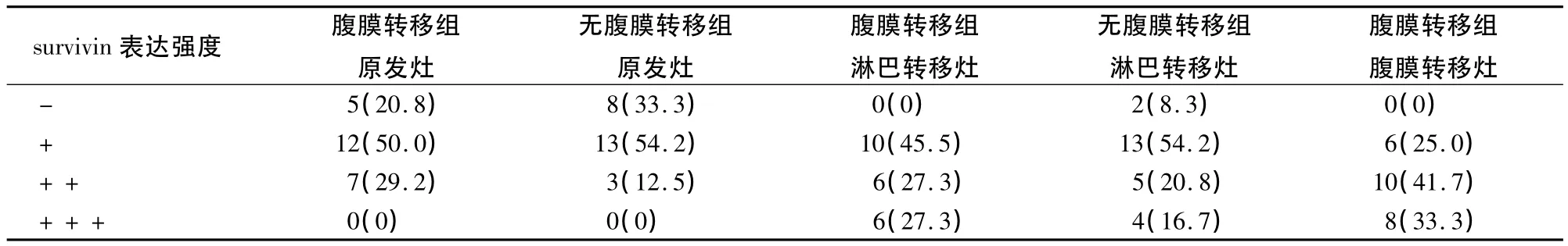
表3 腹膜转移组与无腹膜转移组survivin的表达比较[例(%)]
3 讨论
随着标准胃癌根治手术和围手术期辅助放化疗的开展,胃癌总体预后有一定程度的改善,然而进展期胃癌术后5年生存率仍仅有30%~40%。腹膜转移在进展期胃癌发生率高,成为影响其预后的主要因素,针对胃癌腹膜转移的机制研究一直是研究的焦点之一。随着胃癌分子生物学研究的不断深入,针对肿瘤浸润、血管生成以及生物性癌变机制等靶点提出的分子靶向治疗成为胃癌综合治疗的重点和热点[4]。预测进展期胃癌的分子标志物候选者众多,但迄今国内外的基础研究尚未找到有效的早期预测进展期胃癌腹膜转移的分子标志物,尚缺乏干预的关键分子靶点。近年的研究认为,胃癌腹膜转移是一个多阶段、序贯的复杂过程。Tanaka等[5]证实,胃癌的腹膜转移与血行转移和淋巴转移机理不同,众多研究对细胞黏附、血管生成等进行探讨,但失巢凋亡机制在其中的作用尚缺乏深入研究。
失巢凋亡是由于与细胞外基质和其他细胞失去接触而诱导的一种程序化细胞死亡形式。survivin作为迄今发现的最强的凋亡抑制因子之一,与IAP家族其他成员一样,其对凋亡的抑制作用较明确,也参与失巢凋亡过程[6]。survivin是caspase抑制剂,同时也通过调节细胞周期、细胞分离和信号传导抑制细胞死亡。survivin在分化成熟的正常组织中很少表达,而在肿瘤组织中过表达,且与肿瘤进展相关,预示更差的预后。Yao等[7]用免疫组化技术检测survivn在胃腺癌中的表达,结果显示胃癌原发灶、淋巴结转移灶及正常腺体基底生发层细胞的survivn阳性率分别为49.17%、64.00%和17.50%,survivin的表达与肿瘤病理分型、分化程度及淋巴结转移有关,其在胃癌组织中的表达呈一渐进的过程。李平等[8]研究显示,胃癌组织中survivin阳性率为53.85%,且临床分期越晚其表达越高,在伴有淋巴结转移的胃癌组织中survivin阳性率显著高于无淋巴结转移的病例。
本研究发现伴腹膜转移的进展期胃癌组织中,淋巴转移灶与原发灶之间survivin表达有差异,随着肿瘤进展胃癌出现腹膜转移,腹膜转移灶中survivin表达强度逐渐增高,明显高于淋巴转移灶中的表达强度,表明survivin在胃癌腹膜转移过程中发挥特殊作用。在伴或不伴腹膜转移的两组胃癌病例中,其原发灶间及淋巴转移灶间survivin表达强度均无差异,但在腹膜转移灶中其表达强度却明显高于两组的原发灶和淋巴转移灶。上述结果表明腹膜转移灶中survivin表达增强可能在于高表达survivin的亚群癌细胞更易发生转移,或转移的肿瘤细胞在转移部位因为survivin表达上调抑制失巢凋亡而得以存活,成为腹膜转移灶。survivin在腹膜转移灶中高强度表达预示其可能在胃癌腹膜转移中发挥特殊的作用。有研究表明诱导survivin表达升高,可调节生理性或病理性的血管形成,与依赖于新生血管形成的肿瘤细胞生长、浸润、转移密切相关[9,10]。Wang等[11]以survivin为靶基因,以RT-PCR方法检测腹膜冲洗液的癌细胞来确定有无腹膜转移,结果显示在所有良性肿瘤的腹膜冲洗液中均未检测到survivin的mRNA,但在48例胃癌并淋巴结转移的病例中有28例检测到survivin的表达,其表达与癌的浸润深度、淋巴结转移和TNM分期相关,在92%的腹膜转移病例中检测到survivin的表达。因此survivin相关通路在胃癌腹膜转移中可能发挥特殊作用,与本研究结论相似。
恶性肿瘤在增殖演进过程中不断变异,造成该肿瘤内瘤细胞亚群表型的多样性,即所谓异质性。与胃癌腹膜转移直接相关的是癌细胞的转移潜能,具有高转移潜能的癌细胞容易发生转移。survivin基因在肿瘤细胞内广泛而特异的表达,为肿瘤的基因治疗提供新的靶向物[12],而本研究进一步表明,survivin在胃癌腹膜转移中也起关键作用,针对这一分子靶点设计治疗,可望有效控制胃癌腹膜转移,改善患者预后。但对于survivin在胃癌腹膜转移灶中高表达的机制,以及如何有效阻断相关分子通路干预腹膜转移的发生和进展,有待深入研究。
[1]Jiang CG,Xu Y,Wang ZN,et al.Clinicopathological analysis and prognostic significance of peritoneal cytology in Chinese patients with advanced gastric cancer[J].ANZ J Surg,2011,81(9):608-613.
[2]Frisch SM,Francis H.Disruption of epithelial cell-matrix interactions induces apoptosis[J].J Cell Biol,1994,124(4):619-626.
[3]Da CL,Xin Y,Zhao J,et al.Significance and relationship between Yes-associated protein and survivin expression in gastric carcinoma and precancerous lesions[J].World J Gastroenterol,2009,15 (32):4055-4061.
[4]Bornschein J,Rokkas T,Selgrad M,et al.Gastric cancer:clinical aspects,epidemiology and molecular background[J].Helicobacter,2011,16(1):45-52.
[5]Tanaka T,Kumagai K,Shimizu K,et al.Peritoneal metastasis in gastric cancer with particular reference to lymphatic advancement; extranodal invasion is a significant risk factor for peritoneal metastasis[J].J Surg Oncol,2000,75(3):165-171.
[6]Marconi A,Dallaglio K,Lotti R,et al.Survivin identifies keratinocyte stem cells and is downregulated by anti-beta1 integrin during anoikis[J].Stem Cells,2007,25(1):149-155.
[7]Yao XQ,Liu FK,Qi XP,et al.Expression of survivin in human gastric adenocarcinomas:correlation with proliferation and apoptosis[J].Zhonghua Wai Ke Za Zhi,2004,42(3):145-148.
[8]李平,李兆中,王雅杰,等.凋亡抑制基因生存素在胃癌组织中的表达及意义[J].中华消化杂志,2003,23(11):662-664.
[9]Harfouche R,Hassessian HM,Guo Y,et al.Mechanisms which mediate the antapoptotic effects of angiopoietin-1 on endothelial cells[J].Microvasc Res,2002,64(1):135-147.
[10]Ohashi H,Takagi H,Oh H,et al.Phosphatidylinositol 3-kinase/ Akt regulates angiotensin II-induced inhibition of apoptosis in microvascular endothelial cells by coveming survivin expression and suppression of caspase-3 activing[J].Circ Res,2004,94(6): 785-793.
[11]Wang ZN,Xu HM,Jiang L,et al.Expression of survivin mRNA in peritoneal lavage fluid from patients with gastric carcinoma[J].Chin Med J,2004,117(8):1210-1217.
[12]Wenying Z,Zhaoning J,Zhimin Y,et al.Survivin siRNA inhibits gastric cancer in nude mice[J].Cell Biochem Biophys,2012,62 (2):337-341.

