慢性阻塞性肺疾病伴肺炎患者中血清IL-6、TNF-α、AAG检测价值比对研究
鲍舟君 王晔恺 李翊卫 姚燕珍 安明和 方国安
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),是以不完全可逆的气流受限为特征的疾病,气流受限通常呈进行性发展并与气道慢性非特异性炎症反应有关。COPD发病机制尚未完全明了,目前一致认为气道慢性非特异性炎症是COPD的主要病理基础,并且炎性细胞及其细胞因子在发病过程中起重要作用。本研究通过选取并检测了3种感染相关的炎性细胞因子:白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)、α1-酸性糖蛋白(α1-acidglycoprottin,AAG),以初步探讨其与COPD疾病进程及感染评估中的临床价值。
材料与方法
1.临床资料:随机选取2009年9月~2010年9月笔者医院呼吸内科和重症监护室患者共72例(43例伴肺炎、48例未伴肺炎),COPD诊断分级和肺炎诊断标准见文献,其中男性37例,女性35例,患者年龄46~80岁,平均年龄63.32± 16.55岁[1,2]。其包括单纯肺炎患者组16例,COPD缓解期伴肺炎组16例,COPD缓解期未伴肺炎组12例,COPD急性加重期(以下简称加重期)伴肺炎组11例,COPD急性加重期未伴肺炎组17例,另选择同期笔者医院进行健康体检者19例作为对照组,男性10例,女性9例,年龄39~71岁,平均年龄56.41±13.28岁,已排除其他部位炎性疾病和其他器质性疾病。6组人群性别分布与年龄经χ2或F检验显示无显著统计学意义,具有可比性(P>0.05)。
2.治疗方法:首先给予抗感染、合理氧疗、控制心力衰竭、处理并发症、加强营养支持。对COPD合并肺炎引发呼衰的部分患者在上述保守治疗失败的,选择清醒、能配合治疗、血流动力学稳定、不需气管插管保护气道的、无急性面部创伤的患者,行无创性正压通气。
3.细胞因子检测方法:患者治疗前和对照组均于清晨空腹静脉抽血2ml,2h内分离血清,-80℃冷冻保存。IL-6、 TNF-α检测采用酶联免疫吸附试验(ELISA),试剂盒购自上海晶美生物制品有限公司,操作严格按照说明书进行。AAG检测采用免疫散射速率比浊法测定,仪器为IMMAGE双光径免疫浊度分析仪,由美国Beckman-coulter公司提供原装试剂盒。
4.统计学方法:将COPD分期和肺炎作为控制变量,对各组细胞因子表达量作双因素协方差分析,IL-6、TNF-α、AAG对肺炎的诊断价值应用ROC曲线分析,曲线下面积(AUC)、敏感性、特异性、阳性预测值(PPV)、阴性预测值(NPV)、Youden index(YI)由计算得出,以P<0.05为具有显著统计学意义。
结果
1.各组细胞因子表达:双因素方差分析校正模型成立(F=4.03,P<0.05,表1),伴肺炎患者中,加重期和缓解期IL-6、加重期 TNF-α、加重期AAG均高于对照组,差异具有显著统计学意义(P<0.01),加重期HPT、加重期SAA高于其缓解组,差异具有显著统计学意义(P<0.05)。未伴肺炎患者中,加重期IL-6、TNF-α、AAG和缓解期IL-6、TNF-α均高于对照组,差异具有显著统计学意义(P<0.01),加重期IL-6、TNF-α、AAG高于缓解期,差异具有显著统计学意义(P<0.01)。伴肺炎患者中,除加重期AAG,其余均高于未伴肺炎患者中其相应的组别,差异具有显著统计学意义(P<0.01)。
2 IL-6、TNF-α、AAG对肺炎诊断价值:见表2、图1,对43例肺炎患者和48例未患肺炎患者中IL-6、TNF-α、AAG的诊断价值做ROC曲线分析。TNF-α诊断界值(cut-off值)为131.00ng/L时,预测肺炎的ROC曲线下面积(AUC,0.928)和IL-6一样,但其Youden指数(YI,0.821)最高。

表1 伴或未伴肺炎的COPD各分期细胞因子表达量
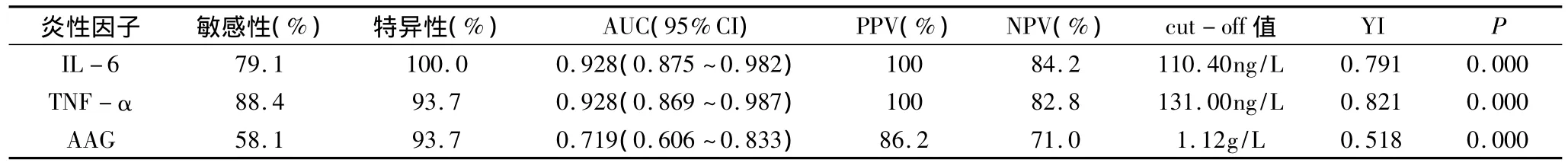
表2 IL-6、TNF-α、AAG对肺炎诊断价值的比较
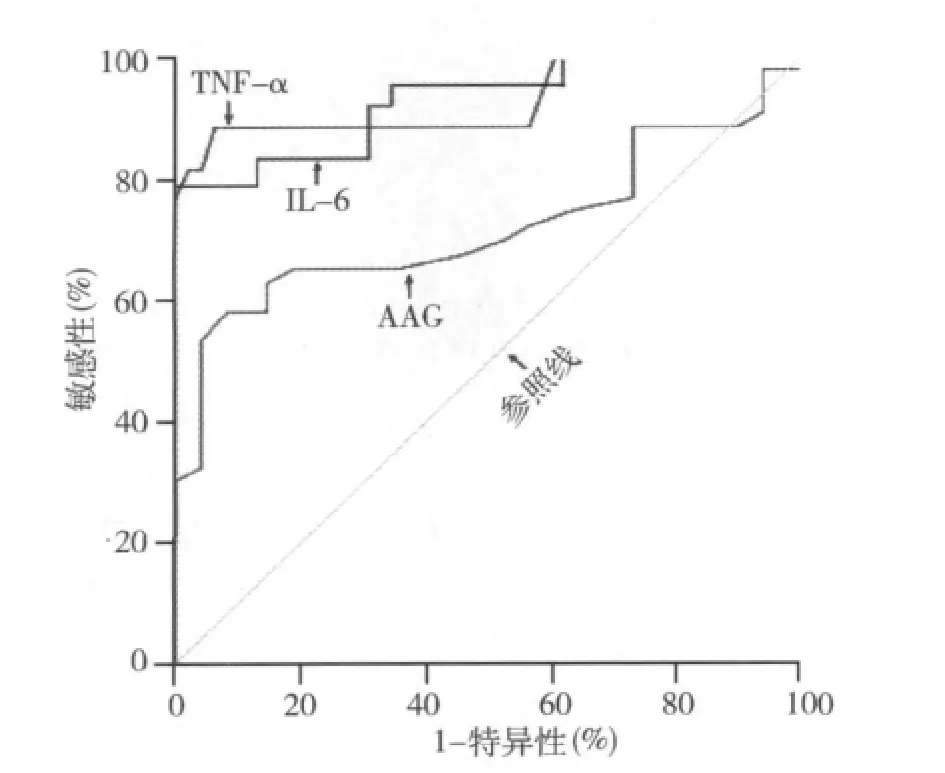
图1 IL-6、TNF-α、AAG对肺炎诊断的ROC曲线分析
讨论
COPD是一种以气流受限为特征的疾病,通常呈进行性发展,不完全可逆,多与肺部对有害颗粒物或有害气体的异常炎症反应有关。COPD行进中,在肺的不同部位有巨噬细胞、T淋巴细胞(尤其是CD8+)和中性粒细胞的增多。激活的炎性细胞释放多种介质,包括白三烯B4(LTB4)、IL-8、TNF-α和其他介质,这些介质能破坏肺的结构和(或)促进中性粒细胞炎症反应[3,4]。除炎症外,肺部的蛋白酶和抗蛋白酶失衡及氧化作用也在COPD发病中起重要作用[5]。20世纪80年代以前,有学者认为微生物感染是COPD的主要病因,但目前主流多倾向于是其次要病因。COPD伴感染尤其是儿童易引发肺功能的下降,并造成病情急性加重,而文献[1]提示肺炎链球菌和流感嗜血杆菌可能是COPD急性发作的主要病原菌[6]。由于多数COPD急性加重由细菌感染引发,因此抗感染治疗在COPD加重治疗中具有重要地位。本研究显示,未伴感染的COPD病程加重过程中,IL-6和TNF-α均存在显著增高,尤其以急性加重期尤为明显,说明IL-6、TNF-α参与COPD的疾病进展。
本研究还显示,COPD伴肺炎中IL-6和TNF-α中的增幅远高于COPD疾病进展的增幅,这可能是由于COPD伴肺炎中有感染引起的特异性急性炎症和COPD引起的非特异性炎症并存,且特异性急性炎症引起的炎性因子增高幅度远高于COPD本身的非特异性炎症所致[7]。ROC曲线显示:TNF-α的曲线下面积(AUC)(0.928,95%可信区间为0.869~0.987)和IL-6的 AUC(0.928,95%可信区间: 0.875~0.982)均高于AAG的AUC(0.719,95%可信区间:0.606~0.833),但TNF-α的Youden指数最高,说明TNF-α对肺炎的诊断效能高于IL-6和AAG。虽然本研究中TNF-α对肺炎的敏感性较高,但国外报道都显示TNF-α和COPD的疾病进程呈正相关,且机体其他部位感染中能广谱升高包括TNF-α在内的多种炎性因子[8]。因此,临床中使用TNF-α协助诊断COPD中的肺炎时需考虑COPD的疾病进程并排除其他部位的炎症影响,否则易造成干扰。
1 中华医学会呼吸病学会.慢性阻塞性肺疾病诊治指南[J].中华结核和呼吸杂志,2002,25(8):453-460
2 Mathew JL,Patwari AK,Gupta P,et al.Acute respiratory infection and pneumonia in India:a systematic review of literature for advocacy and action:UNICEF-PHFI series on newborn and child health,India[J].Indian Pediatr,2011,48(3):191-218
3 Snelgrove RJ,Jackson PL,Hardison MT,etal.A critical role for LTA4H in limiting chronic pulmonary neutrophilic inflammation[J].Science, 2010,330(6000):90-94
4 Sarir H,Mortaz E,JanseWT,et al.IL-8 production bymacrophages is synergistically enhanced when cigarette smoke is combined with TNF-alpha[J].Biochem Pharmacol,2010,79(5):698-705
5 Parameswaran GI,Wrona CT,Murphy TF,et al.Moraxella catarrhalis acquisition,airway inflammation and protease-antiprotease balance in chronic obstructive pulmonary disease[J].BMC Infect Dis,2009,9: 178
6 Sethi S.Molecular diagnosis of respiratory tract infection in acute exacerbations of chronic obstructive pulmonary disease[J].Clin Infect Dis, 2011,52(Suppl 4):S290-295
7 Kersul AL,Iglesias A,Ríos A,et al.Molecularmechanisms of inflammation during exacerbations of chronic obstructive pulmonary disease[J].Arch Bronconeumol,2011,47(4):176-183
8 Amer MS,Wahba HM,Ashmawi SS,etal.Proinflammatory cytokines in Egyptian elderly with chronic obstructive pulmonary disease[J].Lung India,2010,27(4):225-229