保护地土传病害枯萎病和疫霉病生防菌剂的田间试验
李意坚,闫淑珍,蒋利春,朱 慧,孙 莉,韩雪梅,黄科力,徐 坚,陆云明,陆宏伟,洪根泉
(1.张家港市农业试验站,江苏张家港215616;2.南京师范大学生命科学学院,江苏 南京210046;3.苏州市吴中区农林局,江苏苏州215128;4.江苏华昌化工股份有限公司,江苏张家港215634;5.苏州市甪直镇农林服务中心,江苏苏州215127)
传统保护地作物栽培中由于连作普遍存在,而连作使根系代谢产物不断积累,为真菌类病害提供了生长繁殖环境,使保护地农田中土传病害日益加剧。在保护地蔬菜栽培中土传病害的病原主要为镰刀菌(Fusarium)、疫霉菌(Phytophora)、腐霉菌(Pythium)和假单胞杆菌(Pseuodomonos)以及线虫(Nematodes)等,蔬菜被侵染致病表现的症状一般为疫病型、枯萎型和黄萎型,表现为植株凋萎或萎蔫,根和茎维管束阻塞、变褐[1]。其中镰刀菌引起的枯萎病和疫霉菌引起疫霉病就是保护地栽培的西瓜、甜瓜和辣椒等最常见的两种病害。在西瓜的保护地栽培中为避免连作病害发生,近年西瓜种植户开始年年易地重建大棚,土地损毁严重,人、财、物成本增加。为解决这一生产实际问题,为设施栽培的可持续发展提供技术支撑,江苏省张家港农业试验站与南京师范大学合作研究,从常年种植蔬菜和西瓜的保护地土壤中筛选和分离了大量的对枯萎病菌、疫霉病菌具有显著抑制效果的放线菌和植物内生细菌,研究了菌种的提纯和扩繁及复合制剂的制备方法,并在张家港市塘桥镇西瓜主产区连作大棚、锦丰镇南冈村千亩设施栽培蔬菜基地的辣椒连作地块、苏州甪直镇光辉蔬菜基地的甜瓜连作地进行了田间试验。
1 材料和方法
1.1 菌种来源
1.1.1 生防菌种 R-1、ME2、XG32和 DP24均为南京师范大学生命科学学院微生物实验室提供。R-1为泾阳链霉菌(Streptomyces jingyangensis),具有分泌植物生长素和拮抗黄瓜枯萎病菌的功能[2];ME2为小单孢菌(Micromonospora sp.)具有拮抗黄瓜枯萎病菌和辣椒疫霉病菌的功能[3];DP24为芽孢杆菌(Bacillus sp.)是植物内生细菌,具有促进生长和抑制辣椒疫霉的功能[4]。
1.1.2 病原菌 黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum)和辣椒疫霉病菌(Phytophthora capsici)南京师范大学生命科学学院微生物实验室提供。
1.2 菌剂的制备方法
1.2.1 放线菌(R-1和ME2)的斜面菌种挖菌块接种到米饭培养基(将浸1 h的粳米隔水蒸至半熟,晾凉后加入干米重的10%的黄豆粉,拌匀,用1 mol/L的NaOH调pH值至7.0,装瓶,多层纱布和报纸封瓶,121 ℃灭菌40 min)[5]中,31 ℃培养5 ~7 d为扩繁菌种。扩繁菌种在无菌条件下,用混合方法接种到灭菌的固体发酵料(细土、黄豆粉、米糠、过磷酸钙按体积比77∶10∶10∶3比例混匀过100目筛装瓶,用纱布和报纸多层封瓶于121℃灭菌30 min在把灭菌的料倒入方盘中并用多层报纸覆盖)中,31℃发酵培养7~10 d,在发酵过程中定期搅拌,注意确保不污染杂菌,不同的放线菌株分别发酵。发酵结束后菌料倒入方盘中,置40℃干燥箱干燥至恒重,包装为放线菌单菌剂。
1.2.2 细菌(DP24)斜面菌种接种到一瓶牛肉膏蛋白胨液体培养基中31℃摇瓶发酵48 h为种子液,再接种到1L以上大的发酵瓶中发酵,发酵条件为:31℃,48 h。发酵液按照1∶2的比例倒入草炭中,搅拌均匀后置40℃干燥箱干燥至恒重,包装,为细菌单菌剂。
1.2.3 把1.2.1中发酵的不同的放线菌株发酵后。未烘干前按1∶1混合后倒入无菌方盘中,再与1.2.2中发酵的细菌液体发酵液按体积比1∶1混拌均匀,置干燥箱干燥,干燥条件为40℃,24 h,再调高温度到60℃,发酵物前期湿润时可以鼓风,后期干燥时定期搅拌但不要鼓风,发酵物干燥到恒重为混合菌剂。
1.3 菌剂中含有活体菌数量的测定
测定方法采用平板菌落计数法[6]。测定细菌用牛肉膏蛋白胨固体培养基;测定放线菌采用高氏一号固体培养基。混合菌剂中两株放线菌在高氏一号固体培养基上的菌落形态区分:R-1为浅粉色的菌落;ME2为黄色的菌落,分别计数。
1.4 菌剂抑菌活性测定
烘干的混合菌剂称取5 g,加入50%乙醇15 mL,充分浸泡12 h以上,取上清用0.22 μm的细菌滤膜过滤,滤液在无菌条件下滴加到PDA平板上的牛津小杯中。PDA平板在放置牛津小杯前已涂抹过黄瓜枯萎病菌和辣椒疫霉的孢子悬液。28℃恒温箱培养3~5 d,观察抑菌圈大小。
1.5 菌剂对人工接种辣椒疫霉病和黄瓜枯萎病菌的防治实验
辣椒种子和黄瓜种子在2%次氯酸钠溶液浸泡15 min。洗净后播种于经高温消毒的育苗土中。温室内培育。辣椒苗3~5叶期用伤根法接种辣椒疫霉孢子悬液,接种方法和调查方法参照文献[7];黄瓜小苗真叶展开时接种黄瓜枯萎病菌,接种方法和调查方法参照文献[8]。每盆4株苗,每处理6盆,3次重复,分别设清水浇苗后接种病原菌和不接种病原菌的空白为对照。
1.6 混合菌剂的田间实验
1.6.1 保护地西瓜和甜瓜实验设计。西瓜和甜瓜栽培大棚内划出6个试验区,其中处理区3个,对照区3个。处理区和对照区间隔排列。小区面积为12.2 m2,共10棵西瓜,每棵西瓜疏花疏果结1个瓜;甜瓜小区面积是14.84㎡,每个小区15株苗。处理区除按照实验设计方法接种混合菌剂外,栽培措施与对照区相同,常规田间管理。处理区实验方法是在西瓜和甜瓜苗移栽时,按用量20 kg/亩(1亩约为667 m2,下同)将菌剂先与细土或有机肥混匀后,根据移栽密度折算出每棵西瓜和甜瓜苗所用量,用量具如一次性水杯等量取并施入每棵苗穴,栽入西瓜苗,灌透水,在西瓜和甜瓜开花前追施一次,用量为10 kg/亩,距苗根部2~5 cm处挖小坑把菌剂施入后盖上2~3 cm的浮土。西瓜和甜瓜采收前调查枯萎病发病率,采收时测量西瓜和甜瓜每个实验处理区的单个西瓜产量和甜瓜的总产量,用甜度计测量每个西瓜和甜瓜的甜度。
1.6.2 保护地辣椒的实验设计。试验方法同1.6.1,小区面积为8 m2。调查方法是在辣椒盛果期调查辣椒疫霉病的发病率。多次采收,多次测产,直到采收结束,同一处理区的产量合并计算。

图1 两株放线菌单菌剂和混合菌剂的50%乙醇浸提液抑制黄瓜枯萎病菌的效果
2 实验结果分析
2.1 菌剂的菌体数量和抑菌活性测定结果
每个单菌剂和混合菌剂在制备完成后,均抽样检测菌剂中的菌体数量和抑菌活性。单菌剂中菌体数量达到108以上,并且50%乙醇浸提液存在抑菌活性,这些单菌剂为合格样品。混合菌剂中每个单菌株菌体数量达到105以上,且50%乙醇浸提液存在抑菌活性,这些混合菌剂为合格样品。不同批次的菌剂样品检验合格后均匀混合后再使用。由图1可见:用菌剂的50%乙醇浸提液0.2 mL滴加到牛津小杯中,抑菌圈直径达1.70~1.73 cm,表明功能菌株ME2和R-1制备的固体菌剂和混合菌剂抑制黄瓜枯萎病菌效果显著。
2.2 菌剂对苗期人工接种辣椒疫霉的防治试验结果
实验结果见表1,单菌剂和混合菌剂对辣椒苗期人工接种辣椒疫霉病菌的病情指数和发病率明显降低,防效均达到了50%以上,其中混合菌剂防效达到81.91%。

表1 菌剂对人工接种辣椒疫霉的防治效果
2.3 菌剂对苗期人工接种黄瓜枯萎病菌的防治试验结果
实验结果见表2,单菌剂和混合菌剂对黄瓜苗期人工接种黄瓜枯萎病菌的病情指数和发病率明显降低,防效均达到了60%以上,其中R-1单菌剂和混合菌剂防效达到80%以上。
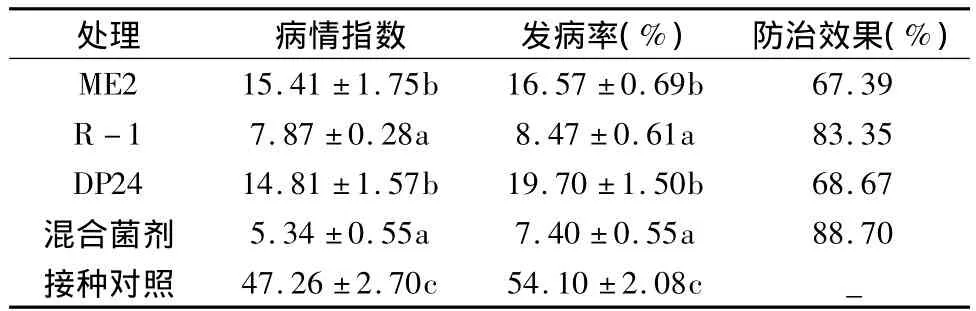
表2 菌剂对人工接种黄瓜枯萎病菌的防治效果
2.4 混合菌剂在保护地西瓜的试验结果
试验地点在张家港市塘桥镇鹿苑花园村18组农户西瓜连作地,供试西瓜品种为8424。由表3试验结果可见,田间施用混合菌剂处理的西瓜产量在32 006.7 ~33 054.3 kg/hm2之间,较常规对照田西瓜产量平均增加3027.5 kg/hm2,增幅为10.2%。处理差异达到极显著。增产因素为单果直径增加4.41 cm,单果重增10.16%,并均达到差异极显著水平。

表3 田间施用混合菌剂对西瓜产量的影响
处理田块的西瓜心糖糖度为10.9,边糖糖度为10.1,分别比未处理的西瓜糖度高出 0.8%、0.7%,但差异并不显著(见表4)。可见用混合菌剂接种西瓜田,对西瓜产量与单果重及单果直径有极显著的增产、增重、增大的作用,对西瓜糖度的作用不显著。

表4 田间施用混合菌剂对西瓜甜度的影响
混合菌剂对西瓜枯萎病的防治效果见表5。接种混合菌剂的田块,西瓜枯萎病的发病率为15%,没有接种的常规对照田块的发病率为65%,施用混合菌剂对西瓜枯萎病的防治率为77%。实验结果见表5。

表5 混合菌对西瓜枯萎病防治效果
2.5 混合菌剂在保护地甜瓜的试验结果
试验地点在苏州甪直镇澄湖良种基地的甜瓜连作地,供试甜瓜品种为日本甜宝。由表6的试验结果可见,使用混合菌剂处理的甜瓜产量平均为31 497.3 ~31 925.4 kg/hm2,比未用混合菌剂的常规对照田增产1729.8 kg/hm2,增幅为5.8%,达差异显著水平。产量构成因子之一的单果重,处理比对照增加了6.8%,但并未达到差异显著水平。混合菌剂对甜瓜单果增重和糖度的影响并不显著。

表6 田间施用混合菌剂对保护地甜瓜产量和甜度的影响
2.6 混合菌剂在保护地辣椒的实验结果
试验地点在张家港市锦丰镇南港蔬菜基地连作的辣椒地,辣椒品种为丰椒一号。由表7的试验结果可见,用混合菌剂处理的辣椒产量在50 771.6~51 496.2 kg/hm2,比未用混合菌剂的常规对照田增产2 716.2 kg/hm2,增幅5.6%,但差异不显著。处理单果重平均77.73g,比对照增3.13%,处理间差异显著。表明混合菌剂对提高辣椒的单果重量有显著作用,对提高产量虽有一定的作用,但效果并不明显。

表7 田间施用混合菌剂对辣椒产量的影响
混合菌剂对辣椒疫霉病的防治效果见表8。使用混合菌剂处理的辣椒田块发病率为25%,对照田发病率为100%,混合菌剂对辣椒疫霉病的防治率为75%。

表8 田间施用混合菌剂对辣椒疫霉病的防治效果
3 结论与讨论
已有的研究表明,在植物的根围土壤中存在很多对植物病原菌具有抑制作用的微生物,通常可利用竞争、抗生、寄生和交叉保护等直接的拮抗机制抑制植物病害[9],土壤放线菌的一些种还可以产生抗生素、酶及酶抑制剂,并与土壤中其他微生物形成稳定的微生物群落,对蔬菜根际及表层土壤阻挡其他病原微生物入侵起到了一定的屏障作用[10]。植物根分泌物为微生物提供重要的营养和能量物质,其成分和含量影响着根际微生物的种类和数量;根际微生物的代谢作用,反过来可以增加土壤中的氮和某些植物生长素抗生素的含量,或促进土壤中一些有效性低的营养物质的转化,或者兼有刺激植物的生育进程及防治病虫害的作用[11]。放线菌作为丰富的微生物资源,在作物枯、黄萎病防治中具有广阔的应用前景[12]。但是单种生防菌存在诸如菌株作用谱窄、持效性差、环境依赖性强等弊端,不能达到理想的促生防病效果[13]。因此利用生防菌组合防治作物病害成为国内外研究的新热点[14,15]。此外,采用具有不同拮抗作用特点的多个拮抗菌菌株组合的方法防治植物病害被认为是一种更为实际、更有效的生物防治策略[16-18]。随着人们对环保和健康意识的逐渐加强,用有益微生物防治植物病害以及生物净化环境已成为研究热点[12,19]。但复合菌剂的作用机理不是简单的累加,而是有一定的协同作用[20,21]。有些复合的生物菌剂确实达到提高生防效果的目的,但是,有些复合的生物菌剂并不增效,其中一个重要原因是使用的生防菌株之间不亲和,相互间有拮抗作用,最终导致多个菌株复合的生物菌剂防效不佳。理想的生防菌组合应克服不同拮抗微生物之间的排斥作用,并非混合的种类越多,效果就越优,只有全面考虑各菌株的习性并进行合适的组合,才能充分发挥其生防效果。利用拮抗微生物防治植物根部病害,就是将培养好的拮抗微生物以一定方式施入土壤中,或是通过在土壤中加入有机物等措施提高原有的拮抗微生物的活性,从而降低土壤中病原菌的密度,抑制病原菌的活动,减轻病害的发生[22]。在综合控制系统中,拮抗菌的加入有时是非常有效的[23]。
本实验是在研究了每个单菌剂的生防效果的前提下,再采取放线菌间组合的方法研究了放线菌组合菌的防效[2,3]。采用放线菌单独固体发酵,再混合烘干。以及在固体发酵的放线菌发酵料中混拌细菌发酵液的方法保证了制备的混合菌剂的各个菌株的菌体数量,同时也保证了混合菌剂的抑菌活性的存在。
本实验的试验结果证实混合菌剂在保护地一定的适宜环境下,能够有效地克服因连作而产生的枯萎病、疫霉病等土传病害;具有提高西瓜、甜瓜和辣椒的的产量、单果重和甜度品质的作用。该混合菌剂在保护地内的试验除了针对栽种的西瓜、甜瓜和辣椒进行了试验外,还对西葫芦、草莓和西红柿等植物上进行了试验(实验结果另文发表)。在试验中发现这些作物在一些地块中除发生枯萎病和疫霉病外,还发生青枯病、病毒病和线虫病害,特别是辣椒和西红柿青枯病的发生田块使用该生防菌剂是没有任何防效的,也导致实验数据的无法统计。实验的栽培基地中各种植物病毒病的发生也是普遍和严重,同样影响该试验的实验结果的分析。这些事实说明,生防菌剂的研究还应不断的深入,不断的扩大防治目标;还应针对线虫、青枯病菌以及植物病毒的有效控制菌株进行筛选和研究,有效的解决农业生产的实际问题。
[1]王成德,赵建成.蔬菜地土传病害及其防治技术[J].植物保护,1994,20(5):38-39.
[2]闫淑珍,杨启银,陈育如.复合微生物肥对植物土传病原真菌的抑制作用[J].中国生物防治,2004,20(1):49-52.
[3]闫淑珍,刘维红,方洁.小单孢菌E2菌株对辣椒疫霉的抑制及抗菌物质的初步测定[J].植物保护学报,2005,32(4):383-386.
[4]沈 萍,闫淑珍,陈双林,等.具ACC脱氨酶活性的植物内生细菌对辣椒的促生作用和对疫霉病的防治作用[J].植物保护学报,2008,35(1):28-32.
[5]朱 慧,孙 莉,李意坚,等.菌克菌对作物增产效果的研究[J].现代农业科技,2010,22:176-178.
[6]周德庆.微生物学实验教程[M].2版.北京:高等教育出版社,2009,117-121.
[7]毛爱军,胡 洽,耿三省.辣椒疫病菌接种鉴定技术研究[J].北京农业科学,1998,16(2):21-24.
[8]苗则彦,赵奎华,刘长远,等.内生细菌B504的鉴定及对黄瓜枯萎病的生防作用[J].植物保护,2009,35(6):73-77.
[9]陆雅海,张福锁.根际微生物研究进展[J].土壤,2006,38(2):113-121.
[10]罗文隧,姚政.促进根系健康的土壤微生态研究[J].中国农业生态学报,2002,10(1):44-46.
[11]毛知耘.肥料学[M].北京:中国农业出版社,1995.
[12]Mao W,Lewis J A,Hebbar P K,et al.1997.Seed treatment with a fungal or a bacterial antagonist for reducing corn damping-off caused by species of Pythium and Fusarium[J].Plant Disease,81:450-454.
[13]刘 仪.植物病害研究与防治[M].北京:中国农业科技出版社,1998:313-315.
[14]柳春燕,郭 敏,林学政等.拟康氏木霉和枯草芽孢杆菌对黄瓜枯萎病的协同防治用[J].中国生物防治,2005,21(3):206-208.
[15]Roberts D P ,Lohrke S M,Meyer S L F ,et al.Biocontrol agents applied individually and in combination for suppression of soilborne diseases of cucumber[J].Crop Protection,2005,(24):141-155.
[16]陈 红,李 平,王玲霞,等.混合菌培养提高水稻纹枯病生防效果的研究[J].中国农学通报,2001,17(5):1-5.
[17]Pierson E A,Weller D M.Use of mixtures of fluorescent pseudo-monads to suppress take-all and improve the growth of wheat[J].Phytopathology,1994,84:940-947.
[18]Raupach G S,Kloepper J W.Mixtures of plant growth promoting rhizobacteria enhance biological control of muitiple cucumber pathogens[J].Phytopathology,1998,88:1158-1164.
[19]Zhou Q X,Song Y F,Sun T H.Progress of study and application of bioremediation[J].Progress in Natural Science.2004,14(7):721-728.
[20]陈志谊,刘永峰,陆凡,等.井冈霉素和生防菌Bs-916协同控病作用及增效机理初探[J].植物保护学报,2003,30(4):429-434.
[21]Getha K,Vikineswary S,Wong W H,et al.Evaluation of Streptomyces sp.strain g10 for suppression of Fusarium wilt and rhizosphere colonization in pot-grown banana plantlet[J].Journal of Industrial Microbiology& Biotechnology,2005,32(1):24-32.
[22]Ouhdouch.Actinomycetes of Moroccan habitats:Isolation and screening for antifungal activities[J].European Journal of Soil,2001,37(2):69-74.
[23]Magnusson J,Strom K,Roos S,et al.Broad and complex antifungal activity among environmental isolates of lactic acid bacte[J].FEMS Microbiology Letters,2003,219(1):129-135.

