轻度高尿酸血症小鼠模型的实验研究
黄智勇 谢 红
解放军第175医院肾内科,福建省漳州市 363000
高尿酸血症是一种常见病,多种原因可导致血尿酸水平升高,包括饮食、肾脏排泄受损和过多内源性嘌呤的分泌,基因因素也起到一定作用。随着人们饮食结构的改变,以及对高尿酸血症认识的提高,高尿酸血症的发病率明显增加[1]。人们不仅认识到痛风性关节炎和尿酸盐结晶对肾脏的损伤,而且众多研究表明,尿酸升高与高血压、肾脏疾病、代谢综合征、脑卒中、胰岛素抵抗、脂代谢紊乱、心血管事件及全因死亡率成独立正相关[2,3]。由于越来越多的证据提示尿酸与高血压、代谢综合征、心血管疾病等之间的联系,似乎对高尿酸血症的治疗将使伴有其他危险因素的患者获益。然而,在临床实践中,对于血尿酸水平轻度升高的无症状患者是否给予治疗仍存在争议。本研究拟通过建立高尿酸血症动物模型,了解高尿酸血症时机体状态的变化,探讨无症状高尿酸血症时是否需要早期干预。
1 材料和方法
1.1 实验动物和试剂 雄性4月龄昆明小鼠20只,购自北京军事医学科学院实验动物中心。常规饲料喂养,自由摄食、饮水,自然昼夜采光。尿酸(美国Sigma公司),氧嗪酸钾(美国Sigma公司),一氧化氮(NO)试剂盒(普利莱基因技术有限公司),小鼠血管性假血友病因子(vWF)ELISA试剂盒(上海蓝基生物科技有限公司),过氧化氢(H2O2)检测试剂盒(南京建成生物有限公司)。
1.2 检测指标 血尿酸(UA)、尿素氮(UN)采用日立7150型全自动生化分析仪测定。血NO、vWF和H2O2检测按相关试剂盒操作说明书进行。肾脏和大血管PAS或HE染色,光镜下观察。
1.3 实验方法 实验前适应性饲养1周。20只昆明小鼠随机分为对照组和模型组,每组各10只。模型组腹腔注射氧嗪酸钾250mg/(kg·d)(氧嗪酸钾难溶于生理盐水,60℃水浴成混悬液,混悬液恢复至室温后使用)和尿酸250mg/(kg·d)(混悬液),对照组注射同等体积生理盐水,连续14d。摘眼球采血,分离血清后行UA、UN、NO、vWF、H2O2检测。留取肾脏、腹主动脉,10%甲醛固定,PAS或HE染色,光镜下观察肾脏组织和大血管形态。
2 结果
2.1 血清UA、UN测定结果 腹腔注射氧嗪酸+尿酸14d,模型组血UA水平较对照组明显升高,差异有统计学意义(P<0.05),见图1A。但2组小鼠血UN变化无统计学差异(P>0.05),见图1B。
2.2 血清H2O2测定结果 以氧嗪酸+尿酸腹腔注射制备高尿酸血症小鼠模型,模型组血H2O2水平较对照组明显升高,差异有统计学意义(P<0.05),见图2。
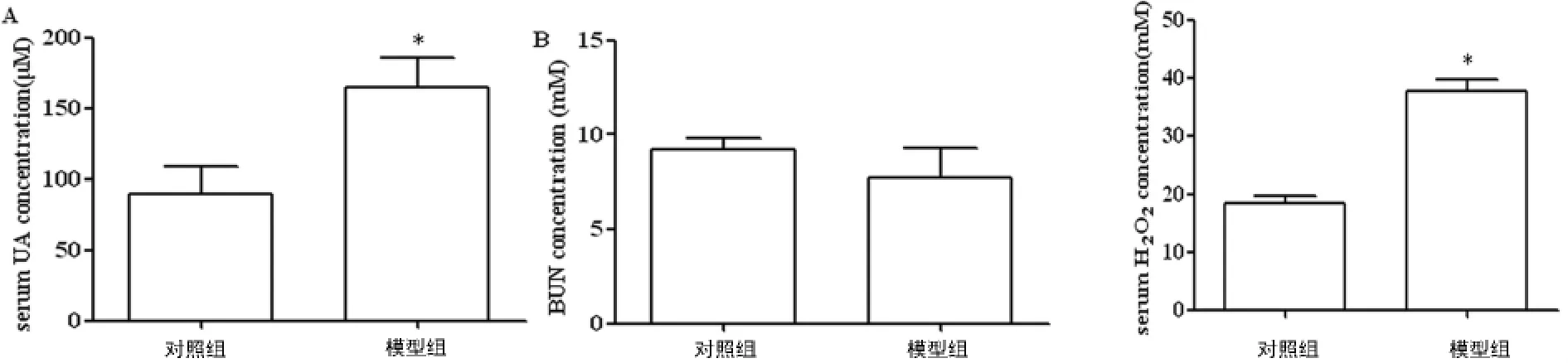
图1 高尿酸血症小鼠模型的建立 图2 对照组与模型组血清H2O2测定结果比较注:图1 A:模型组血尿酸水平明显升高(*P<0.05,与对照组比较,n=10)。B:模型组与对照组比较,血尿素氮水平无显著差异。图2:高尿酸血症小鼠血H2O2水平升高(*P<0.05,与对照组比较,n=10)。
2.3 血清NO、vWF测定结果 与空白对照组比较,模型组血NO水平降低,差异有统计学意义(P< 0.05),见图3A。血vWF水平升高,差异有统计学意义(P<0.05),见图3B。
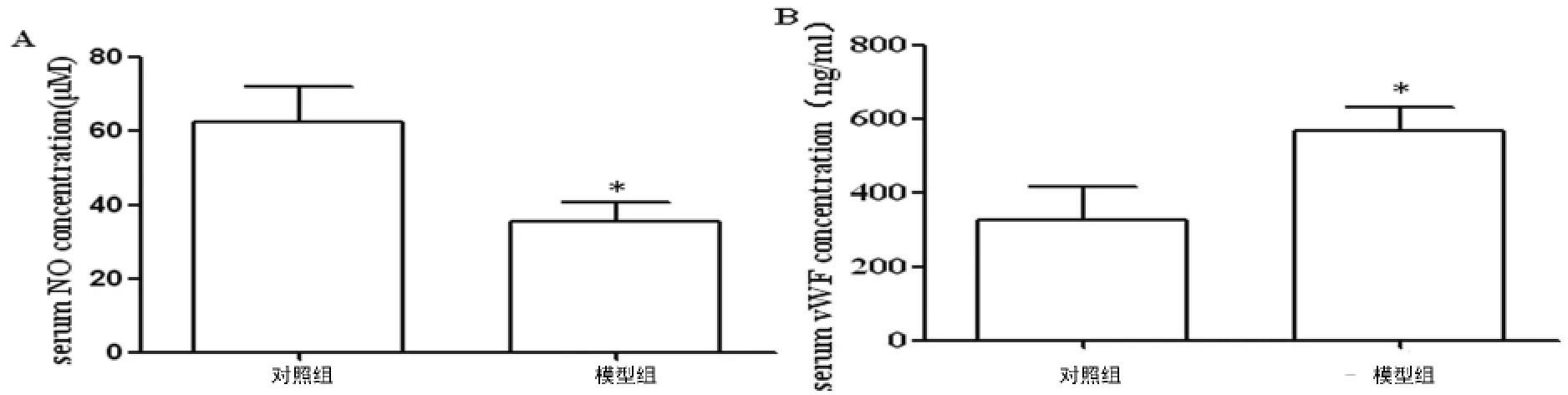
图3 模型组与对照组内皮细胞功能指标比较注:A:高尿酸血症模型小鼠血NO水平降低(*P<0.05,与对照组比较,n=10)。B:高尿酸血症模型小鼠血vWF水平升高(*P<0.05,与对照组比较,n=10)。
2.4 组织病理 对照组与模型组均未见明显肾小球、肾小管及肾间质小动脉病变,小管管腔无结晶样物质沉积,肾间质结构物异常,见图4A、图4B、图4C。血管内皮细胞排列于血管内膜下,内膜无增厚,血管壁无炎性细胞浸润,平滑肌细胞排列规则,未见明显病变,见图4D。
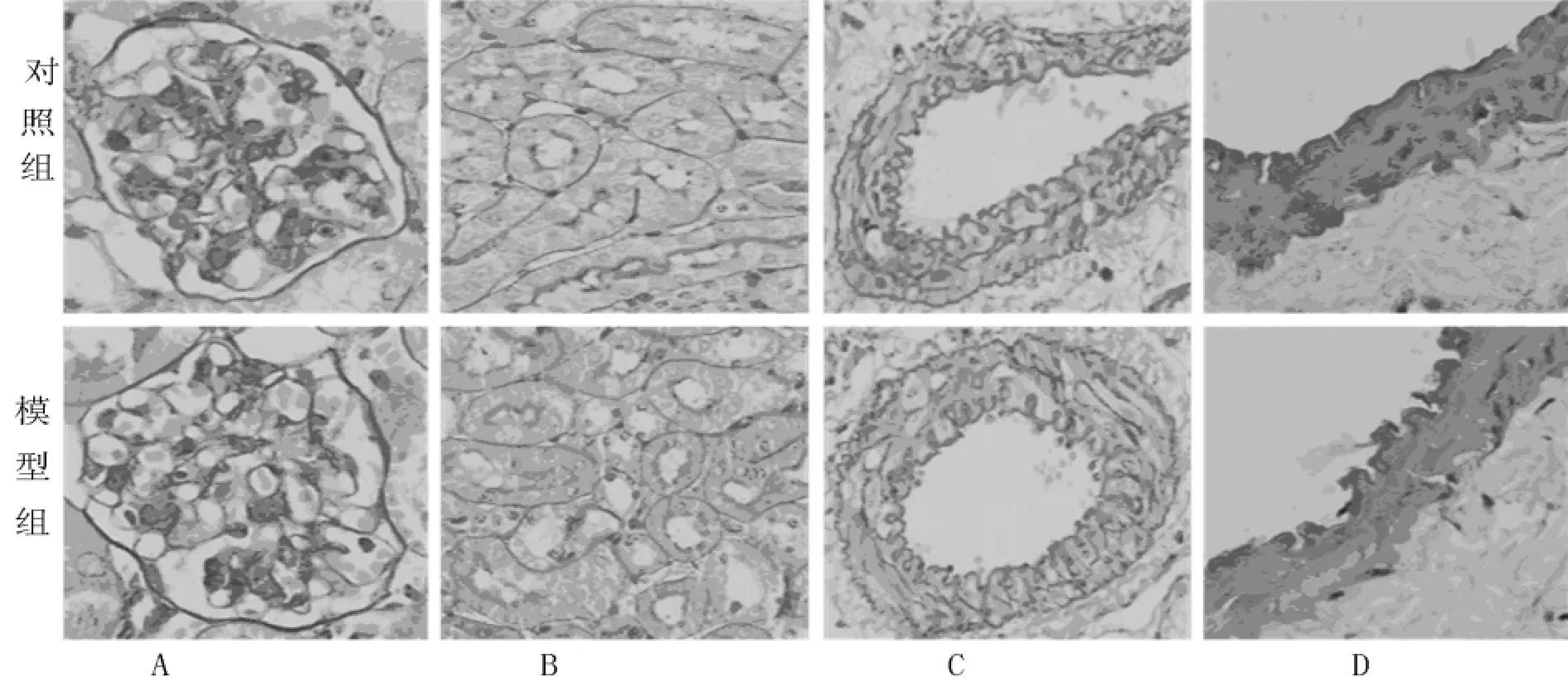
图4 对照组与模型组病理学结果比较注:模型组肾小球(A,PAS染色,×400)、小管间质(B,PAS染色,×400)、间质小动脉(C,PAS染色,×400)和大动脉(D,HE染色,×400)与对照组比较均无明显病理学改变。
3 讨论
血尿酸水平的变化与临床多种系统性疾病的发生发展相关,特别是与高血压、糖尿病、肥胖、代谢综合征等有密切联系[4]。当尿酸生成过多、排出障碍或者二者兼而有之,血尿酸水平升高超出正常范围,则出现高尿酸血症。随着生活水平的提高,高尿酸血症的发病率呈上升趋势,发病年龄呈现低龄化[1]。大量流行病学资料提示高尿酸血症是独立于高血压、糖尿病、肥胖等危险因素之外的导致慢性肾脏病和心血管疾病的危险因素,高水平血尿酸可通过氧化应激,增加ROS生成,诱导炎症和内皮细胞功能障碍,促进血管病变的发生发展[5]。然而,对无症状高尿酸血症的积极治疗却存在争议。
氧化应激是机体ROS产生和作用于生物系统对ROS解毒或修复损伤之间的一种不平衡。目前公认的是氧化应激在内皮细胞损伤和功能变化中发挥了重要的作用,是内皮功能紊乱的一个主要机制[6]。当ROS产生超过机体的抗氧化防御能力则产生毒性作用,导致内皮细胞发生炎症反应,损伤内皮细胞功能。H2O2是体内最常见的一种氧自由基,参与细胞增殖、分化以及凋亡等多种细胞调节过程,是造成组织器官损伤的主要ROS成分。在实验中,笔者发现模型组血UA水平升高,且H2O2水平也明显升高,提示高尿酸小鼠机体处于氧化应激状态。NO在调节血管张力、抑制血小板聚集、抗炎等方面起着重要作用,NO生物活性的下降是内皮功能障碍的一个主要部分。vWF主要在血管内皮细胞中合成和储存,当血管内皮细胞受损,vWF合成释放增加。因此vWF是反映内皮细胞受损的分子标志物之一。本实验中,笔者观察到模型组血vWF水平升高,NO水平下降,提示内皮细胞受损,功能障碍。即高尿酸血症小鼠存在明显氧化应激状态,内皮功能受损。
目前制备高尿酸血症模型主要有使用次黄嘌呤、腺嘌呤、尿酸盐、尿酸酶抑制剂等方法。从本实验结果可以看出,氧嗪酸联合尿酸腹腔注射,可在较短时间内明显升高血尿酸水平,且无肾功能损害,肾小球、肾小管间质及大血管均无明显病理改变,可用于无症状轻度高尿酸血症模型制备。
综上所述,本研究通过制备轻度高尿酸血症小鼠模型,发现轻度高尿酸血症时氧化应激即已增强,内皮功能受损。所以,应考虑积极治疗血尿酸轻度增高的无症状患者,以利于纠正患者体内氧化应激状态,改善内皮细胞功能,延缓心肾等疾病的发生。
[1] Choi HK,Curhan G.Gout:epidemiology and lifestyle choices〔J〕.Curr Opin Rheumatol,2005,17(3):341-345.
[2] Fang J,Alderman MH.Serum uric acid and cardiovascular mortality the NHANES I epidemiologic follow-up study,1971-1992.National Health and Nutrition Examination Survey〔J〕.JAMA,2000,283(18):2404-2410.
[3] Sun Y,Lin CH,Lu CJ,et al.Carotid atherosclerosis,intima media thickness and risk factors-an analysis of 1781asymptomatic subjects in Taiwan〔J〕.Atherosclerosis,2002,164(1):89-94.
[4] Feig DI,Kang DH,Johnson RJ.Uric acid and cardiovascular risk〔J〕.N Engl J Med,2008,359(17):1811-1821.
[5] Glantzounis GK,Tsimoyiannis EC,Kappas AM,et al.Uric acid and oxidative stress〔J〕.Curr Pharm Des,2005,11(32):4145-4151.
[6] Fenster BE,Tsao PS,Rockson SG.Endothelial dysfunction:clinical strategies for treating oxidant stress〔J〕.Am Heart J,2003,146(2):218-226.

