可降解金属血管支架研究进展
吴远浩,周晓晨,李 楠,郑玉峰,
(1.北京大学前沿交叉学科研究院生物医用材料与组织工程中心,北京100871)(2.北京大学工学院材料科学与工程系,北京100871)
可降解金属血管支架研究进展
吴远浩1,周晓晨2,李 楠2,郑玉峰1,2
(1.北京大学前沿交叉学科研究院生物医用材料与组织工程中心,北京100871)(2.北京大学工学院材料科学与工程系,北京100871)
随着心血管疾病治疗技术的发展,各种金属血管支架作为治疗心血管疾病的最有效器械之一,已经越来越受到人们的关注。重点介绍了目前研究最广泛的2类可降解金属血管支架材料:镁基合金和铁基合金。总结了这2类血管支架用可降解金属材料的研究进展,血管支架器械的动物试验和临床试验研究成果。归纳了可降解金属血管支架的有限元结构设计、应力分析、体内体外降解性能和生物相容性等需要重点考虑的属性。指出了可降解金属血管支架目前存在的不足,并对可降解金属血管支架未来的研究方向和发展前景进行了展望。
镁合金;铁;血管支架;生物降解;有限元分析
1 前言
近年来,随着人们生活水平的不断提高,各种心血管疾病的发病率正呈逐年升高趋势。世界卫生组织预计,到2030年,每年将会有约2 360万人死于心血管疾病[1],届时心血管疾病将成为人类健康的头号杀手。Charles Dotter and Melvin Judkins等[2]首先在1964 年提出了血管内介入治疗的概念。1977年,Gruentzig等[3]进行了第一例经皮冠状动脉成形术,Sigwart等[4]在1986年第一次报道了自扩张的冠状动脉支架,1987年,球囊扩张支架首次应用于人体[5]。血管支架的植入能够为血管提供支撑,使已经堵塞或者狭窄的血管完成血运重建,实现其正常生理功能。随着血管内治疗技术的发展,血管内支架植入术已经成为了治疗心血管疾病最有效的方法之一。在早期的临床应用中,常用的血管支架材料包括了不锈钢、镍钛、钴铬合金等生物惰性材料,这些支架材料作为异物虽然能够长期存在于人体内,但会引起内膜的过度增生,造成15%~30%的术后再狭窄。除了术后再狭窄,这些不可降解的惰性金属支架还能够产生内皮功能紊乱、凝血、慢性炎症、血管与支架机械性能不匹配等生物相容性问题,这在一定程度上限制了金属血管支架在临床中的应用。
理想的金属血管支架在体内存在的时间应该与血管功能的修复时间一致,一般需要6~12个月[6-7],超过这个时间后,金属支架的存在没有任何意义。在临床应用中人们希望该金属血管支架能够在血管功能重建的过程中逐渐降解,最后被人体完全吸收。因此,完全可降解的金属血管支架是治疗心血管疾病比较理想的选择。
由于高分子的天然可降解性,在可降解支架概念提出的早期,高分子可降解支架得到了一些研究。可用来制备可降解支架的高分子材料包括聚乳酸(PLA)、聚乙烯(PE)、聚对苯二甲酸乙二醇酯(PET)等。早期的研究结果显示,高分子类可降解支架的力学性能较差,往往不能提供血管重建的径向支撑力。Gammon等[8]采用编织的方法制备了聚-L-乳酸(PLLA)支架,这种支架能够提供0.01~0.013 Pa的支撑力,但是在含盐的环境中,这种支撑力只能维持30 d左右,远远低于血管早期修复所需要的时间。为了提供足够的力学性能,往往通过增加支架的尺寸来实现,这样就限制了高分子可降解支架在小血管方面的应用。其次,高分子支架的X射线成像能力差,这也限制了其在临床中的应用。此外,高分子在体内的降解会产生局部小分子的积聚,还会引起植入部位组织的无菌性炎症。
随着生物医用可降解材料研究的不断深入与发展,由于镁基合金以及铁基合金具有良好的生物相容性、生物可降解性以及力学性能,逐渐引起了人们的广泛关注。镁基合金和铁基合金在体液环境中能够腐蚀降解,降解产物中镁离子和铁离子都是人体必需的重要阳离子,参与体内许多重要的生理生化反应,对维持生命体的正常新陈代谢具有重要意义,不会产生细胞毒性。镁基合金和铁基合金具有较好的力学性能,能够为早期的血管重建提供足够的支撑力,有效地减少支架再狭窄的发生。本文将重点介绍镁基合金和铁基合金在血管支架方面的应用。
2 可降解金属支架
2.1 镁合金血管支架
镁是人体内必需的微量金属元素,具有良好的生物相容性和生物可降解性。其降解释放的镁离子相比于人体内镁离子浓度(0.7~1.0 mol/L)可以忽略不计,对人体无毒性[9]。镁在心血管领域的应用最早可以追溯到1878年。Huse医生曾3次利用镁丝结扎血管成功止血[10]。进入20世纪后,镁丝也被用于血管瘤的治疗[10]。在临床应用中发现镁的性质过于活泼,其在体内降解速度过快,力学性能过早丧失,往往达不到临床应用的要求。早期的镁合金动物试验和临床应用分别如表1、表2所示。

表1 镁合金支架的动物试验Table 1 Animal experiment of magnesium stents

表2 镁合金支架的临床应用Table 2 The clinic application of magnesium stents
动物实验结果显示,镁合金支架耐蚀性较差,在体内降解速率过快。为了提高镁的抗腐蚀性能,Heublein等[11]首先采用了合金化的方法来制备AE21镁合金(2%Al,1%RE)。他们将AE21合金植入到11只家猪冠状动脉内,随后在10,35,56 d后进行了检测。组织学分析显示AE21合金支架会诱导新生内皮的形成,但是新生的少量内皮组织在随后的血管重建过程中完全可以忽略。血液相容性试验结果表明,在每个观察阶段都没有在支架植入部位观察到血小板沉积和血栓形成。此外,在植入部位观察到轻微的炎症。AE21合金的降解速率与时间呈线性关系,主要问题在于降解速率要比预期快,在35~56 d之间就已经开始失去支架的机械完整性。他们认为这种镁合金可降解支架将会是替代永久性支架的很好选择,但是其降解速率需要得到控制,力学性能的完整性需要进一步提高。
Waksman等[17]在小型猪冠状动脉植入了镁合金支架(Mg-Zr-Y)和不锈钢支架(Lekton Motion)。血管组织切片以及血管造影术结果表明,植入3 d后,所有支架末端均保持打开状态,支架外围没有发生栓塞以及血栓的迹象。肉眼观察没有看到心脏发生畸形、心膜出血以及动脉瘤等现象,镁合金仍然保持完整。第28 d时,X射线检测已经能观察到镁合金支架降解的迹象。组织学分析没有观察到支架栓塞、血栓、炎症以及纤维蛋白沉积等不良反应。不锈钢支架血管面积(8.23±0.24)mm2要比镁合金支架血管面积(7.04±1.24)mm2大,然而镁合金支架血管新生内皮面积(2.44±0.88)mm2要比不锈钢支架血管的小(5.03±1.5)mm2。就新生内皮厚度而言,镁合金支架血管也比较小(分别为(382.9±154.18)μm,(636.49 ±227.34)μm)。3 个月后的组织学检测结果与28 d时类似,镁合金支架中的新生内皮面积要明显小于不锈钢支架。虽然支架在血管内时新生内皮面积增加较小,但是血管内腔增大不明显。他们的研究成果展示了镁合金血管支架的安全性和可行性,但是研究过程中仍发现镁合金降解速率还是过快。
Zartner等[15]将一个镁合金支架(φ3 mm ×10 mm)植入到了一个左肺动脉被误结扎的早产婴儿体内。在四个月的随访期间,左肺动脉的灌注随着支架的降解逐渐恢复,这说明这种支架的力学性能和降解能力能够满足血管再灌注的要求。尽管患者很小,但临床上表现出对支架的降解是可耐受的。他们认为设计不同尺寸的这类新型支架对治疗新生儿血管狭窄等病症非常有用。
Schranz等[18]报道了利用可吸收镁支架(φ4 mm ×15 mm)经皮治疗新生儿主动脉收缩的案例。在植入支架15 d后,血流速度从1.9 m/s提高到了2.9 m/s,到第三周时血流速度已经达到3.7 m/s,初步恢复了血液灌流。植入支架前,血管直径只有1.5~1.8 mm,植入支架后随着支架的逐渐降解,血管直径达到2~2.8 mm。由于支架的降解,考虑到其力学性能的丧失,他们给患者植入了第二个支架。尽管在患者体内植入了2个支架,血液中的镁离子并没有达到病理学的浓度。他们认为,这种可降解镁合金支架不需要随着患者的成长而扩张,不需要像传统支架进行二次手术,非常适合于儿科患者。
Erbel等[16]在63位病人体内植入了71个镁合金血管支架(直径:3.0~3.5 mm,长度:10~15 mm),所有的支架都准确地植入到了病变部位。在植入支架后,血管阻塞比例由 61.5%(±13.1%)降低到 12.6%(±5.6%)。4,6,12个月后进行血管造影和血管内超声检测。植入支架4个月后,缺血部位血管再生率为23.8%,在一年之后再生率达到45%。期间没有心肌炎症以及急、慢性凝血的发生。血管内超声检测只能看到很少支架残留物,说明大部分支架都已经降解。他们认为可降解镁合金支架在4个月内能够安全地降解,性能能够与其他血管支架相比拟。
早期的动物试验和临床试验结果都表明,镁合金支架作为一种可降解支架其降解产物无毒害,在体内不会产生慢性炎症,血管内皮增生率低,具有良好的生物相容性,但是其活性较高,合金成分需要加以设计来降低其降解速率,以满足血管逐渐重建过程中所需要的径向支撑力。
2.2 铁基金属血管支架
铁是构成人体的必需微量元素之一。在成人体内共有5 g铁,其中约有75%的铁以络合物的形式存在于血液中的血红蛋白内,参与氧气的转运。铁离子还是很多酶促反应的辅助因子,直接影响DNA合成以及氧化还原酶的活性。研究表明,成人每天需要补充约1 mg铁,因此铁基可降解材料作为可降解植入物时,其降解产生的铁离子可以被人体吸收参与新陈代谢,不会产生累积毒性,能够提供足够的安全保障[19]。纯铁可降解支架早期动物试验及其结果如表3所示。

表3 纯铁血管支架动物试验Table 3 Animal experiment of iron stents
2001年,Peuster等[20]利用激光切割技术加工了一种与永久支架PUVA-AS16结构相似的可降解纯铁(>99.8%)支架,并植入到新西兰大白兔体内进行了6~18个月的体内试验研究。在体实验结果表明,在跟踪的6~18个月时间内,没有发现血栓等并发症。在第6,12,18个月时,血管造影没有发现显著的内皮增生,植入部位没有观察到炎症现象,也没有发现全身系统的生物学毒性。Peuster等的工作第一次论证了铁基可降解血管内支架的可行性和安全性。
Waksman等将纯铁支架和钴铬合金支架置于猪冠状动脉中[22],28 d后发现纯铁支架表面呈黑色和棕色,与其相邻的血管呈现褐色。组织形态学检测结果表明在支架边缘部位没有过量内皮细胞的增殖,也没形成血栓。纯铁支架和钴铬合金支架的测量结果没有任何显著性差异。在支架厚度,支架面积以及阻塞率等方面,纯铁支架性能要优于钴铬合金支架。
Zhu等[23]进行了纯铁体外降解实验,并评价了其对内皮细胞的生物毒性作用。他们将样品放置于装有SBF溶液的流动腐蚀装置中,剪切应力通过SBF的流速控制在1.14 Pa,与血液流动过程中剪切应力一致。随着实验时间的延长,样品质量减少,腐蚀速率增加。672 h后,铁块平均质量从638.6 mg降到613.8 mg,其平均降解速率为 20.4 μg/cm2·h。SBF 中浸泡 1个月后,SEM结果显示样品表面形貌均一。样品在SBF中的腐蚀为均匀腐蚀,能够在较长时间内维持机械完整性并为血管提供径向支撑力。溶出的铁离子对内皮细胞影响试验结果显示:只有铁离子浓度大于50 μg/ml时才会表现出细胞毒性。SEM下,内皮细胞形态正常。第一天时,铁离子存在与否对细胞数量没有明显影响,但是在培养3 d后,不含铁离子的实验组粘附的细胞较少。
Hermawan等[24]采用粉末冶金方法制备了一种Fe-35Mn(质量分数)合金,并对合金的显微结构、力学性能、磁学性质以及降解性能进行了研究。XRD结果表明,合金中主要为奥氏体相γFe-35Mn。在力学性能方面,合金的拉伸强度与316L不锈钢相当,达到235 MPa,优于纯铁和镁合金。样品还具有较高的应变硬化指数,这能够保证其作为血管支架植入时发生的形变为塑性形变。在磁学性能方面,样品几乎没有像316L不锈钢那样的磁滞回路,呈现较低的磁化率,故植入后将不会影响MRI成像。在Hank's溶液中的电化学测试和浸泡测试表明,样品的腐蚀电位要小于纯铁,腐蚀速率比纯铁快3倍左右。Fe-35Mn合金由于其出色的力学性能、腐蚀性能以及磁学性能,具有发展成新型可降解铁基合金支架材料的前景。
为了提高铁基材料降解速率,Moravej等[25]用电铸的方法制备了一种纯铁材料。这种电化学沉积的纯铁(E-Fe)要比铸造热处理的纯铁(CTT-Fe)拥有更小的晶粒(4 μm)。在 Hank's溶液中的静态腐蚀结果显示,E-Fe的腐蚀速率约是CTT-Fe的3倍,达到0.4 mm·a-1。动态腐蚀试验中,E-Fe的铁离子溶出率比CTT-Fe高,这与其降解速率一致。按表面积1 cm2计算,理论上30 d内释放到血液中的铁离子为0.418 mg·L-1,远小于血液中铁离子含量(447 mg·L-1),不会对人体产生毒性。对于所有的铁样品,溶液的pH值在48 h内升高到7.6,随后保持稳定。细胞存活实验结果显示E-Fe不会降低原代大鼠平滑肌细胞新陈代谢活性,但是会降低该细胞的增殖能力,这样能有效地减少支架内的再狭窄。
材料显微结构的变化对细胞的增殖也有一定影响。Nie等[26]利用EACP技术制备了纳米晶的纯铁材料,并研究了其晶粒粒径分布、SBF中静态腐蚀、电化学腐蚀行为,与细胞相互作用等性质。试验结果表明,纳米晶的纯铁比微米晶的纯铁抗腐蚀能力要好,而且能够更好地促进成纤维细胞和内皮细胞的生长。此外纳米晶的纯铁能抑制血管平滑肌细胞的生长,因而有作为血管内植入材料的潜力。
各种合金化元素的添加可以增加铁基材料的降解速率,同时也能够对血管内皮细胞的增殖起到一定的抑制作用。随着对铁基合金可降解材料研究的深入,新型合金体系的开发,新型加工方法的采用势必会在降解速率、力学性能、生物相容性等方面提高铁基合金的临床应用价值。
3 血管支架的设计
3.1 支架力学性能以及腐蚀性能的改善
可降解血管支架植入后的降解速率应该与其力学性能一致,如图1所示[27]。在植入的早期(1~6个月内),降解速率很慢,提供血管重建需要的较大的径向支撑力。在6~12个月时间内,随着血管功能的恢复,支架降解速率加快,力学性能降低,避免对血管壁施加过大的载荷导致血管内膜增生。在12~18个月时间内,力学性能降低和腐蚀速率都加快。在18个月以后,血管功能重建完成,支架完全降解。
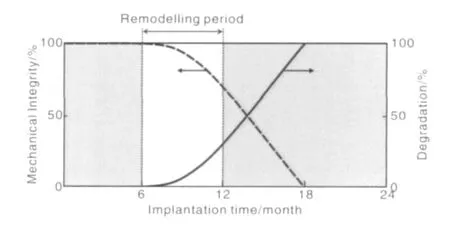
图1 理想支架降解性能与机械性能关系Fig1.Illustration of an ideal compromise between mechanical integrity anddegradation of a biodegradable stent
镁基合金和铁基合金作为支架的2种主要材料,从表4可以看出[28],镁合金的力学性能远不及不锈钢,镁合金材料脆性大,塑性变形能力差,容易发生断裂。在早期的骨科应用中也发现,镁合金性质过于活泼,在体液中腐蚀速率很快,在植入部位功能恢复之前就已经丧失大部分力学性能,往往达不到临床要求。在血管支架应用中也一样,镁合金支架过快的降解会导致支架自行坍塌,堵塞血管造成严重后果。为了在血管重建的整个过程中都提供较好的径向支撑力,如何提高其抗腐蚀能力和增加它在血管中的服役时间就成为了镁合金支架亟待解决的问题。
采用表面处理可以进一步提高支架的腐蚀抗力,减缓其降解速度。黄晶晶等[39]在镁表面涂覆聚乳酸涂层可以显著提高其在模拟体液中的耐蚀性,其中涂覆分子量为2×105左右的PLGA能够满足降解条件和结合力的要求。赵常利等[40]在Mg-Zn合金表面浸涂PLGA涂层,试验结果表明涂层致密均匀,在模拟体液环境中耐蚀性好,降解周期延长。Gu[41]还发现浸涂不同分子量壳聚糖涂层和不同涂层层数均对镁合金的腐蚀速度有影响,其中浸涂6层壳聚糖涂层(分子量2.7×105)的镁合金具有最好的耐腐蚀性。

表4 几种不同材料的力学性能Table 4 Properties of different kinds of biomaterials
铁基合金在临床上应用广泛,316L不锈钢的各项性能参数一直作为评价其他材料的黄金标准。纯铁材料虽然具有较好的力学性能和支撑性能,但它在体内降解速率较慢,长期存在于体内会带来一系列的生物相容性问题。因而提高铁基材料在体液环境中的腐蚀速率对其在临床中的应用具有非常重要的意义。目前有人采用合金化等方法提高其在体内的腐蚀速率使其在体液环境下能够较快降解以扩大其应用范围。Hermawan等[31-33]最早进行了利用合金化的方法来提高纯铁的腐蚀速率的研究。Shcinhammer等[42]认为Mn元素和Pd元素都是比较合适的合金化元素。Mn和Pd的加入都能够与铁形成金属间化合物,这些金属间化合物能够显著地增加其腐蚀速率和强度。Mn能够降低合金的标准电极电位,Pd能够形成惰性的Pd金属间化合物作为阴极,从而达到增加合金腐蚀速率的目的。他们开发的Fe-10Mn-1Pd合金的抗腐蚀速率要比纯铁抗腐蚀速率小一个数量级,同时合金的机械性能还能够通过控制合金元素的含量和随后的热处理来加以控制。他们认为这种新材料在电化学腐蚀以及机械性能等方面都有作为可降解支架材料的潜质。Liu等[43]开发了6种 Fe-X二元合金(X=Mn,Co,Al,W,Sn,B),每种合金元素原子比控制在3%。同时,他们还研究了含碳3%的高碳钢1070以及含硫0.5%的易切削钢,研究了钢中碳、硫对铁性能的影响。拉伸试验结果表明Mn,Co,W,B,C和S能够增加纯铁的屈服强度,Sn的加入使纯铁力学性能降低。腐蚀试验表明,纯铁以及这6种合金的腐蚀都是局部腐蚀,纯铁与合金之间的腐蚀速率差别不大。此外,相比于316L不锈钢而言,纯铁以及合金的萃取液都能够抑制L929细胞以及血管平滑肌细胞(VSMC)的增殖能力,但是对ECV304内皮细胞没有显著的细胞毒性,凝血试验表明所有的材料凝血率都在5%以下,具有较好的血液相容性。他们认为,就力学性能、腐蚀速率、生物相容性等方面而言,Co,W,C,S是开发可降解铁基合金比较合适的合金元素。
3.2 血管支架结构的有限元设计
血管支架用来重建发生堵塞的血管部分,不同的支架设计对支架提供的径向支撑力、术后再狭窄率等方面都有重要的影响。有人认为血管受到支架的损伤程度直接决定血管再狭窄率,因而合理的设计对支架的性能有着非常重要意义[44]。有限元方法(FEM)是一种常见的现代计算方法,在很多领域都有广泛的应用。有限元的基本思想是将待分析的结构离散化,即将复杂区域划分成相互连接的小单元,通过每个小单元之间的应力和应变传递,获得整体的应力、应变结果,从而达到对复杂的机械问题进行求解的目的。近些年来,有限元方法也被用来进行血管支架受力分析以及结构优化等方面。人们可以对支架建立有限元模型,施加载荷并确立边界条件,从而对支架在血管中受到的应力以及受力后的形变进行分析,通过这些模拟结果,对支架的相关性能进行预测和分析,并对支架的结构设计提供一定的指导[45]。
对于理想的镁合金支架,进行有限元设计时,主要考虑以下要求[46]:①为防止血管弹性重塑,因此必须具有较强的支撑力,有限元计算的结果显示相同情况下,开环结构的支撑力要大于闭环结构,主要是因为相同长度的支架所含有的开环结构单元的数目多于闭环结构单元的数目。因此,在镁合金支架设计中应尽量减小支架单元的轴向长度,这样才能保证有足够的支撑力以抵抗血管的压力。而支架单元扩张之后应力集中的地方一般都是在单元的两端以及中部,为了保证其支撑力,可以在这些部位进行加粗处理。②考虑到血管的弯曲变形,支架的柔顺性必须较好,不同结构设计的支架其柔顺性不一样。有限元计算结果表明在相同的变形量前提下,开环结构支架的柔顺性要优于闭环结构,这些差异导致了支架表面金属覆盖率的不同,使支架在弯曲过程中参与变形的材料增加,从而对柔顺性产生一定的影响。③支架在球囊撑起的扩张过程中会发生轴向缩短,球囊撤除之后支架会发生弹性回弹,需要将这2个量尽量控制到最小。
王小平等[47]研究了Biotronik公司的2种支架在球囊扩张作用下外径从2 mm扩大到4 mm时的整个支架的形变。有限元分析结果表明,支架在扩张的过程中最大应变达到了20%,超过了目前镁合金的最大延伸率。因此他们认为对镁合金血管支架而言,不仅需要对支架的几何形状进行优化,避免应力集中,还需要对镁合金进行改进,提高其塑性变形能力。
Wu等[48]采用有限元方法对AZ80,AZ31,AZ21以及WE43等4种镁合金支架结构进行了优化。模拟结果表明,最优化的支架支柱宽度增加了48%,最大主应力降低14%,回缩后的最大主应力降低29%,支架的扩张性能增加24%。他们认为支架各单元之间支柱在不同部位应设计成不一样的宽度。支柱内部直线部分减少质量,外部曲线部分增加质量能够显著地降低最大应力而且能够使应力分布更加均匀。他们还认为,对于支柱采用不同厚度的设计会提供更多的优化参数。在支架材料的选择上,模拟结果证明材料延伸率对支架优化的结果有很大的影响。随着支架每个单元长度的下降,最大主应力会增加,甚至会大于材料的延伸率,因而单元的长度应有一定限制。在另一个试验中,Wu等人[49]对3种不同结构的支架(如图2所示)进行了模拟。模拟结果表明,在球囊扩张过程中,B支架的最大主应力最小,C支架最大。对于这3种支架,应力都主要集中在扩张过程中形变的区域。在体内降解的模拟过程中,所有的支架在表面都表现出均匀腐蚀,但是B支架表现出更加温和的应力腐蚀。在质量损失方面,A支架质量损失最快,最先失去支架能力,在整个降解过程中,B支架能够起到最长的支架作用。尽管C支架质量比B支架大,但是由于应力更加集中的原因,C支架在增加半回缩时间方面不如B。他们认为,增加支架质量和降低主应力是提高支架机械性能的主要方法,但是二者往往相互矛盾,因此需要在二者之间寻求一个平衡。
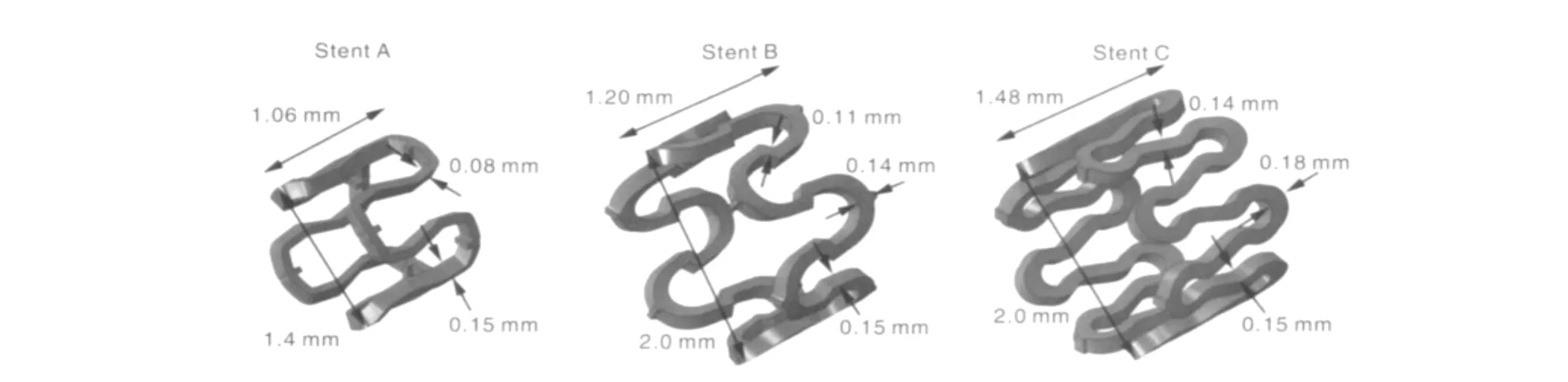
图2 3种不同结构的支架Fig.2 Three designs of magnesium alloy stent
4 结语
在心血管疾病治疗方面,早期使用的是裸金属支架和药物洗脱金属覆膜支架。随着临床应用的增多,裸金属支架造成的长期排异反应会影响血管的正常生理机能。药物洗脱金属覆膜支架(DES)在植入患者后的初期,能够有效地降低血管再狭窄率(再狭窄率将到10%以下),然而随着DES在体内存在时间的延长,一系列研究表明DES会增加死亡率和晚期血栓的形成。此外,DES还存在植入晚期贴壁不良的现象,容易从植入部位脱落,造成严重后果。可降解金属支架的发展改变了以往仅仅是机械替代病变组织的概念。早期的体外研究结果表明,镁基和铁基可降解支架在体内具有较好的生物相容性,能够提供足够的支撑力,但是它们的降解速率需要进一步的控制以适应血管重建的过程。未来的血管支架研究热点应该包括以下几个方面:通过合金化、热处理、表面处理等方式改善镁基合金以及铁基合金支架的腐蚀速率;改进血管支架体外实验评价体系,进行体外动态腐蚀试验,合理定制腐蚀溶液的粘度以及流速,使其更加真实地模拟血管内环境;建立新的有限元模型,利用有限元分析模拟结果,设计更加合理的支架结构。
随着生物医用可降解金属材料研究的进一步深入,通过建立新型合金体系以及设计支架的新结构,我们有理由相信可降解金属血管支架性能将逐渐完善,并在不久的将来在治疗心血管疾病等方面发挥其重大作用。
References
[1]WHO Medium Center(世卫组织媒体中心).Cardiovascular Disease(心血管病)[EB/OL].(2011-09)[2012-03-10].http://www.who.int/mediacentre/factsheets/fs317/zh/index.html.
[2]Dotter C T,Judkins M P.Transluminal Treatment of Arteriosclerotic Obstruction,Description of a New Technic and a Preliminary Report of Its Application[J].Circulation,1964(30):654-670.
[3]Gruentzig A R.Percutaneous Transluminal Coronary Angioplasty[J].Semin Roentgenol,1981(16):152-153.
[4]Sigwart U,Puel J,Mirkovitch V,etal.Intravascular Stents to Prevent Occlusion and Restenosis after Transluminal Angioplasty[J].The New England Journal of Medicine,1987(316):701-706.
[5]Kauffmann G W,Wenz W.Intraluminal Palmaz Stent Implantation.The First Clinical Case Report on a Balloon-Expanded Vascular Prosthesis[J].Radiologe,1987(27):560-563.
[6]ElOmar M M,Dangas G,Iakovou I,etal.Update on In-Stent Restenosis[J].Current Interventional Cardiology Reports,2001(3):296-305.
[7]Schomig A,Kastrati A,Mudra H,etal.Four-Year Experience with Palmaz-Schatz Stenting in Coronary Angioplasty Complicated by Dissection with Threatened or Present Vessel Closure[J].Circulation,1994(90):2 716-2 724.
[8]Gammon R,Chapman G,Agrawal G,etal.Mechanical Features of the Duke Biodegradable Intravascular Stent[J].Journal of the American College of Cardiology,1991(17):372-377.
[9]Erne P,Schier M,Resink T J,etal.The Road to Bioabsorbable Stents:Reaching Clinical Reality[J].Cardiovasc Intervent Radiol,2006(29):11-16.
[10]Frank Witte.The History of Biodegradable Magnesium Implants:A Review[J].Acta Biomaterialia,2010(6):1 680-1 692.
[11]Heublein B,Rohde R,Kaese V,etal.Biocorrosion of Magnesium Alloys:a New Principle in Cardiovascular Implant Technology[J].Heart,2003(89):651-656.
[12]Waksman R,Pakala R,Kuchulakanti P,etal.Safety and Efficacy of Bioabsorbable Magnesium Alloy Stents in Porcine Coronary Arteries[J].Catheterization and Cardiovascular Interventions,2006(68):606-617.
[13]Waksman R,Pakala R,Okabe T,etal.Efficacy and Safety of Absorbable Metallic Stents with Adjunct Intracoronary Beta Radiation in Porcine Coronary Arteries[J].Journal of Interventional Cardiology,2007(20):367-372.
[14]Mario C,Griffiths H,Goktekin O,etal.Drug-Eluting Bioabsorbable Magnesium Stent[J].Journal of Interventional Cardiology,2004(17):391-395.
[15]Peter Z,Robert C,Helmut S,etal.First Successful Implantation of a Biodegradable Metal Stent into the Left Pulmonary Artery of a Preterm Baby[J].Catheterization and Cardiovascular Interventions,2005(66):590-594.
[16]Erbel R,Haude M,Böse D,etal.Temporary Scaffolding of Coronary Arteries with Bioabsorbable Magnesium Stents:a Prospective,Non-Randomised Multicentre Trial[J].Lancet,2007(369):1 869-1 875.
[17]Waksman R,Rajbabu P,Pramod K,etal.Safety and Efficacy of Bioabsorbable Magnesium Alloy Stents in Porcine Coronary Arteries[J].Catheterization and Cardiovascular Interventions,2006(68):607-617.
[18]Dietmar S,Peter Z,Ina M,etal.Bioabsorbable Metal Stents for Percutaneous Treatment of Critical Recoarctation of the Aorta in a Newborn[J].Catheterization and Cardiovascular Interventions,2006(67):671-673.
[19]Liu Hengquan(刘恒全),Zhang Yong(张 勇),Zhu Shengfa(朱生发),etal.心血管可降解金属材料的研究进展[J].Chinese Journal of Interventional Imaging and Therapy(中国介入影像与治疗学),2008(5):306-311.
[20]Peuster M,Wohlsein P,Brügmann M,etal.A Novel Approach to Temporary Stenting:Degradable Cardiovascular Stents Produced from Corrodible Metal-Results 6~18 Months after Implantation into New Zealand White Rabbits[J].Heart,2001(86):563-569.
[21]Peuster M,Hesse C,Schloo T,etal.Long-Term Biocompatibility of a Corrodible Peripheral Iron Stent in the Porcine Descending Aorta[J].Biomaterials,2006(27):4 955-4 962.
[22]Waksman R,Pakala R,Baffour R,etal.Short-Term Effects of Biocorrodible Iron Stents in Porcine Coronary Arteries[J].Jour-nal of Interventional Cardiology,2008(21):15-20.
[23]Zhu S,Huang N,Xua L,etal.Biocompatibility of Pure Iron:in Vitro Assessment of Degradation Kinetics and Cytotoxicity on Endothelial Cells[J].Materials Science and Engineering C,2009(29):1 589-1 592.
[24]Hermawan H,Alamdari H,Mantovani D,etal.Iron-Manganese:New Class of Metallic Degradable Biomaterials Prepared by Powder Metallurgy[J].Powder Metallurgy,2008(51):38-45.
[25]Moravej M,Purnama A,Fiset M,etal.Electroformed Pure Iron as a New Biomaterial for Degradable Stents:in Vitro Degradation and Preliminary Cell Viability Studies[J].Acta Biomaterialia,2010(6):1 843-1 851.
[26]Nie F,Zheng Y,Wei S,etal.In Vitro Corrosion,Cytotoxicity and Hemocompatibility of Bulk Nanocrystalline Pure Iron[J].Biomedical Material,2010(5),065 015.
[27]Hermawan H,Dubé D,Mantovani D,etal.Developments in Metallic Biodegradable Stents[J].Acta Biomaterialia,2010(6):1 693-1 697.
[28]Maryam M,Diego M.Biodegradable Metals for Cardiovascular Stent Application:Interests and New Opportunities[J].International Journal of Molecular Sciences,2011(12):4 250-4 270.
[29]ASTM International.ASTM F138-08Standard Specification for Wrought18Chromium-14Nickel-2.5Molybdenum Stainless Steel Bar and Wire for Surgical Implants[S].USA:West Conshohocken,2008.
[30]Mani G,Feldman M,Patel D,etal.Coronary Stents:A Materials Perspective[J].Biomaterials,2007(28):1 689-1 710.
[31]Hermawan H,Dube D,Mantovani D,etal.Development of Degradable Fe-35Mn Alloy for Biomedical Application[J].Advanced Materials Research,2007(15):107-112.
[32]Hermawan H,Alamdari H,Mantovani D,etal.Iron-Manganese:New Class of Metallic Degradable Biomaterials Prepared by Powder Metallurgy[J].Powder Metallurgy,2008(51):38-45.
[33]Hermawan H,Dube D,Mantovani D,etal.Degradable Metallic Biomaterials:Design and Development of Fe-Mn Alloys for Stents[J].Journal of Biomedical Materials Research Part A,2010(93):1-11.
[34]Schinhammer M,Hanzi A,Loffler J,etal.Design Strategy for Biodegradable Fe-Based Alloys for Medical Applications[J].Acta Biomater,2010,6,1 705-1 713.
[35]Moravej M,Prima F,Fiset M,etal.Electroformed Iron as New Biomaterial for Degradable Stents:Development Process and Structure-Properties Relationship[J].Acta Biomaterialia,2010(6):1 726-1 735.
[36]Hermawan H,Moravej M,Dubé D,etal.Degradation Behaviour of Metallic Biomaterials for Degradable Stents[J].AdvancedMaterials Research,2007(15-17):113-118.
[37]Gu X,Zheng Y.A Review on Magnesium Alloys as Biodegradable Materials[J].Frontiers of Materials Science in China,2010(4):111-115.
[38]Hanzi A,Sologubenko A,Uggowitzer P,etal.Design Strategy for Microalloyed Ultra-Ductile Magnesium Alloys for Medical Applications[J].Materials Science Forum,2009(618-619):75-82.
[39]Huang Jingjing(黄晶晶),Ren Yibing(任伊宾),Zhang Bingchun(张炳春),etal.可降解镁植入材料表面涂层的制备及其性能[J].The Chinese Journal of Nonferrous Metals(中国有色金属学报),2007(17):1 465-1 469.
[40]Zhao Changli(赵常利),Zhang Shaoxiang(张绍翔),He Cihui(何慈晖),etal.生物医用镁合金表面PLGA涂层研究[J].Journal of Functional Materials(功能材料),2008(39):987-993.
[41]Gu X,Zheng Y,Lan Q,etal.Surface Modification of an Mg-1Ca Alloy to Slow Down Its Biocorrosion by Chitosan[J].Biomedical Materials,2009(4):044 109.
[42]Schinhammer M,Hanzi A,Loffler J,etal.Design Strategy for Biodegradable Fe-Based Alloys for Medical Applications[J].Acta Biomaterialia,2010(6):1 705-1 713.
[43]Liu B;Zheng Y.Effects of Alloying Elements(Mn,Co,Al,W,Sn,B,C and S)on Biodegradability and in Vitro Biocompatibility of Pure Iron[J].Acta Biomaterilia,2010(7):1 407-1 420.
[44]Lallya C,Dolanb F,Prendergast P,etal.Cardiovascular Stent Design and Vessel Stresses:a Finite Element Analysis[J].Journal of Biomechanics,2005(38):1 574-1 581.
[45]Xia Z,Jua F,Sasakib K,etal.Ageneral Finite Element Analysis Method for Balloon Expandable Stents Based on Repeated Unit Cell(RUC)Model[J].Finite Elements in Analysis and Design,2007(43):649-658.
[46]Si Chaoyang(司超阳).Finite Element Analysis of Mechanical Behavior on Biodegradable Magnesium Alloy Stents(生物可降解镁合金支架力学性能的有限元分析)[D].Dalian:Dalian University of Technology,2010.
[47]Wang Xiaoping(王小平),Jiao Yanpeng(焦延鹏),Cui Fuzhai(崔福斋),etal.新型可降解金属血管支架的有限元力学分析[J].Journal of Machine Design and Research(机械设计与研究),2007(23):59-61.
[48]Wu W,Petrini L,Gastal D,etal.Finite Element Shape Optimization for Biodegradable Magnesium Alloy Stents[J].Annals of Biomedical Engineering,2010(38):2 829-2 840.
[49]Wu W,GastaldiaD,Yang K,etal.Finite Element Analyses for Design Evaluation of Biodegradable Magnesium Alloy Stents in Arterial Vessels[J].Materials Science and Engineering B,2011(176):1 733-1 740.
Research Progress on Biodegradable Metallic Endovascular Stents
WU Yuanhao1,ZHOU Xiaochen2,LI Nan2,ZHENG Yufeng1,2
(1.Center for Biomedical Materials and Tissue Engineering,Academy for Advanced Interdisciplinary Studies,Peking University,Beijing 100871,China)(2.Department of Materials Science and Engineering,College of Engineering,Peking University,Beijing 100871,China)
With the development of new technology to treat cardiovascular disease(CVD),cardiovascular stents have drawn more and more attention as one of the most effective device in the treatment of CVD.In this paper,we mainly focused on two types of biodegradable metallic vascular stents which are mostly investigated nowadays,namely magnesium alloy stents and iron-based alloy stents.We summarized the research progresses on these biodegradable metallic alloys from the viewpoint of materials science in the present days and the animal experiments,clinic trail results of their stents as well.We overviewed about the finite element design,stress analysis,mechanical property,degradation performance,biocompatibility of the biodegradable metallic stents.Finally,we pointed out the deficiency of current biodegradable metallic stent and their future research direction.
magnesium alloy;iron;endovascular stents;biodegradable;finite element
R318.08
A
1674-3962(2012)09-0027-08
2012-03-21
国家重点基础研究发展计划(2012CB619102);高等学校博士学科点专项科研基金资助课题(20100001110011);国家自然科学基金(31170909);国家高技术研究发展计划专项(2011AA030103)
吴远浩,男,1989年生,博士研究生
郑玉峰,男,1973年生,博士,教授
10.7502/j.issn.1674-3962.2012.09.04

