超高效液相色谱法测定烟叶中的茄尼醇含量
张 婕,汪云松,蔡 凯,向章敏,周淑平,许冬青,耿召良*
(1.贵州省烟草科学研究所,贵阳 550081;2.云南大学,昆明 650091)
茄尼醇(C45H74O)是一种主要存在于茄科植物叶中的无环四倍半萜烯醇化合物,于 1956年首次从烤烟中分离出来,在烟草叶片中的含量最高[1-2]。茄尼醇是药物合成的重要原料和泛醌类药物的关键中间体,具有重要的医药开发价值[1-4]。同时,茄尼醇在卷烟燃吸过程中可以热解产生多种香气成分和多环芳烃等有害物质,对烟草制品的品质和安全性具有很大影响[5]。烟叶中的茄尼醇测定方法主要有薄层扫描法、气相色谱法、液相色谱法和库仑滴定法,其中液相色谱法具有操作简单、定量准确、重复性好等优点,是测定茄尼醇含量应用较多的一种方法[6-9]。普通高效液相色谱分析时间长,多使用乙腈、甲醇、乙醇等2种以上的洗脱剂作为流动相,其与萃取液(丙酮、甲醇等有机溶剂)组成的差异,会对色谱峰形造成影响,降低准确性[7-15]。针对普通液相色谱检测烟叶茄尼醇含量的不足,本研究采用分析速度更快、流动相用量更省的超高效液相色谱(UPLC)对烟叶中的茄尼醇进行分析,对流动相组成等分析条件进行优化,将烟草样品用甲醇溶液萃取过滤后,直接进行超高效液相色谱分离测定,并通过比较标样和样品质谱图的方式对是否有共流出的干扰峰进行了检测,最终建立烟叶中游离茄尼醇含量的快速分析方法。
1 材料与方法
1.1 仪器与试剂
超高效液相色谱-二极管阵列检测器(美国Waters公司,ACQUITY UPLC H-CLASS);超高效液相色谱-四级杆串联飞行时间质谱(美国 Waters公司,UPLC-XEVO Q-TOF);电子天平(瑞士Merrier Toledo公司,AB104-S,波振荡器(德国Elma公司,T701DH);KS多用调速摇床振荡器(北京科伟科技仪器有限公司);超纯水系统(美国Millipore公司,Milli-Q Element);尼龙针式滤头(天津市津腾实验设备有限公司,0.22 μm)乙腈、甲醇、异丙醇(美国默克公司,色谱纯);丙酮(上海申博化工有限公司,分析纯)、无水乙醇(上海振兴化工一厂,分析纯);茄尼醇对照品(广州百灵威科技有限公司,纯度90%)。
1.2 样品制备
共 11个烟叶样品,其中烤烟和晾晒烟烟叶样品采集于贵州省某产区,香料烟采自云南保山。研磨至粉末,过60目筛,称取50 mg(精确至0.1 mg)样品于50 mL离心管中,准确加25 mL甲醇溶液在超声波频率40 KHz,萃取功率130 W条件下萃取10 min,取2 mL萃取液,经0.22 μm滤膜过滤后进样分析。
1.3 色谱条件
色谱柱:BEH C18 (1.7 μm,2.1 mm×50 mm),美国Waters公司;流速为0.4 mL/ min;柱温为30℃;进样量为2 μL;运行时间5 min。
流动相:100%甲醇等度洗脱。
1.4 质谱条件
大气压化学电离源(APCI),正离子模式检测,电晕电流4 μA,电晕针温度500 ℃,采样锥孔电压30 V,提取锥孔电压4 V,源温120 ℃,锥孔气流速50 L/h,脱溶剂气流速800 L/Hr。
采用 MS模式,全扫描质荷比(m/z)范围为100~1000,扫描时间 5 min。
1.5 标准溶液的配制及定量
准确称取8.5 mg茄尼醇对照品,用甲醇溶解定容至50 mL,得浓度为153.00 μg/mL的标准储备液,冷藏于4 ℃备用。
分别取茄尼醇标准储备液,用甲醇稀释配制成浓度为0.765,1.530,3.825,7.650,15.30,30.60,76.50 μg/mL的系列标准溶液。
采用比较标准与样品质谱图、保留时间定性,外标法定量。
2 结果与讨论
2.1 线性范围及检出限
采用1.5配制的系列标准溶液进行液相色谱分析,对峰面积(Y)与浓度(X,μg/mL)进行线性回归,得茄尼醇的回归方程。结果表明,该方法在0.765~76.5 μg/mL浓度范围内有良好的线性关系(Y= 2110X+ 4120,r2= 0.9992)。以信噪比为3计算,茄尼醇的检测限为7.65 ng/mL,远低于实际烟草样品中茄尼醇含量,说明本方法的灵敏度较高。
2.2 回收率和重复性
称取50 mg相同烤烟粉末样品10份,分成2组,一组5份。其中一组按照1.3、1.4的实验条件平行测定5次,计算方法的重复性,另外一组样品分别加入0.68 mg的茄尼醇对照品,根据标样加入量、加标前后样品的测定量计算回收率。结果表明,茄尼醇的精密度测定 RSD为 2.62%,回收率为91.1%,说明本方法的准确性较高,重复性较好。
2.3 稳定性实验
取同批次供试品溶液,按上述测定方法在0、1、4、8、12、24 h分别测定1次,测得茄尼醇峰面积的RSD为0.6%,表明提取样品溶液在24 h内稳定性好。
2.4 最佳操作条件的选择
2.4.1 流动相及检测波长选择 考虑到茄尼醇的低极性,在反相色谱柱上分别考察了以不同比例的乙腈-异丙醇、乙腈、甲醇作为流动相时茄尼醇的分离情况。结果表明,茄尼醇在乙腈:异丙醇体积比为83:17和100%甲醇作为流动相的时候都得到了良好的色谱分离。与乙腈-异丙醇流动相比较,甲醇作为流动相不仅信噪比高、分离时间短,且甲醇毒性较低,因此选择 100%甲醇作为流动相。经全波长扫描,知茄尼醇最佳吸收波长在200 nm左右。实验选取波长范围为199~213 nm、间隔2 nm的多通道检测方式,比较茄尼醇在不同检测波长下的吸光度值,同时比较各波长条件下的基线噪音干扰因素。结果表明,207 nm为茄尼醇最佳的检测波长。
2.4.2 流速及柱温选择 比较了流速分别为 0.2,0.4,0.6 mL/min时茄尼醇的出峰分离情况。综合考虑流速和柱压对检测物质峰形和色谱柱寿命的影响,确定选择检测流速为0.4 mL/min,此时茄尼醇的色谱保留时间为2.49 min,柱压正常。在该流速下每个样品在5 min内即可完成色谱分离。考察色谱柱在 23、30、35、40 ℃柱温条件下样品的分离情况。结果表明,温度对茄尼醇色谱分离的影响较小,确定最佳的柱温条件为30 ℃。
2.4.3 共流出物干扰峰检测 实验采用纯甲醇进行提取前处理和进行色谱分离,使极性很弱的茄尼醇在2.49 min即洗脱下来,但这样强的洗脱能力同样可能会使样品中的其他物质的出峰时间缩短,可能导致与茄尼醇性质类似的非极性物质与茄尼醇共流出,从而对茄尼醇的测定造成干扰。为排除这种可能性,采用定性能力强的四级杆串联飞行时间质谱(Q-TOF)对茄尼醇标准品和样品进行了对比分析。
在大气压化学电离源(APCI),正离子模式下,采用茄尼醇标准品不经液相色谱柱分离,直接进样的方式,使用TOF MS对茄尼醇的质谱分析条件进行了优化,结果表明在1.4的质谱条件下茄尼醇响应最高。实验采用1.3和1.4的分析条件分别对茄尼醇标准品和烟叶样品进行分析,由二者扣除各自基线背景的质谱图(图 1)看出,二者质谱图的特征离子峰一致,都是以m/z为613.57的离子峰为基峰,另外还存在丰度较低的m/z为631.58的离子峰。
采用 MassLynx 4.1质谱软件对分子式进行推测,得知m/z为613.57的离子峰的分子式为C45H73,是茄尼醇(C45H74O)失去一个H2O分子的加氢离子峰([M-H2O+H]+离子),m/z为631.58的分子式为C45H75O,是茄尼醇分子的加氢离子峰([M+H]+离子)。由此可知,在APCI正离子分析模式下,茄尼醇的羟基不稳定,大部分极易失水脱去而形成脱水加氢离子峰,仅一小部分形成加氢离子峰。由此确定采用1.3的色谱条件可以使样品中的茄尼醇完全从基质中分离出来,未受到共流出杂质的干扰,分离效果良好。

图1 茄尼醇标样和烟样质谱图Fig.1 APCI-TOF MS spectra of solanesol of standard sample and tobacco sample
2.5 前处理条件优化
2.5.1 提取溶剂的选择 实验选取甲醇、乙醇、丙酮3种萃取溶剂,根据1.2的样品制备方法,称取同一烤烟样品9份,分成3组,分别加入25 mL甲醇、乙醇、丙酮进行提取。结果表明,使用乙醇、丙酮作为萃取溶剂时,其提取液在茄尼醇出峰位置都存在另一化合物的干扰峰(图2),严重干扰茄尼醇的定性和定量检测。为进一步验证干扰物质是否来自提取溶剂的差异,改用异丙醇:乙腈体积比为17:83的有机试剂作为流动相,对上述甲醇、乙醇、丙酮处理后的样品进行色谱分离,分析结果类似于图2。因此,选取甲醇作为最佳提取溶剂。

图2 萃取溶剂分别为甲醇、乙醇、丙酮的茄尼醇色谱图Fig.2 Chromatogram of solanesol using methanol, alcohol,acetonie as extracting solvent respectively
2.5.2 超声提取时间选择 根据1.2的样品制备方法,称取同一烤烟样品8份,分为4组,按1.2的超声萃取条件,分别考察了超声时间为 5,10,20和30 min时茄尼醇的提取情况。结果发现,萃取5,10,20和30 min茄尼醇含量分别为11.50、12.64、12.48、12.22 µg/g,此说明当提取时间为10 min时,提取液已达到溶解平衡。因此,确定超声提取时间为10 min。
2.6 烟草样品中茄尼醇分析
采用比较标准与样品质谱图、保留时间定性,外标法定量,分别对不同的烤烟、晾晒烟、香料烟样品进行了检测分析,结果见表1。
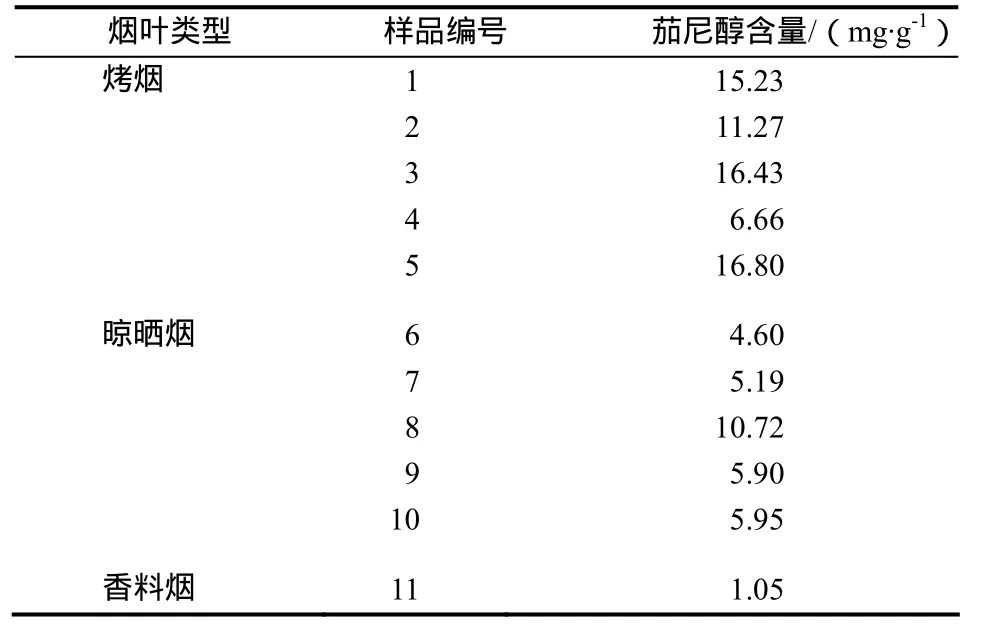
表1 3种不同类型烟草中茄尼醇含量Table 1 The contents of solanesol in the extract of 3 different tobacco leaves
3 结 论
反相高效液相色谱法是检测烟叶茄尼醇含量的主要手段,但实际操作中依然存在分析时间长、流动相用量大,前处理复杂、流动相与萃取溶剂存在差异影响定量等问题。本研究优化了样品前处理,对样品检测条件进行了比较分析,采用四级杆串联飞行时间质谱(Q-TOF)对共流出物的干扰峰进行了排除,建立了将烟叶样品用甲醇萃取后直接使用UPLC进行分析的快速检测方法。该方法简便快速、结果准确,适用于烟叶中游离茄尼醇含量的快速批量分析。
[1]Rowland R L, Latimer P H, Giles J A.Flue-cured tobacco.I.Isolation of solanesol, an unsaturated alcohol[J].J.Am.Chem.Soc., 1956, 78: 4680-4683.
[2]Alejandro Ruiz-Rodriguez, Maria-Ros´ario Bronze,Manuel Nunes da Ponte.Supercritical fluid extraction of tobacco leaves: A preliminary study on the extraction of solanesol [J].J of Supercritical Fluids, 2008, 45:171-176.
[3]周华英,晏琼,刘春朝.烟草中茄尼醇分离纯化研究进展[J].天然产物研究与开发,2007,19:574-577.
[4]李春英,赵春建,祖元刚.气相色谱法测定茄尼醇中有机溶剂残留量[J].应用化学,2009,26(3):364-366.
[5]陈爱国,申国明,梁晓芳,等.茄尼醇的研究进展与展望[J].中国烟草科学,2007,28(6):44-48.
[6]陈燕梅,刘财清,陈建民.一种同时提取烟草中茄尼醇和烟碱并测定其含量的简便方法[J].中国烟草科学,2009,30(2):71-73.
[7]严冲,陈尚卫,王建新.反相HPLC同时测定茄尼醇和茄尼溴的含量[J].化学研究与应用,2008,20(5):573-576.
[8]童康琼,兰明蓉,赵云飞,等.高效液相色谱法测定烟叶中的总茄尼醇[J].烟草科技,2008(3):49-52
[9]马君义,张继,柳国学,等.反相高效液相色谱法测定马铃薯茎叶废弃物中的茄尼醇含量[J].西北师范大学学报:自然科学版,2009,45(4):72-75.
[10]Zhou H Y, Liu C Z.Microwave-assisted extraction of solanesol from tobacco leaves[J]. Journal of Chromatography A, 2006, 1129: 135-139.
[11]Machado P A, Fu H, Robert J.et al.Recovery of solanesol from tobacco as a value-added byproduct for alternative applications[J].Bioresource Technology, 2010, 101:1091-1096.
[12]黄翼飞,李峰,马青.液相色谱-大气化电离离子肼质谱法测定烟草中的游离茄尼醇[J].分析实验室,2009,28(11):84-87.
[13]李春英,赵春建,祖元刚.高效液相色谱法同时测定烟叶中茄尼醇和辅酶Q10的含量[J].应用化学,2006,23(5):524-527.
[14]王婷,许激扬,赵芳.反相高效液相色谱法测定烟叶提取物中茄尼醇含量[J].食品与药品,2009,9(4):18-19.
[15]武永昆,张征,苏鹏娟,等.反相高效液相色谱法测定烟叶中茄尼醇的含量[J].云南民族大学学报:自然科学版,2005,14(3):275-277.

