Cr(Ⅵ)对肝细胞线粒体ATP酶6和ATP酶8基因表达的影响以及与能量代谢障碍的关系
邹悦,钟才高,曾明,刘新民,肖芳,李鹏,杨渊
(中南大学公共卫生学院卫生毒理学系,湖南长沙410078)
Cr(Ⅵ)对肝细胞线粒体ATP酶6和ATP酶8基因表达的影响以及与能量代谢障碍的关系
邹悦,钟才高,曾明,刘新民,肖芳,李鹏,杨渊
(中南大学公共卫生学院卫生毒理学系,湖南长沙410078)
目的探讨Cr(Ⅵ)对肝细胞线粒体ATP酶6和ATP酶8基因表达水平与能量代谢的影响及其相互联系。方法用Cr(Ⅵ)2,8和32 μmol·L-1分别处理体外培养的人胚L-02肝细胞24 h后,用细胞总RNA提取试剂盒分离RNA,线粒体ATP酶6和ATP酶8 mRNA表达水平用逆转录-荧光定量聚合酶链反应(qRT-PCR)测定;细胞ATP含量、线粒体呼吸链复合体酶Ⅴ活性与细胞活性氧(ROS)含量分别用化学发光法、紫外分光光度法和荧光分光光度法检测。结果与正常对照组相比,Cr(Ⅵ)2,8和32 μmol·L-1使ROS显著升高(P<0.05);与正常对照组相比,Cr(Ⅵ)2 μmol·L-1可使ATP酶6和ATP酶8基因表达水平增高(P<0.05),Cr(Ⅵ)8和32 μmol·L-1使之明显降低(P<0.05);而呼吸链复合体酶Ⅴ活性及细胞内ATP含量均随Cr(Ⅵ)浓度的增加而显著降低(P<0.05)。ATP酶6和ATP酶8基因表达与呼吸链复合体酶Ⅴ活性及细胞内ATP含量呈正相关(r=0.858,0.795,0.809,0.766,P<0.01),与ROS水平呈负相关(r=-0.738,-0.801,P<0.01)。结论Cr(Ⅵ)能诱导肝细胞ATP酶6和ATP酶8基因表达水平改变,导致线粒体呼吸链复合体酶Ⅴ活性及细胞内ATP含量降低。
铬;肝细胞;线粒体;能量代谢;腺苷三磷酸酶类
随着铬及其化合物在近代工业中的生产与应用,铬的生物损害已引起高度重视。六价铬〔hexavalent chromium,Cr(Ⅵ)〕具有潜在的肝毒性和致癌性。研究发现Cr(Ⅵ)可使肝出现明显的形态和功能异常,诱导人和小鼠细胞的恶性转化,并与肺癌的发生有关[1-3]。Cr(Ⅵ)通过细胞膜表面的非特异性阴离子通道(SO42-/HPO4
2-)进入细胞,在细胞内逐步还原为Cr(Ⅴ),Cr(Ⅳ)与Cr(Ⅲ),并产生大量的活性氧簇(reactive oxygen species,ROS),引发细胞氧化损伤,形成Cr-DNA加合物、DNA-蛋白质交联及DNA-DNA交联[4],DNA转录和翻译过程受阻,进而影响蛋白质等生物大分子的活性。肝是机体物质代谢和能量代谢的重要器官,而线粒体是肝细胞进行能量代谢的重要场所,通过氧化磷酸化合成ATP,为生命活动提供能量。线粒体能量代谢过程受线粒体膜通透性转运孔(mitochondrial permeabilitytransition pore,MPTP)开放度、膜电位、呼吸链复合体酶活性、线粒体DNA功能及结构的完整性等多种因素的影响[5-6]。线粒体呼吸链复合体酶Ⅴ,又称F1F0-ATP酶,在肝组织中含量丰富,F1F0-ATP酶广泛分布于线粒体内膜,由16个亚基组成[7-8],其中由线粒体DNA编码的ATP酶6和ATP酶8亚基与细胞能量代谢关系密切。ATP酶6和ATP酶8基因的损伤可导致线粒体ATP合成障碍、能量代谢紊乱。本研究测定了不同浓度Cr(Ⅵ)处理的L-02肝细胞线粒体ATP酶6和ATP酶8基因表达、细胞内ATP含量、线粒体呼吸链复合体酶Ⅴ活性及ROS水平的变化,并分析它们之间的相互关系,为进一步探索Cr(Ⅵ)所致线粒体能量代谢障碍的分子机制提供实验依据。
1 材料与方法
1.1 细胞
人胚肝细胞系L-02(L-02肝细胞)购自上海中科院细胞培养中心。
1.2 试剂和仪器
重铬酸钾(K2Cr2O7),购自美国Sigma公司;RPMI 1640培养基,购自美国Solarbio公司;新生牛血清购自杭州四季青公司;噻唑蓝(MTT),购自美国Ameresco公司;细胞总RNA提取试剂盒和cDNA第一链合成试剂盒购自美国Fermentas公司;2×Taq PCR MasterMix和SYBR Green-RealMasterMix,购自北京天根公司;线粒体呼吸链复合物Ⅴ活性比色法定量检测试剂盒购自美国Genmde公司;ATP检测试剂盒和细胞ROS检测试剂盒购自南京碧云天公司。
HH·CP-T型CO2培养箱为上海一恒科技有限公司产品;TGL-20M高速冷冻离心机为长沙平凡仪表有限公司产品;Varioskan Flash3001多功能酶标仪为美国Thermo-Fisher公司产品;Mastercycler Realplex 2荧光定量PCR仪为德国Eppendorf公司产品。
1.3 L-02肝细胞培养和Cr(Ⅵ)浓度确定
按常规细胞培养法培养L-02肝细胞,所用培养基为含10%新生牛血清的RPMI 1640培养基,置于37℃,5%二氧化碳培养箱中培养,每2~3 d用0.25%胰酶进行消化,并传代1次。
用MTT法测定细胞存活率。取对数生长期细胞,胰酶消化后制成单细胞悬液,调整细胞密度为5×106L-1,以每孔100 μl接种于96孔板,置37℃,5%CO2,饱和湿度环境下培养。设Cr(Ⅵ)2,4,8,16,32,64和128 μmol·L-1组和1个空白对照组,处理24 h后,加入10 μl MTT溶液5 g·L-1,继续培养4 h,每孔加入甲臜裂解液100 μl,培养箱内继续孵育6 h,震荡5 min,于波长492 nm处用酶标仪测定吸光度(absorbance,A),按下式计算细胞存活率:细胞存活率(%)=A处理组/A对照组×100%。
根据细胞存活率结果,选择细胞存活率大于70%的Cr(Ⅵ)2,8和32 μmol·L-1为后续实验浓度,处理时间24 h。
1.4 细胞内活性氧水平检测
取对数生长期细胞,接种于6孔板中,不同浓度Cr(Ⅵ)处理24 h后,收集细胞。1∶1000用无血清培养基稀释荧光探针DCFH-DA,终浓度为10 μmol·L-1,收集细胞后悬浮于已稀释的DCFH-DA中,细胞密度2×109L-1,37℃孵育30 min,每5 min混匀1次。用无血清培养基洗涤3次。激发波长488 nm,发射波长525 nm处,荧光酶标仪检测各组荧光强度。
1.5 线粒体ATP酶6和ATP酶8基因表达水平检测
根据GenBank DNA序列数据库中的人类线粒体基因全序列应用Whitehead生物医学研究所的www primer picking software(引物3)进行引物设计。β-肌动蛋白作为内对照,引物设计如下。
ATP酶6(613 bp)上游引物:5'-CTGTTCGCTTCATTCATTGC-3';下游引物:5'-TTAAGGCGACAGCGATTTCT-3';ATP合成酶8(170 bp)上游引物:5'-ATGGCCCACCATAATTACCC-3';下游引物:5'-GCAATGAATGAAGCGAACAG-3';β-肌动蛋白(318 bp)上游引物:5'-ATCATGTTTGAGACCTTCAACA-3';下游引物:5'-CATCTCTTGCTCGAAGTCCA-3'。
1.5.1 细胞总RNA提取和逆转录合成cDNA
按细胞总RNA提取试剂盒的说明书要求操作,分离RNA的有关物品均以焦碳酸二乙酯浸泡,高温高压消毒处理。提取细胞总RNA后,立即用RevertAid First Strand cDNA Synthesis Kit进行逆转录反应。逆转录反应条件为42℃60 min,70℃5 min。
1.5.2 PCR及荧光定量PCR(qRT-PCR)测定ATP酶6和ATP酶8基因相对表达水平
经逆转录生成的cDNA模板分别用ATP酶6和ATP酶8特异性引物进行普通PCR及qPCR反应扩增,并以β肌动蛋白作为内参照,PCR标准反应体系总体积为25 μl,扩增条件:94℃预变性4 min,94℃变性35 s,55℃退火35 s,72℃延伸45 s,反应35个循环,72℃延伸10 min。对PCR产物进行琼脂糖凝胶电泳检测,紫外灯下观察,凝胶成像系统成像分析,证实特异性地扩增出ATP酶6和ATP酶8目的基因。ATP酶6和ATP酶8基因相对表达水平以目的基因与内参基因灰度值比值表示。qPCR标准反应体系25 μl,扩增条件:95℃预变性10 min,94℃变性30 s,55℃退火30 s,72℃延伸40 s,共40个循环。参考文献[9]的方法计算Cr(Ⅵ)组ATP酶6和ATP酶8基因相对表达水平。
1.6 线粒体呼吸链复合体酶Ⅴ活性的测定
[10]的方法从L-02肝细胞中提取线粒体,收集各Cr(Ⅵ)处理组细胞,细胞量约4×107L-1,加入缓冲液A(mmol·L-1:蔗糖250,HEPES 2,EGTA 0.1,pH 7.4)悬浮细胞,将细胞悬液转移至玻璃匀浆器中匀浆5 min,4℃600×g离心10 min,收集上清4℃7000×g离心10 min,弃上清,缓冲液A悬浮沉淀,4℃7000×g离心10 min,所得沉淀即为线粒体,所有步骤均在冰上操作。采用Bradford法[11]测定线粒体蛋白浓度,调整各处理组待测线粒体蛋白浓度为0.1 g·L-1。按照GENMED线粒体呼吸链复合物Ⅴ活性光谱法定量检测试剂盒说明书实验步骤操作。于340 nm处测定各组吸光度(absorbance,A340nm),间隔30 s,记录5 min内A值的变化。肝细胞线粒体呼吸链复合体酶Ⅴ活性=〔(A样品-A背景)×样品稀释倍数〕/〔0.1(样品容量;ml×6.22)〕/线粒体蛋白浓度。酶活性单位为mmol·min-1·g-1蛋白。
1.7 细胞ATP含量测定
将处于对数生长期的L-02肝细胞,接种于6孔板中,分别以Cr(Ⅵ)0,2,8和32 μmol·L-1处理24 h,每孔加入200 μl裂解液,4℃下12 000×g离心10 min,取上清,用于后续测定。向96孔板检测孔中,每孔加入100 μl ATP检测工作液,室温放置3~5 min;每孔加入50 μl样品或标准品,迅速混匀并用Luminometer测定相对光单位(relative light unit,RLU)值,根据标准曲线计算出样本中ATP的含量。
1.8 统计学分析
2 结果
2.1 Cr(Ⅵ)对L-02肝细胞存活率的影响
由图1可见,L-02肝细胞存活率随Cr(Ⅵ)处理浓度升高而降低,存在明显的浓度-效应关系,两者呈显著负相关(r=-0.888,P<0.05)。

Fig.1 Effect of Cr(Ⅵ)on L-02 hepatocyte survival rate.L-02 hepatocytes were plated in 96-well plates at the density of 5×106L-1 and incubated for 24 h.Cell viability was determined by MTT assay after treatment with Cr(Ⅵ)for another 24 h.Survival rate(%)=A492nmin test group/A492nmin negative control group×100%.±s,n=6.
2.2 Cr(Ⅵ)对L-02肝细胞氧化应激的影响
如表1所示,Cr(Ⅵ)处理24 h后,各处理组肝细胞ROS水平随染毒浓度增加均有不同程度的增高,荧光强度逐渐增大,其中Cr(Ⅵ)8和32 μmol·L-1组细胞内ROS水平与对照组比较显著增高(P<0.05)。Cr(Ⅵ)浓度与肝细胞内ROS水平之间存在明显正相关(r=0.993,P<0.05)。

Tab.1 Effect of Cr(Ⅵ)on reactive oxygen species(ROS)level in L-02 hepatocytes
2.3 Cr(Ⅵ)对L-02肝细胞线粒体编码基因ATP酶6和ATP酶8 mRNA表达水平的影响
2.3.1 RT-PCR法考察Cr(Ⅵ)对ATP合成酶6和ATP合成酶8基因表达的影响
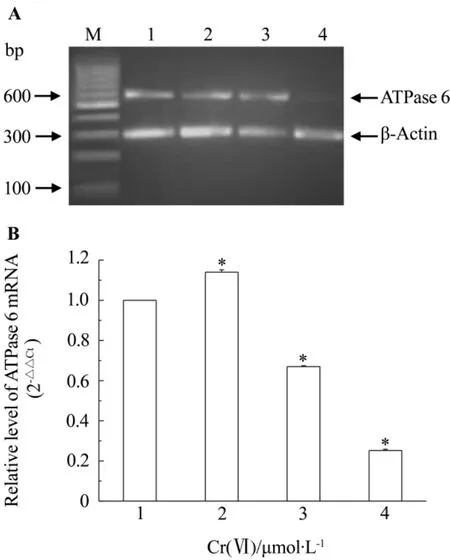
Fig.2 Agarose gel electrophoresis of ATPase 6 mRNA by RT-PCR in L-02 hepatocytes treated with Cr(Ⅵ)for 24 h.A:total cellular RNA was isolated from L-02 hepatocytes and reverse transcription of RNA was done in a final volume of 20 μl.B:semiquantitative result of A.M:marker;1:normal control;2-4:Cr(Ⅵ)2,8 and 32 μmol·L-1,respectively.±s,n=3.*P<0.05,compared with normal control group.

Fig.3 Agarose gel electrophoresis of ATPase 8 mRNA by qRT-PCR in L-02 hepatocytes treated with Cr(Ⅵ)for 24 h.A:total cellular RNA was isolated from L-02 hepatocytes and reverse transcription of RNA was done in a final volume of 20 μl.B:semiquantiative result of A.M:marker;lane 1:control group;lane 2-4:Cr(Ⅵ)2,8 and 32 μmol·L-1,respectively.±s,n=3.*P<0.05,compared with normal control group.
图2和图3结果表明,应用肝细胞总RNA逆转录产物cDNA作为模板,对ATP酶6和ATP酶8基因进行PCR扩增反应,经凝胶成像系统分析,证实PCR产物分别为ATP酶6和ATP酶8基因片段。正常对照组ATP酶6和ATP酶8基因mRNA有一定程度的表达,与正常对照组比较,随Cr(Ⅵ)浓度的增加,二者表达水平呈先增加后减少的趋势,Cr(Ⅵ)2,8和32 μmol·L-1组ATP酶6和ATP酶8 mRNA表达显著升高(P<0.05),但Cr(Ⅵ)2 μmol·L-1组ATP酶6和ATP酶8 mRNA表达最高,而Cr(Ⅵ)8和32 μmol·L-1组相应表达随剂量降低。
2.3.2 qRT-PCR法考察Cr(Ⅵ)对ATP酶6和ATP酶8基因表达的影响
由表2所示,Cr(Ⅵ)0,2,8和32 μmol·L-1,线粒体ATP酶6和ATP酶8基因表达均呈现先增强后减弱的趋势,其中Cr(Ⅵ)2 μmol·L-1组ATP合成酶6基因表达水平为正常对照组的1.45倍,Cr(Ⅵ)8和32 μmol·L-1组ATP酶6基因表达水平分别为对照组的25%和5%(P<0.01),Cr(Ⅵ)2 μmol·L-1ATP酶8基因表达水平为正常对照组的2.54倍,Cr(Ⅵ)8和32 μmol·L-1组ATP酶8基因表达水平分别为正常对照组的42%和26%(P<0.01)。

Tab.2 Effect of Cr(Ⅵ)on ATPase 6 and ATPase 8 mRNA expression in L-02 hepatocytes
2.4 Cr(Ⅵ)对L-02肝细胞线粒体复合体酶Ⅴ活性及ATP含量的影响
由表3可知,随着Cr(Ⅵ)0,2,8和32 μmol·L-1浓度增高,线粒体复合体酶Ⅴ活性有逐渐降低的趋势,与正常对照组(1.37±0.16)mmol·min-1·g-1蛋白相比,Cr(Ⅵ)2,8和32 μmol·L-1组复合体酶Ⅴ活性显著降低,分别为1.27±0.23,0.92±0.08和(0.58±0.02)mmol·min-1·g-1蛋白(P<0.05,P<0.01);而与正常对照组(13.78±0.48)μmol·g-1蛋白相比,Cr(Ⅵ)2,8和32 μmol·L-1组肝细胞ATP含量显著降低,分别为9.00±0.23,6.33±0.09和(4.69±0.10)mmol·g-1蛋白(P<0.01)。
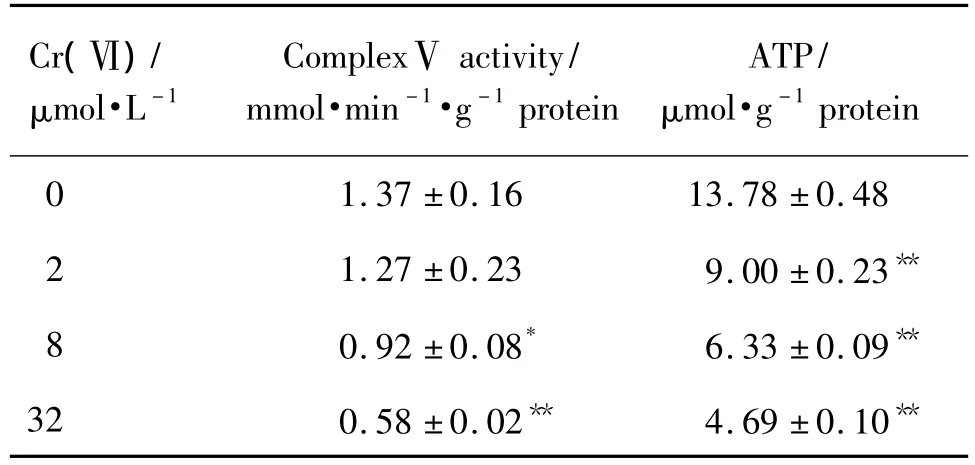
Tab.3 Effects of Cr(Ⅵ)on complexⅤand ATP in L-02 hepatocyte
2.5 肝细胞线粒体ATP酶6和ATP酶8基因mRNA表达水平与ATP含量、ROS水平及复合体酶Ⅴ活性的相关分析
由表4所见,在Cr(Ⅵ)0~32 μmol·L-1范围,L-02肝细胞线粒体ATP酶6和ATP酶8基因表达与复合体酶Ⅴ活性及ATP含量均呈正相关,相关系数分别为0.858,0.795和0.809,0.766(P<0.01),与ROS含量均呈负相关,相关系数分别为-0.738和-0.801(P<0.01)。

Tab.4 Correlation coefficients between ATPase 6 and ATPase 8 genes expression levels wth energy metabolism and oxidative damage
3 讨论
线粒体是细胞的能源中心,是化学毒物诱导细胞毒性最为敏感的细胞器,其能量代谢障碍是许多化学毒物毒性的生物效应学标志[12]。Cr(Ⅵ)对细胞的损害作用主要取决于Cr(Ⅵ)还原过程中产生的ROS对细胞生物大分子如RNA、DNA、蛋白质和脂质等的氧化损伤以及Cr(Ⅵ)还原产物与DNA形成加合物造成的遗传学损伤[13-14]。mtDNA是唯一存在于细胞核以外的遗传物质,编码区共37个基因,其中与线粒体氧化磷酸化有关的13个基因所编码的蛋白质均是线粒体呼吸链各亚单位的组成部分[15]。mtDNA直接暴露于氧化磷酸化过程产生的ROS中,加之缺乏组蛋白和其他结合蛋白的保护以及没有完善的损伤修复系统,致使mtDNA对氧化损伤有较高的敏感性,与细胞核DNA相比其突变率更高[16]。本研究发现,随着Cr(Ⅵ)浓度的增大,细胞内ROS水平明显增高,而肝细胞线粒体ATP酶6和ATP酶8基因表达水平下降,二者呈负相关。Sánchez-Alcázar等[17]也发现肿瘤坏死因子α通过诱导L-929细胞产生大量ROS,导致ATP酶6和ATP酶8基因转录水平下调。用甘氨鹅脱氧胆酸处理L-02肝细胞,结果显示过量ROS的产生能导致mtDNA基因表达的改变和线粒体功能障碍[18]。Cr(Ⅵ)引起的细胞内ROS水平的增高具有浓度和时间依赖性[19],ROS可攻击mtDNA导致其断裂,破坏mtDNA结构和功能的完整性,从而影响下游的转录和翻译过程,这可能是Cr(Ⅵ)引起ATP酶6和ATP酶8基因表达水平发生改变的原因之一。
线粒体呼吸链复合体酶Ⅴ,即F1F0-ATP酶,是线粒体进行氧化磷酸化和水解ATP的关键酶,ATP酶6和ATP酶8基因编码F1F0-ATP酶复合物的F0部分,主要参与ATP的生成,对于维持肝细胞线粒体能量代谢十分重要,但ATP酶6和ATP酶8基因保守性低,容易发生突变[20],继之可引起基因转录水平的改变。研究表明,mtDNA编码基因表达水平的改变会引起线粒体功能障碍[6]。本研究中,Cr(Ⅵ)2 μmol·L-1可上调ATP酶6和ATP酶8基因mRNA表达,但Cr(Ⅵ)8和32 μmol·L-1使ATP酶6和ATP酶8基因的表达显著降低。可能是因为低浓度的Cr(Ⅵ)诱导mtDNA的损伤,促使mtDNA拷贝数代偿性增多[21],或通过核基因编码的线粒体转录因子A的代偿性调控使mtDNA表达增强,ATP酶6和ATP酶8基因表达上调,当Cr(Ⅵ)浓度超过某一水平时,对mtDNA表达的抑制作用超出了细胞代偿性调节的能力,ATP酶6和ATP酶8基因的表达下调。对乙醇毒性效应的研究显示,乙醇可以降低mtDNA编码的线粒体ATP酶的表达,损伤线粒体功能,进而影响ATP的产生[22]。Dey等[23]发现,经Cr(Ⅵ)处理后,总ATP酶和Na+,K+-ATP酶的活性都明显受到抑制。本研究中随着Cr(Ⅵ)浓度的增高细胞F1F0-ATP酶活性呈降低的趋势,并以Cr(Ⅵ)32 μmol·L-1组降低最为明显,同时各Cr(Ⅵ)处理组细胞内ATP含量均显著降低,提示Cr(Ⅵ)可引起ATP合成酶6和ATP合成酶8基因转录过程改变或受阻,ATP酶6和ATP酶8表达下降,导致F1F0-ATP酶活性降低,引起F0质子通道障碍,阻碍了线粒体内膜外质子通过F0质子通道的流回,影响ADP磷酸化形成ATP,导致ATP合成减少。相关分析结果显示,ATP酶6和ATP酶8表达水平与F1F0-ATP酶活性及ATP含量之间存在负相关关系,表明线粒体能量代谢障碍与ATP酶6和ATP酶8基因表达之间存在联系。本研究还发现ATP酶6表达水平较ATP酶8降低更为明显,这反映出氧化应激引起线粒体F1F0-ATP酶亚单位基因表达改变的强度不同。Li等[24]用不同浓度的过氧化氢处理肠上皮细胞,ATP酶6的mRNA表达明显降低,而ATP酶8的mRNA表达无明显改变,提示线粒体F1F0-ATP酶亚单位基因表达对氧化应激的敏感性存在差异。另外,值得注意的是Cr(Ⅵ)2 μmol·L-1组ATP酶6和ATP酶8 mRNA表达增高但F1F0-ATP酶活性降低,揭示低浓度的Cr(Ⅵ)虽然使ATP酶6和ATP酶8基因表达增强,但蛋白的合成过程可能受阻,导致蛋白合成减少,F1F0-ATP酶活性或数量降低,无法合成足够的ATP以满足细胞的能量需求。
目前关于Cr(Ⅵ)引起细胞能量代谢障碍的分子机制研究,主要关注于Cr(Ⅵ)对核DNA的影响,对线粒体DNA的损伤以及转录翻译水平影响的报道较少。Cr(Ⅵ)所致的线粒呼吸链蛋白亚基表达水平的变化与细胞能量代谢紧密相连,既受到mtDNA的影响又受核DNA调控。要全面阐明Cr(Ⅵ)影响细胞能量代谢的分子机制,还有待进一步的实验研究。
参考文献:
[1]Zeng M,Wang XP,An FY,Gao ZX,Wang A.An experimental study on the toxic liver and renal damage induced by chromium[J].China Public Health(中国公共卫生),1999,15(10):869-870.
[2]Patierno SR,Banh D,Landolph JR.Transformation of C3H/10T1/2 mouse embryo cells to focus formation and anchorage independence by insoluble lead chromate but not soluble calcium chromate:relationship to mutagenesis and internalization of lead chromate particles[J].Cancer Res,1988,48(18):5280-5288.
[3]Zhitkovich A.Chromiumin drinking water:sources,metabolism,and cancer risks[J].Chem Res Toxicol,2011,24(10):1617-1629.
[4]Valko M,Morris H,Cronin MT.Metals,toxicity and oxidative stress[J].Curr Med Chem,2005,12(10):1161-1208.
[5]Pramanik KC,Boreddy SR,Srivastava SK.Role of mitochondrial electron transport chain complexes in capsaicin mediated oxidative stress leading to apoptosis in pancreatic cancer cells[J].PLoS One,2011,6(5):e20151.
[6]Ballinger SW,Patterson C,Yan CN,Doan R,Burow DL,Young CG,et al.Hydrogen peroxide-and peroxynitriteinduced mitochondrial DNA damage and dysfunction in vascular endothelial and smooth muscle cells[J].Circ Res,2000,86(9):960-966.
[7]Guerrieri F,Kalous M,Adorisio E,Turturro N,Santoro G,Drahota Z,et al.Hypothyroidism leads to a decreased expression of mitochondrial F0F1-ATP synthase in rat liver[J].J Bioenerg Biomembr,1998,30(3):269-276.
[8]Walker JE,Collinson IR.The role of the stalk in the coupling mechanism of F1F0-ATPases[J].FEBS Lett,1994,346(1):39-43.
[9]Livak KJ,Schmittgen TD.Analysisof relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(4):402-408.
[10]Frezza C,Cipolat S,Scorrano L.Organelle isolation:functional mitochondria from mouse liver,muscle and cultured fibroblasts[J].Nat Protoc,2007,2(2):287-295.
[11]Bradford MM.Arapidand sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[12]Mingatto FE,Maioli MA,Bracht A,Ishii-Iwamoto EL.Effects of monocrotaline on energy metabolism in the rat liver[J].Toxicol Lett,2008,182(1-3):115-120.
[13]Klaunig JE,Kamendulis LM.Therole of oxidative stress in carcinogenesis[J].Annu Rev Pharmacol Toxicol,2004,44:239-267.
[14]Arakawa H,Wu F,Costa M,Rom W,Tang MS.Sequence specificity of Cr(Ⅲ)-DNA adduct formation in the p53 gene:NGG sequences are preferential adduct-forming sites[J].Carcinogenesis,2006,27(3):639-645.
[15]Spinazzola A.Mitochondrial DNA mutations and depletion in pediatric medicine[J].Semin Fetal Neonatal Med,2011,16(4):190-196.
[16]Tan DJ,Bai RK,Wong LJ.Comprehensive scanning of somatic mitochondrial DNA mutations in breast cancer[J].Cancer Res,2002,62(4):972-976.
[17]Sánchez-Alcázar JA,Schneider E,Hernández-Muñoz I,Ruiz-Cabello J,Siles-Rivas E,de la Torre P,et al.Reactive oxygen species mediate the down-regulation of mitochondrial transcripts and proteins by tumour necrosis factor-alpha in L929 cells[J].Biochem J,2003,370(Pt 2):609-619.
[18]Xu SC,Chen YB,Lin H,Pi HF,Zhang NX,Zhao CC,et al.Damage to mtDNA in liver injury of patients with extrahepatic cholestasis:the protective effects of mitochondrial transcription factor A[J].Free Radic Biol Med,2012,52(9):1543-1551.
[19]Bagchi D,Stohs SJ,Downs BW,Bagchi M,Preuss HG.Cytotoxicity and oxidative mechanisms of different forms of chromium[J].Toxicology,2002,180(1):5-22.
[20]Lee SH,Lee S,Jun HS,Jeong HJ,Cha WT,Cho YS,et al.Expression of the mitochondrial ATPase 6 gene and Tfam in Down syndrome[J].Mol Cells,2003,15(2):181-185.
[21]Malakhova L,Bezlepkin VG,Antipova V,Ushakova T,Fomenko L,Sirota N,et al.The increase in mitochondrial DNA copy number in the tissues of gamma-irradiated mice[J].Cell Mol Biol Lett,2005,10(4):721-732.
[22]Chu J,Tong M,de la Monte SM.Chronic ethanol exposure causes mitochondrial dysfunction and oxidative stress in immature central nervous system neurons[J].Acta Neuropathol,2007,113(6):659-673.
[23]Dey SK,Nayak P,Roy S.Alpha-tocopherol supplementation on chromium toxicity:a study on rat liver and kidney cell membrane[J].J Environ Sci(China),2003,15(3):356-359.
[24]Li JM,Zhou H,Cai Q,Xiao GX.Effects of hydrogen peroxide on human mitochondrial gene expression of intestinal epithelial cells[J].Acta Acad Med Mil Tert(第三军医大学学报),2002,24(2):267-270.
Effect of Cr(Ⅵ)on mitochondrial ATPase 6 and ATPase 8 genes expression and its relation with dysfunction of energy metabolism in hepatocytes
ZOU Yue,ZHONG Cai-gao,ZENG Ming,LIU Xin-min,XIAO Fang,LI Peng,YANG Yuan
(Department of Health Toxicology,School of Public Health,Central South University,Changsha410078,China)
OBJECTIVETo explore the correlation between mitochondrial DNA ATPase 6 and ATPase 8 genes expression and dysfunction of energy metabolism in L-02 hepatocytes treated with hexavalent chromium〔Cr(Ⅵ)〕.METHODSL-02 hepatocytes were treated with Cr(Ⅵ)2,8 and 32 μmol·L-1,respectively,for 24 h and then harvested.Total RNA was extracted from L-02 hepatocytes using RNA extraction kit.The quantitative reverse transcription polymerase chain reaction(qRT-PCR)was applied to detect the mRNA levels of ATPase 6 and ATPase 8 genes.The content of ATP was measured by bioluminescence technique.The activity of mitochondrial respiratory chain complexⅤand the level of cellular ROS were determined by ultraviolet spectrophotometry and fluorometric methods,respectively.RESULTSCompared with normal control group,ROS level significantly increased in Cr(Ⅵ)2,8 and 32 μmol·L-1groups.Compared with normal control group,the expression levels of ATPase 6 and ATPase 8 genes in Cr(Ⅵ)2 μmol·L-1group firstly increased(P<0.05),then they gradually decreased in Cr(Ⅵ)8 and 32 μmol·L-1groups,while the activity of mitochondrial respiratory chain complexⅤand cellular ATP level significantly decreased(P<0.05).The relative analysis showed the complexⅤactivity was positively correlated with ATPase 6 and ATPase 8 genes expression levels(r=0.858,0.809,P<0.01),and the cellular ATP level was yet positively correlated with ATPase 6 and ATPase 8 genes expression levels(r=0.795,0.766,P<0.01).But ROS level was negatively correlated with ATPase 6 and ATPase 8 genes expression levels(r=-0.738,-0.801,P<0.01).CONCLUSIONCr(Ⅵ)can induce expression changes in mitochondrial encoding ATPase genes,and this might result in the decrease in the complexⅤactivity and ATP synthesis.
chromium;hepatocytes;mitochondria;energy metabolism;adenosine triphophatases
The project supported by National Natural Science Foundation of China(30972511)
ZHONG Cai-gao,E-mail:zcg54@syxm.net,Tel:(0731)84805461
R995
A
1000-3002(2012)06-0853-07
10.3867/j.issn.1000-3002.2012.06.013
国家自然科学基金(30972511)
邹悦(1986-),女,硕士研究生,主要从事肝脏毒理学研究;钟才高,(1954-),男,教授,博士生导师,主要从事肝脏毒理学研究。
钟才高,E-mail:zcg54@syxm.net,Tel:(0731)84487130
2011-12-26接受日期:2012-04-30)
(本文编辑:付良青)

