冠心病患者血尿酸、氧化修饰低密度脂蛋白水平及其相关性研究*
陈 萍 张 利 杨锐英
(1.泰山医学院附属泰山医院,山东 泰安 271000;2.宁夏医科大学总医院,宁夏 银川 750004)
SAP患者血UA与oxLDL成正相关(r=0.567,P=0.001);ACS患者血UA与oxLDL成正相关(r=0.847,P=0.000)。结论 血UA水平升高可能是CHD的一个危险因素,其可能通过促进氧化应激损伤的增加,导致了CHD的发生发展,且病情愈重其氧化应激损伤愈明显。
研究表明血尿酸(UA)升高和氧化应激与冠心病(CHD)的关系较为密切,部分学者认为它们可能是CHD的危险因素;但少有研究报道血UA升高和氧化应激损伤与CHD严重程度的关系及其相互联系。不同学者对于UA作为CHD的危险因素也持有异议[1-2],而氧化修饰低密度脂蛋白(oxLDL)能够反应氧化应激损伤的程度,因此该研究以CHD患者为观察对象,通过对血清UA、氧化修饰低密度脂蛋白(oxLDL)的检测,了解CHD患者血清UA水平、氧化应激损伤程度及其相互联系,从而探讨血UA升高及氧化应激损伤在CHD发生中的作用。
1 资料与方法
1.1研究对象 2006年3月至2006年8月在宁夏医学院附属医院心血管内科就诊的CHD患者,CHD诊断标准采用1979年WHO的诊断标准,急性冠脉综合征(ACS)30例,男18例,女12例,平均年龄(55.09±12.11)岁;稳定型心绞痛(SAP)30例,男14例,女16例,平均年龄(54.05±10.04)岁;对照组(CO)为同期在该院心血管内科住院的非CHD患者,共30例,其中男16例,女14例,平均年龄(48.73±15.29)岁。所有患者入院后询问吸烟史、饮酒史、高血压、糖尿病等病史,并均排除肝肾功能不全、白血病、多发性骨髓瘤、贫血、甲状腺疾病、感染性疾病、免疫性疾病及肿瘤性疾病等可能影响本研究检测指标的疾病。三组患者在性别、年龄、吸烟、饮酒、合并症等构成比差异无统计学意义(P>0.05),提示三组研究对象具有可比性。
1.2血液标本采集和储存 所有研究对象入院24小时内抽取清晨安静平卧状态下的空腹肘静脉血,置于非抗凝试管中,3000rpm离心15分钟,收集上清液,-70 ℃保存,备测血清UA和oxLDL水平。
1.3检测方法 UA测定采用化学比色法,试剂盒由南京建成生物工程研究所提供;oxLDL测定采用酶联免疫法(ELISA),试剂盒由美国ADL公司提供。操作方法均严格按试剂盒说明书进行。

2 结 果
2.1三组间血UA和oxLDL水平的比较(表1)。
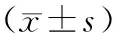
表1 三组间血UA和oxLDL水平的比较
注:与CO组比较,*P<0.05;与SAP组比较,▲P<0.05。
2.2冠心病患者中高尿酸血症与正常血尿酸者oxLDL水平的比较(表2):
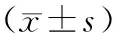
注:NUA为正常血尿酸者,HUA为高尿酸血症,*P<0.05。
2.3相关性分析表明 SAP患者血UA与oxLDL成正相关(r=0.567,P=0.001); ACS患者血UA与oxLDL成正相关(r=0.847,P=0.000)
3 讨 论
目前对于血尿酸作为冠心病的危险因素尚存争议[1-2]。本研究显示:SAP和ACS患者血清UA水平均明显高于CO组,差异有统计学意义(均P<0.05 );我们认为血尿酸升高在冠心病发生发展中扮演着重要的角色,可能是冠心病的危险因素。Rotterdam研究[3]表明:尿酸是心肌梗死和中风的一个强有力的危险因素。其导致冠心病发生的机制,研究认为[4]可能是通过对血栓形成、炎症、氧化型低密度脂蛋白的产生、高尿酸血症时对动脉内膜的损伤和内皮功能的影响,加速动脉粥样硬化和冠心病发生发展。本研究发现ACS组和SAP组相比,血UA水平虽有增高,但差异无统计学意义(P>0.05)。这可能是由于二者发病的病理生理机制不同、有其他因素参与ACS发生机制的缘故。我们知道SAP主要是由于稳定的动脉粥样硬化斑块导致冠状动脉的固定狭窄,当心肌氧耗量增加时心肌供血失代偿而引起;而ACS则主要是由于不稳定斑块在炎症刺激、机械应力、血管内皮功能异常等因素共同作用下破裂,引起急性冠状动脉内血栓形成,从而导致急性事件,而斑块不稳定是其主要始动因素,导致斑块不稳定的因素主要有:脂质含量增加、MMP活性增加、炎症、组织因子活性增强、平滑肌细胞死亡增加、胶原含量减低等[5],而oxLDL被单核/巨噬细胞吞噬后形成泡沫细胞,泡沫细胞死亡后降低斑块的不稳定性,促进冠脉事件的发生。
研究认为oxLDL可以作为冠心病新显现的危险因素[6]。本研究显示:与CO组相比,ACS和SAP组血oxLDL水平均明显增高(P<0.05),与SAP组相比,ACS组血oxLDL水平明显增高(P<0.05);表明氧化应激在冠心病发生中起着一定作用,而且随着冠心病病情的加重,这种氧化应激损伤的程度明显加重。研究认为氧化应激促进动脉粥样硬化主要是通过对脂蛋白的氧化作用和诱导炎性介质基因表达改变来实现的[7]。LDL氧化修饰后生成的oxLDL生物活性发生了明显的改变,可以激活血管内皮细胞使其表达细胞黏附分子,促进炎症细胞的黏附和浸润;巨噬细胞通过清道夫受体大量吞噬oxLDL形成泡沫细胞,而泡沫细胞可增加粥样斑块的脂质含量,使斑块的稳定性降低;oxLDL也能刺激炎性细胞表达基质金属蛋白酶,使纤维帽内的细胞外基质降解,削弱纤维帽的抗损伤程度,增加斑块易损性;oxLDL还能够促进血小板的黏附聚集,从而加速冠心病的发展[8]。
本研究显示,SAP和ACS组高尿酸血症者血oxLDL水平均明显高于正常血尿酸者(P<0.05),相关性分析表明:SAP和ACS患者血UA均与oxLDL成正相关(r分别为0.567、0.847,均P<0.05);进一步表明UA水平愈高则氧化应激损失愈重,而且可能是通过血尿酸水平升高加重了这种氧化应激损伤,从而进一步导致了动脉粥样硬化及冠心病的发生发展。研究认为[9]:高尿酸血症时,尿酸盐结晶可以活化补体,使中性粒细胞受趋化因子作用,活化还原型辅酶Ⅱ等,产生大量自由基;巨噬细胞在吞噬过尿酸盐结晶的程中也产生大量的超氧阴离子,促进LDL的氧化,增加脂质过氧化,导致氧化应激损伤。也有研究认为[10]尿酸具有双重作用:一方面尿酸可以通过阻断硝基化反应过程、防止SOD降解和提高SOD的活性等发挥其内生抗氧化应激作用;而当尿酸水平达到一定程度(女性>360 μmmol/L,男性>390~420 μmmol/L)或合并糖、脂代谢紊乱时,尿酸抗氧化作用可能会变成促氧化作用,并认为在动脉粥样硬化的大血管内膜和局部内皮下毛细血管的间质中,可能存在一个抗氧化剂-促氧化剂氧化还原穿梭。因此,高尿酸血症时尿酸可能主要表现为氧化应激损伤的作用。基于以上分析,本研究考虑血尿酸升高可能通过对氧化应激损伤的影响参与了冠心病的发生发展。
[1] Bickle C,Rupprecht HJ,Blankenberg S,et al.Serum uric as an independent predictor of mortality in patents with angiographically proven coronary artery disease [J].Am J Cardiol,2002,89:12-17.
[2] Jeremy G Wheeler, Kelsey D. M Juzwishin, Gudny Eiriksdottir,et al.Serum Uric Acid and Coronary Heart Disease in 9,458 Incident Cases and 155,084 Controls: Prospective Study and Meta-Analysis [J]. PLoS Med,2005,2:e76.
[3] Bos MJ,Koudstaal PJ,Hofman A,Witteman JC,et al.Uric acid is a risk factor for myocardial infarction and stroke :the Rotterdam study [J].Stroke,2006,37:1503-1507.
[4] Leyva F ,Anlcer S ,Swan JW,et al.Serum uric acid as an index of impaired oxidative metabolism in chronic heart failure[J].Eur Heart J,1997,18:858-865.
[5] 苗阳,雷燕,高铸烨.急性冠脉综合征病理生理研究概况[J].实用心脑肺血管病杂志,2006,14(1):81-82.
[6] Steinberg D,Witztum JL.Is the oxidative modification hypothesis relevant to human atherosclerosis?Do the antioxidant trials conduc-ted to date refute the hypothdsis[J].Circulation,2002,105(17):2107-2111.
[7] Law RE,Goetze S,Xi XP,et al.Expression and function of PPARγ in rat and human vascular smooth muscle cells[J].Circulation,2003,101(11):311-318.
[8] 张廷杰, 叶小平. 高尿酸血症--一个值得关注与探索的问题[J]. 心脑血管病防治,2005,5(3):1.
[9] Hayden MR,Tyaqi SC.Uric acid:A new look at an old risk marker for Cardiovascular disease,metabolic syndrome,and type 2 diabetes mellitus:The urate redox shuttle[J].Nutr Metab(Lond),2004,1(1):10.
[10] Skinner KA,White CR,Patel R,et al.Nitrosation of uric acid by peroxynitrite,formation of a vasoactive nitric oxidedonor[J].J Biol Chem,1998,273(38):491-497.

