两种快速分离检测南方水牛乳乳清蛋白方法的比较
成希飞,李昀锴,向明霞,徐明芳
(广州暨南大学生命科学与技术学院生物工程系,广州 510632)
两种快速分离检测南方水牛乳乳清蛋白方法的比较
成希飞,李昀锴,向明霞,徐明芳
(广州暨南大学生命科学与技术学院生物工程系,广州 510632)
采用了毛细管电泳法(CE)和反相高效液相色谱法(RP-HPLC)两种方法对乳源乳清蛋白进行分离检测。结果表明:两种方法都能够有效分离乳清蛋白中的BSA,α-La,β-Lg,并能对各种蛋白进行定性定量分析。相比而言,毛细管电泳法分离更加快速,整个分离过程7 min左右即可完成,能分离出IgG组分。而RP-HPLC分离时间更长,需要45 min才能完全分离,并且无法分离出IgG组分。
毛细管电泳法;RP-HPLC;牛奶;乳清蛋白
0 引言
水牛乳蛋白和脂肪含量高,还富含锌、铁等矿物质元素,具有脂肪直径大,酸度小,易吸收等特点[1-2]。水牛乳非蛋白氮含量较低,含有寡糖,具有免疫调节作用[3-4]。
近年来高效液相色谱(HPLC)和毛细管电泳(CE)的发展为蛋白质和多肽的分离分析提供了新的手段。CE法在乳蛋白检测[5-6]、遗传变异体及处理方法对乳蛋白含量变化[7]的研究中被广泛应用。唐萍[8]、刘婷[9]等采用柠檬酸缓冲体系对乳蛋白进行研究并取得了较好的结果。HPLC法在氨基酸、多肽、糖类及蛋白质的分离和定量分析上应用广泛,目前RP-HPLC在乳品中的蛋白分离分析、掺假[10-11]、变异体等[12-13]方面已有广泛的研究。
本文采用CE及RP-HPLC两种方法对水牛乳乳清蛋白进行分离检测,并与荷斯坦奶乳清蛋白进行差异性分析。CE法分离效果更好,分离时间更短。
1 实验
1.1 主要仪器、试剂及材料
材料及试剂:荷斯坦鲜牛奶、水牛奶(均为巴氏杀菌奶,市售);α-乳白蛋白(α-lactalbumin,α-La,L6010)、β-乳球蛋白(β-lactoglobulin,β-Lg,L3908)、免疫球蛋白(IgG,HA010,sigma公司)、BSA(纯度≥96%,北京欣普森生物科技有限公司);乙腈及三氟乙酸(色谱纯);Millipor纯水。SDS纯度>99%、聚乙二醇(PEG4000),羟丙基甲基纤维素,其他试剂均为分析纯。
仪器:P/ACE MDQ型毛细管电泳仪;PHS-3C pH计;Agilent 1100型HPLC色谱仪及数据处理平台;KDC-2046型冷冻离心机;CP224C型电子天平。
1.2 方法
1.2.1 乳清蛋白的提取
新鲜牛乳以4 000 r/min(4℃)离心25 min,除去乳脂,吸出清液。用浓度为5 mol/L的HCl调节pH值为4.6,静置30 min,以4 000 r/min(4℃)离心20 min,弃去沉淀,清液0.22 μm滤膜过滤备用。
1.2.2 标准溶液的配制
α-La,β-Lg,BSA,IgG溶于蒸馏水分别配制成终质量浓度为10,9.6,10.1,2.0 g/L的储液,0.22 μm滤膜过滤备用。
1.2.3 缓冲液的配制硼砂电泳缓冲液
质量分数为1.2%硼砂,浓度为1 mol/L硼酸调pH值,定容至25 mL,0.22 μm滤膜过滤备用.
1.2.4 毛细管电泳操作条件
毛细管电泳测定条件:毛细管柱温25℃;检测波长214 nm;压力进样(3.9 KPa),进样时间5 s;运行电压25 kV;柱清洗:每次进样前分别用水洗5 min和缓冲液冲洗3 min。每次分离后用浓度为0.1 mol/L的NaOH冲洗2 min。
1.2.5 反相高效液相色谱条件
Agilent 1100高效液相色谱仪及数据处理平台1100,包括自动进样器、光电二极管阵列检测器(DAD)、柱温箱、进样瓶、涡漩振荡器、针管过滤器、0.45 μm尼龙滤膜;RP-HPLC色谱柱Jupiter C18(250 mm×4.6 mm,5 μm,孔径:300A)。流动相A为体积分数0.1%的三氟乙酸(TFA)水溶液,B为体积分数0.1%的TFA的乙腈溶液。洗脱梯度:0~9 min为3%~35%B;9~18 min为37%~40%B;18~22 min为40%~41%B;22~27.5 min为41%B;27.5~28 min为41%~43%B;28~36 min为43%~45%B;36~40 min为45%~90%B;柱温为20℃,流速为0.8 mL/min,检测波长为214 nm,进样量为20 μL。
2 结果与讨论
2.1 毛细管电泳及RP-HPLC色谱结果
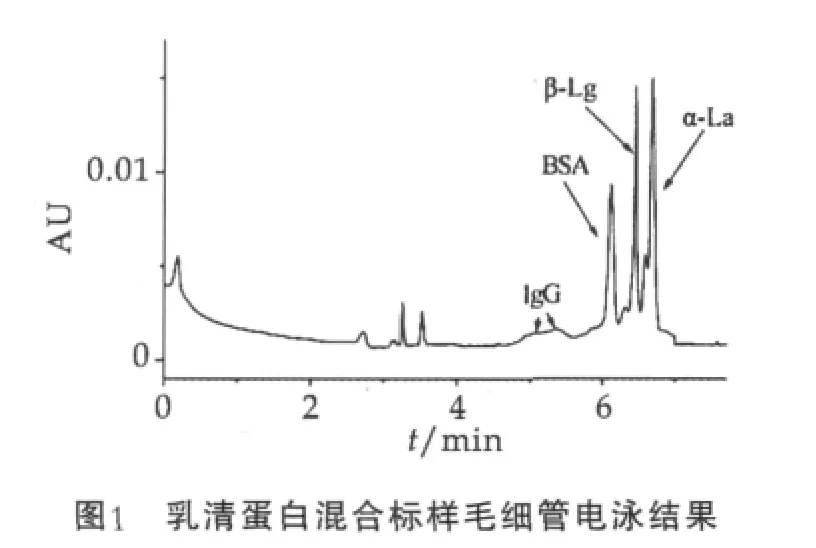
2.1.1 乳清蛋白混合标样毛细管电泳
毛细管电泳条件:电泳缓冲液质量分数为0.2%的SDS,1.2%硼砂,pH值为8.95,电压25 kV,温度25℃。图1为乳清蛋白混合标样毛细管电泳结果。由图1可以看出,本文所采取的毛细管电泳条件可以有效地将乳清蛋白混合标样的各个组分完全分开,出峰顺序依次为IgG,BSA,β-Lg,α-La,且分离效果良好。
2.1.2 RP-HPLC色谱
图2为乳清蛋白混合标样高效液相色谱图。由图2可以看出,在1.2.5色谱条件下,乳清蛋白标样高效液相色谱图出峰蛋白依次为BSA,α-La,β-Lg。最早被洗脱下来的BSA与杂质能完全分离,分离效果较好。结果表明,在该色谱条件下进行乳清蛋白单体的分离是可行的。

2.2 乳源乳清蛋白组分的分离及差异性分析
2.2.1 水牛奶乳清蛋白的毛细管电泳分析
水牛奶含有较高的营养价值,其大多数营养物质比荷斯坦奶牛、人母乳、黄牛奶更丰富,较为适合制作多种优质奶产品。

由图3(a)可以看出,水牛奶乳清蛋白BSA,β-Lg,α-La在该电泳条件下的迁移时间分别为6.19,6.56,6.69 min;IgG的两个迁移时间分别为5.17 min和5.26 min。另外,β-Lg的峰面积大于α-La的峰面积,即β-Lg的含量高于α-La。荷斯坦牛奶乳清蛋白的BSA、β-Lg、α-La的迁移时间为6.11 min、6.31 min、6.43min,IgG的两个迁移时间分别为5.29 min、5.36 min(图3b),β-Lg的峰面积与α-La的峰面积相差极大,即β-Lg的含量远低于α-La的质量浓度,原因可能是在牛奶进行加工时因所采用的处理方法而造成β-Lg蛋白质量浓度的减少。水牛奶乳清蛋白与荷斯坦牛奶的乳清蛋白在迁移时间上有显著不同,同时由表1看出,两种牛奶的乳清蛋白中4种主要成分蛋白的含量也有所不同,水牛奶乳清蛋白的主要成分的质量浓度高于荷斯坦牛奶中乳清蛋白的质量浓度。
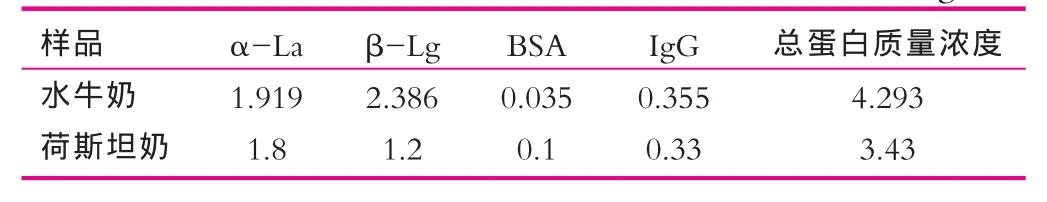
表12 种牛奶乳清蛋白的质量浓度g/L
综上可见,水牛奶乳清蛋白与荷斯坦牛奶的乳清蛋白有显著差异性,分析原因:水牛奶乳清蛋白与荷斯坦牛奶乳清蛋白在蛋白质的一级结构上有所不同,从而造成蛋白在高级结构、分子量及所带电荷的不同,以致各蛋白在进行毛细管电泳时的荷质比不同,表观体现在蛋白的迁移时间的不同。
2.2.2 水牛奶乳清蛋白的RP-HPLC色谱分析
图4为水牛奶、荷斯坦牛奶乳清蛋白的RP-HPLC色谱分离图结果。由图4可以看出,乳清蛋白在本实验色谱条件下的出峰顺序依次为:BSA,α-La,β–Lg。由图4(a)水牛奶乳清蛋白的色谱图可知,BSA的出峰时间为18.91 min。α-La在19.97 min有一个峰,表明α-La成分单一无遗传变异体,β-Lg有3个峰说明β-Lg有3种遗传变异体,其出峰时间分别为28.34 min、32.1 min、33.30 min。由图4(b)可知,荷斯坦牛奶BSA在19.03min,α-La在20.05 min各有一峰,表明α-La成分单一无遗传变异体,β-Lg在29.20 min和32.20 min有两个变异体峰。同时由表2看出,两种牛奶的乳清蛋白中3种主要成分蛋白的含量也有所不同。
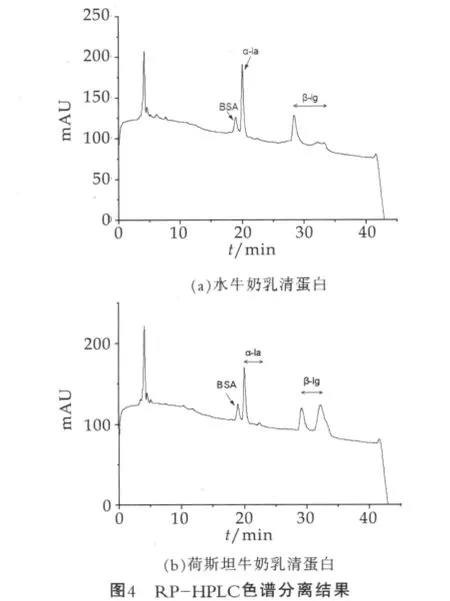
综上所述,水牛奶乳清蛋白与荷斯坦牛奶乳清蛋白在出峰时间及蛋白变异体上都有显著的差异性,分析原因:水牛奶乳清蛋白与普通荷斯坦牛奶乳清蛋白在蛋白质的一级结构上有所不同,从而造成蛋白在高级结构、分子量、所带电荷及蛋白的极性有所不同,在进行梯度洗脱时,蛋白随洗脱液的疏水性的改变而逐步被洗脱,从而表现在出峰时间上有所不同。

表22 种牛奶乳清蛋白的质量浓度g/L
3 结论
毛细管电泳法能有效分离检测乳清蛋白中的BSA,β-Lg,α-La,IgG 4种组分。结果表明,水牛奶乳清蛋白在迁移时间上与普通荷斯坦牛奶乳清蛋白的迁移时间及蛋白质量浓度有明显差异。RP-HPLC法能有效分离检测乳清蛋白中的BSA,β-Lg,α-La 3种组分。从保留时间和蛋白含量两个方面分析了水牛奶乳清蛋白与普通荷斯坦牛奶乳清蛋白的差异性,水牛奶乳清蛋白在保留时间上与普通荷斯坦牛奶乳清蛋白的保留时间有明显差异,且水牛奶乳清蛋白α-La无变异体,β-Lg有3个变异体,与荷斯坦奶有明显差异。
本文采用毛细管电泳和RP-HPLC两种方法都能将乳源乳清蛋白中的组分分开,但是毛细管的分辨率更好,能将乳中的4种组分(BSA,β-Lg,α-La,IgG)分开,RP-HPLC没有检测到IgG峰。并且毛细管电泳的分离时间更短,7 min左右即可分离完全,而RPHPLC需要45 min。对比两种方法的峰形,可以看出毛细管电泳的峰宽比RP-HPLC的峰宽窄,说明毛细管电泳方法分离效率更高。
[1]SPANGHERO M,SUSMEL P.Chemical Composition and Energy Content of Buffalo Milk[J].J.Dairy Res.,1996,63(4):629-633.
[2]HUPPERTZ,ZOBRIST MR,UNIACKE T,et al.Effects of High Pressure on Some Constituents and Properties of Buffalo Milk[J].J Dairy Res,2005,72(2):226-233.
[3]BARAKAT MZ,SHEHAB SK,NAGUIB N.A Study of The Calcium-PhosphorusRatioofDifferentMilks[J].Zentralbl Veterinarmed A,1969,16(5):444-449.
[4]MEDRANO JF,SHARROW L.Milk Protein Typing of Bovine MammaryGlandTissueUsedtoGenerateaComplementary Deoxyribonucleic Acid Library[J].J Dairy Sci,1989,72(12):3190-3196.
[5]TORRE P,BARCINA Y.Validation of Capillary Electrophoresis in The Analysis of Ewe’s Milk Casein[J].Journal of Chromatography A, 1999(832):239–246.
[6]MIRALLESB,ROTHBAUEV.ImprovedMethodforThe Simultaneous Determination of Whey Proteins,Caseins and Para-κ-Casein in Milk and Dairy Products by Capillary Electrophoresis[J]. Journal of Chromatography A,2001(915):225–230.
[7]HAM J S,JEONG S G,LEE S G.Irradiation Effect on α-and β-caseins ofMilkandQuesoBlancoCheeseDeterminedbyCapillary Electrophoresis[J].Radiation Physics and Chemistry 2009(78):158–163.
[8]唐萍,田晶.奶制品中蛋白质测定的毛细管电泳法研究[J].分析科学学报.2006,21(6):5-8.
[9]刘婷,姜金斗,毛细管电泳检测奶粉中添加的大豆分离蛋白[J].分析科学学报.2008,22(1):37-41.
[10]BONFATTI V,GRIGELETTO L,Validation of A New Reversed-Phase High-Performance Liquid Chromatography Method for Separation and Quantification of Bovine Milk Protein Genetic Variants[J]. Journal of Chromatography A,2008(1195):101–106.
[11]BORDIN G.,RAPOSO F C.Identification and Quantification of Major Bovine Milk Proteins by Liquid Chromatography[J].Journal of Chromatography A,2001(928):63–76.
[12]TRUJILLO A J,CASALS I,Analysis of Major Bovine Milk Proteins by Reversed-Phase High Performance Liquid Chromatography and Flow Injection Analysis With Electrospray Ionization Mass Spectrometry[J],Journal of Chromatography A,2000(870):371–380.
[13]PALMANO K P,ELGAR D F,Detection and Quantitation of Lactoferrin in Bovine Whey Samples by Reversed-Phase High Performance Liquid Chromatography on Polystyrene Divinylbenzene,[J]. Journal of Chromatography A,2002(947):307–311.
Contrast between two rapid separation and detection of Southern Water Buffalo whey protein methods
CHENG Xi-fei,LI Yun-kai,XIANG Ming-xia,XU Ming-fang
(Department of biotechnology,Jinan University,Guangzhou 510632,China)
Two methods were studied for the separation and detection of whey protein by reverse-phase HPLC(RP-HPLC)and capillary electrophoresis(CE).The results show that two methods can both separate BSA、α-La、β–Lg effectively,and both can do qualitative and quantitative analysis for different kinds of whey protein.In contrast,CE can separate more rapidly,it only used 7 minutes to complete the whole separation process while RP-HPLC needed 45 minutes,in addition,RP-HPLC cannot separate and examine the IgG component.
CE;RP-HPLC;milk;whey protein
TS252.7
A
1001-2230(2012)05-0055-03
2011-11-14
广东省科技计划项目(No:2009B011300003),两种快速分离检测南方水牛乳乳清蛋白方法的比较。
成希飞(1988-),女,硕士,研究方向为应用微生物与微生物工程。
徐明芳

