新疆疆岳驴乳粉增强小鼠免疫功能的研究
王红娟,郑峥,杨洁
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
新疆疆岳驴乳粉增强小鼠免疫功能的研究
王红娟,郑峥,杨洁
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
探讨驴乳冻干粉对环磷酰胺所致小鼠免疫功能低下的影响。环磷酰胺诱导小鼠免疫功能低下,给小鼠饲喂不同剂量的驴乳冻干粉,并于30 d后测定免疫指标。结果表明:饲喂驴乳粉后,小鼠的T淋巴细胞阳性率由免疫低下组的23.89%上升至驴乳高剂量组的55.70%;白细胞数量由免疫低下组的4.36上升至高剂量组的9.21;吞噬率由免疫低下组的20.9%提高到高剂量组37.2%,吞噬指数由免疫低下组的0.31提高到驴乳高剂量组的0.62;小鼠胸腺指数由免疫低下组的0.012上升到高剂量组的0.02;CD4+/CD8+比例由免疫低下组的0.82提高到高剂量组的1.81,血清IgG质量浓度由免疫低下组的0.453 g/L提高到高剂量组的0.727 g/L。驴乳不仅能提高机体的免疫能力,而且对环磷酰胺所造成的免疫低下具有缓解作用。
驴乳粉;环磷酰胺;免疫低下小鼠;免疫调节
0 引言
驴乳蛋白质中富含人体必需氨基酸,同时含有丰富的儿童生长所必需的组氨酸[1]。大量临床病例证实,约有3%三岁前的婴幼儿会出现由IgE介导的牛乳过敏症,驴乳可以作为牛乳过敏婴幼儿的替乳食品[2]。同时驴乳可以治疗多种疾病,如预防动脉粥样硬化,增强血管神经扩张和作为有效地抗菌剂[3],尤其对猪霍乱沙门氏菌和志贺痢疾杆菌的抗菌活性最为敏感[4,5]。此外,驴乳具有低脂肪、低胆固醇的特点[6]。
目前,国内外相继对牛乳抗炎性、降血脂、提高免疫力作用进行了报道,但对驴乳影响动物机体免疫力的研究尚未见报道。因此本文通过研究不同质量浓度驴乳冻干粉溶液对环磷酰胺所致免疫低下模型小鼠的影响,为研究驴乳的生理活性提供重要的基础资料。
1 实验
1.1 材料
受试物:驴乳冻干粉,采自新疆岳普湖的新鲜疆岳驴乳样品,冷冻干燥后备用。
动物:昆明种小鼠,体质量为18~22 g,雌雄各半。
主要试剂:注射用环磷酰胺,饲料为全价颗粒状饲料,贞芪扶正胶囊,羊抗小鼠IgG,HRP酶标羊抗小鼠IgG,邻苯二胺(OPD)。
仪器:AG204型分析天平,真空冷冻干燥机,酶标仪,流式细胞仪。
1.2 方法
小鼠称重后随机分为6组:正常组,免疫低下组,阳性对照组,驴乳粉低0.75 g(每千克体质量),中1.50 g(每千克体质量),高3.00 g(每千克体质量)三个剂量组,每组10只。其中免疫低下组,阳性对照组,驴乳粉低、中、高3个剂量组在第1,5,10,15,20,25天,同时皮下注射环磷酸胺40 mg/kg,建立小鼠免疫低下模型。正常组和免疫低下组每日生理盐水灌胃,阳性对照组灌胃贞芪扶正胶囊4.20 g(每千克体质量),3个剂量组分别用不同质量分数的驴乳粉给小鼠灌胃,共30 d。第31天测定小鼠免疫指标。
1.3 免疫指标检测
1.3.1 T淋巴细胞阳性率的测定
按照朱辛为等α-醋酸萘酯酶(ANAE)方法[7],用体积分数为75%酒精将小鼠尾端局部消毒,待酒精干燥后用剪刀在尾端部约0.2 mm处剪掉,待血液自行流出后用玻片取血,推片,置于甲醛-丙酮固定液中固定,干燥,进行ANAE染色。镜检100个淋巴细胞求得ANAE阳性百分率。
1.3.2 白细胞计数
小鼠眼球取血20 μL,加入0.38 mL白细胞稀释液中混匀,取混匀稀释血液1滴,滴入计数盘中,静置2~3min,用低倍镜计数四角的四大格中的白细胞总数。
1.3.3 巨噬细胞吞噬能力的测定
小鼠腹腔注射1 mL 2%鸡红细胞,脱臼处死,吸取腹腔液,滴一滴于玻片上,展开液滴,自然干燥,瑞士-姬姆萨染液染色。油镜观察巨噬细胞吞噬鸡红细胞的情况。吞噬指数=100个巨噬细胞吞噬的鸡红细胞总数/100;吞噬百分数=100个巨噬细胞中吞噬了鸡红细胞的细胞数/100。
脏器指数(mg/g)=(脏器重量/小鼠体质量)×10。
1.3.4 T淋巴细胞CD4+/CD8+比例的测定
按照陶冬青,陈如泉等测定CD4+/CD8+比例的方法[8-9],每组取5只小鼠,眼眶采血0.5mL,加入5 μL肝素钠抗凝。取50 μL肝素钠抗凝全血,加入小鼠CD4-PE单抗、CD8-FITC单抗各10 μL,混匀,室温反应15 min。加入950 μL红细胞裂解液。混匀,室温反应15 min。1000 r/min离心5 min,弃上清。加入PBS 500 μL洗两次。PBS重悬细胞,流式细胞仪检测。
1.3.5 血清中免疫球蛋白IgG的测定
按照靳艳等用间接ELISA法测定IgG的方法[10-11],特异羊抗小鼠IgG作为一抗包被酶标板,HRP酶标羊抗小鼠IgG作为检测抗体,邻苯二胺(OPD)为底物,测定小鼠血清样品相应的OD490;以标准IgG作标准曲线,计算各组小鼠血清IgG质量浓度。
1.3.6 脾脏细胞形态观察
取脾脏制作石蜡切片,观察细胞形态变化。
1.4 数据处理
所有数据使用SPSS 13.0软件进行分析。采用方差分析ANOVA,结果以x±s表示,各项指标的描述性数据均用“均值±标准误”表示,显著性水平取ɑ=0.05。
2 结果
2.1 免疫低下小鼠观察
免疫低下组灌胃生理盐水后小鼠形体消瘦,运动迟缓,反应迟钝,体重明显下降。阳性对照组与驴乳灌胃组精神状况良好,行动灵活,且随着驴乳剂量的增加,精神状况更佳,呈剂量依赖性。
2.2 对免疫低下小鼠T淋巴细胞和白细胞的影响
表1为驴乳粉对小鼠T淋巴细胞和白细胞的影响。由表1可以看出,与正常组相比,环磷腺胺所致的免疫低下组T淋巴细胞阳性率、白细胞数明显下降,且差异显著(P<0.05),说明造模成功。与免疫低下组相比,灌胃驴乳各组T淋巴细胞阳性率和白细胞数明显升高,高剂量组T淋巴细胞阳性率和白细胞数几乎达到阳性对照组水平。

表1 对小鼠T淋巴细胞和白细胞的影响
T淋巴细胞介导细胞免疫应答,并在机体针对TD抗原的体液免疫应答中发挥重要辅助作用。灌胃驴乳后,T淋巴细胞阳性率明显上升,说明驴乳可刺激T淋巴细胞数量增长,对提高机体免疫功能有促进作用。白细胞能吞噬异物产生抗体,在机体损伤治愈、抗御病原入侵和对疾病免疫方面起重要的作用。机体发生炎症或其他疾病都可引起白细胞总数及各种白细胞百分比发生变化,因此白细胞总数成为检测免疫作用的重要标准之一。驴乳对环磷腺胺所致的免疫低下小鼠WBC下降有保护作用,可增强机体的免疫力。
2.3 对免疫低下小鼠巨噬细胞吞噬功能的影响
表2为驴乳粉对小鼠巨噬细胞吞噬功能的影响。如表2所示,与正常组相比免疫低下组的吞噬指数和吞噬率明显下降,差异显著(P<0.05)。与免疫低下组相比,各剂量驴乳组巨噬细胞和吞噬鸡红细胞的吞噬指数和吞噬率均有提高。3个剂量组与免疫低下组之间差异显著(P<0.05),其中高剂量组作用最强,与阳性对照组无显著差异(P>0.05)。
巨噬细胞有很强的吞噬能力,主要吞噬外来颗粒如微生物、大分子(包括抗原分子)甚至损伤或死亡的自身组织。此外,巨噬细胞将摄取和处理后的抗原提呈于细胞表面,供抗原特异性T淋巴细胞识别,参与特异性免疫反应。上述实验结果表明灌胃驴乳能显著地提高小鼠巨噬细胞活性。
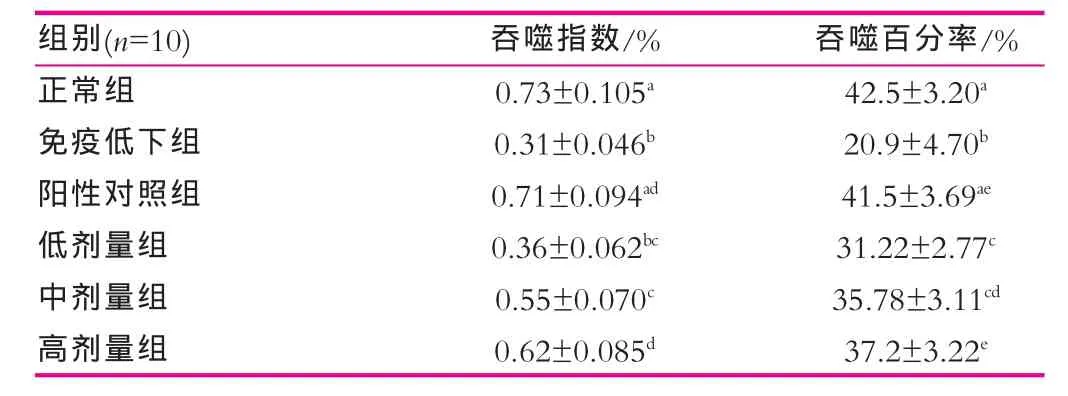
表2 对小鼠巨噬细胞吞噬功能的影响
2.4 对免疫低下小鼠T淋巴细胞CD4+/CD8+和IgG的影响
CD4+淋巴细胞亚群以Th细胞为主,CD8+淋巴细胞亚群以Ts细胞为主,CD4+淋巴细胞能增强和扩大机体的免疫应答,CD8+淋巴细胞能抑制免疫应答过程,两种作用相反的T淋巴细胞借助相互拮抗,调节机体免疫应答。CD4+/CD8+的比值反映机体免疫内环境是否稳定,两者平衡决定了免疫反应的总效应,若比值偏离正常值,说明机体免疫功能失调。与正常组相比,免疫低下组的CD4+/CD8+比例下降,且差异显著(P<0.05),说明造模成功。3个不同质量浓度驴乳粉剂量组的CD4+/CD8+比例均呈上升趋势,中低剂量组与免疫低下组差异不显著(P>0.05),其中高剂量组与免疫低下组差异显著(P<0.05)(表3)。结果说明灌胃驴乳可有效地改善CD4+/CD8+比值的降低,且有一定的剂量依赖性。

表3 对小鼠T淋巴细胞CD4+/CD8+和IgG的影响
IgG是血清和细胞外液中主要的抗体成分,对多种细菌和病毒有抑制和中和作用。与正常组相比,免疫低下组IgG质量浓度显著降低。3个剂量组血清中IgG的质量浓度较免疫低下组增高,且差异显著(P<0.05),且高剂量组与阳性对照组无显著性差异(P>0.05)。结果说明驴乳能改善环磷胺造成的免疫低下,可提高免疫低下小鼠血液中IgG水平。
2.5 对免疫低下小鼠脏器指数的影响
通过驴乳冻干粉对免疫低下的小鼠脏器指数统计,结果如表4所示。由表4可以看出,免疫低下小鼠的胸腺指数下降,与正常组相比差异显著(P<0.05)。各灌胃驴乳组与正常组相比,中剂量和高剂量组已达正常组水平。各灌胃驴乳组的肝指数也上升,但各组差异不显著(P>0.05)。胸腺是机体细胞免疫的中枢器官,对外周免疫器官的发育起主导作用,其功能状态直接决定机体细胞免疫功能,并间接影响体液免疫功能。实验结果说明环磷腺胺导致小鼠免疫器官胸腺萎缩,而驴乳粉对小鼠免疫器官胸腺有明显的保护作用。

表4 驴乳粉对小鼠脏器指数的影响
2.6 脾脏细胞形态观察
通过石蜡切片对不同处理组的脾脏细胞进行观察,结果如图1所示。由图1可以看出,正常组的脾脏细胞形态特征为细胞多为椭圆形,排列密集,边界清晰,形态完整,胞质丰富致密,着色深(图1(a));免疫低下组的脾脏细胞数量明显减少,大部分细胞缩小,细胞边缘不整齐,胞质大量减少,空虚部分较多,着色较浅(图1(b));随着驴乳质量浓度剂量的增高,脾脏细胞逐渐规则完整,驴乳高剂量组脾脏细胞多为椭圆形,细胞排列密集,大小较一致,边界清晰,形态完整,胞质丰富,较致密,着色深(图1(e))。这种变化可能是由于细胞活动功能降低、血液和营养物质供应不足,以及神经内分泌刺激减少引起器官的实质细胞体积或数目的减少所致。只要原因消除,已萎缩的细胞、组织可回复原状。结果说明驴乳能够缓解环磷酰胺导致的脾脏萎缩,对免疫器官有一定的修复作用。

3 结果与讨论
驴乳中富含溶菌酶、β-乳球蛋白和α-乳白蛋白,主要成分与人乳非常相似[12]。Criscione等[13]研究发现驴乳中的蛋白具有多态性,采自不同地方的驴乳样,通过测定成分发现,有的驴乳中缺乏αs1酪蛋白,有的缺乏β-乳球蛋白II。Cunsolo等[14]对驴乳的蛋白质组进行了研究,结果发现驴乳中10%的蛋白组分可以通过已有的数据库进行鉴定,70%的蛋白组分只能通过与驴同源的马属的蛋白数据库进行鉴定,另有20%蛋白组分尚未鉴定。因此有必要对驴乳的生理功能与生物活性成分进行进一步研究。
为了探讨驴乳对小鼠免疫力的影响作用,本研究以新疆岳普湖县的疆岳驴驴乳为研究对象,以不同质量浓度的驴乳冻干粉溶液饲喂环磷酸胺致免疫低下小鼠,分别统计观察不同处理组小鼠的形态、T淋巴细胞和白细胞数量、巨噬细胞吞噬功能、对T淋巴细胞CD4+/CD8+和IgG的影响以及用显微石蜡切片技术观察了不同处理组脾脏细胞形态,结果表明,驴乳能够有效地提高免疫低下小鼠的免疫力。通过灌胃驴乳溶液,能够改善环磷酰胺造成的CD4+/CD8+比例失调,对被环磷酰胺破坏的免疫器官起到一定的修复作用,可提高机体T淋巴细胞和白细胞数量以及提高腹腔巨噬细胞吞噬指数和吞噬率,能增高血清中IgG质量浓度,部分免疫指标可基本达到正常水平。随着驴乳质量浓度增加,小鼠免疫力增强,这暗示了驴乳对提高免疫功能具有剂量依赖性。新疆是我国养驴最多的省(区)[15],大力发展驴乳业不仅可以很好的促进我国新型乳制品的开发、推动我国乳品工业发展,也可以因地制宜,充分挖掘新疆驴乳产业优势。本实验为新疆驴乳的综合开发利用提供了科学依据。
[1]张岩春,尤娟,郑喆,等.驴乳的氨基酸组成与人乳及牛乳的分析比较[J].农产品加工,2008(8):77-79.
[2]MONTIG G,BERTINO E,MURATORE M C,et al.Efficacy of Donkey’s Milk in Treating Highly Problematic Cow’s Milk Allergic Children:An in Vivo and in Vitro Study[J].Pediatric Allergy and Immunology,2007,18(3):258-264.
[3]TAFARO A,MAGRONE T,JIRILLO F,et al.Immunological Properties of Donkey's Milk:Its Potential Use in the Prevention of Atherosclerosis[J].Curr Pharm Des,2007,13:3711–3717.
[4]CHIOFALO B,SALIMEI E,CHIOFALO L.Ass’s milk:Exploitation of an Alimentary Resource[J].Riv.Folium,2001,1(Suppl.3):235-241.
[5]ZHANG X Y,ZHAO L,JIANG L,et al.The Antimicrobial Activity of Donkey Milk and Its Microflora Changes During Storage[J].Food Control,2008,19(12):1191-1195.
[6]陆东林,张丹凤,刘朋龙,等.驴乳的化学成分和营养价值[J].新疆农业科学,2006,43(4):335-340.
[7]朱辛为,李质馨,窦肇华.T淋巴细胞标志染色-ANAE法的改进[J].解剖学杂志,2003,(3):300-301.
[8]陶冬青,陈如泉.复方甲亢片对Graves病大鼠T细胞亚群及其细胞因子失衡影响的实验研究[D].湖北:湖北中医学院,2005.
[9]孙艳,赵晶,钟照华.流式细胞仪检测GFW对荷瘤鼠细胞免疫的影响[J].齐齐哈尔医学院学报,2007,28(5):519-520.
[10]靳艳,高荣.CpG基序重组质粒增强小鼠免疫和抗病力的效应[D].四川:四川大学,2007.
[11]陈希文,程安春.基因枪与肌肉注射猪繁殖与呼综合征病毒ORF5基因疫苗诱导小鼠体液及细胞免疫的比较研究[J].畜牧兽医学报, 2005,36(8):812-818.
[12]VINCENZETTI S,POLIDORI P,MARIANI P.Donkeys Milk Protein Fractions Characterization[J].Food Chemistry,2008,106(2): 640-649.
[13]CRISCIONE A,CUNSOLO V,BORDONARO S,et al.Donkeys Milk Protein Fraction Investigated by Electrophoretic Methods and Mass Spectrometric Analysis[J].International Dairy Journal,2009,19: 190-197.
[14]CUNSOLO V,MUCCILLI V,FASOLI E,et al.Poppea's Bath Liquor:The Secret Proteome of She-donkey's Milk[J].Journal of Proteomics,2011,74:2083-2099.
[15]陆东林,王艳华.新疆乳品加工业发展现状和干乳制品开发[J].新疆畜牧业,2007,(33):4-9.
Immune function influence of Xinjiang Jiangyue Donkey Milk Powder on immunodepressed mice
WANG Hong-juan,ZHENG Zheng,YANG Jie
(College of Life Science and Technology,Xinjiang University,Urumqi 830046,China)
To observe the donkey milk powder on immunodepression induced by cyclophosphamide in mice.The immunodepression was induced by cyclopho*sphamide,the different dose of donkey milk powder were given to mice for 30 days and measure parameters.The masculine ratio of T lymphocytes increased from 23.89%of immundepressed group to 55.70%of high-dose donky milk group;WBC number increased from 4.36 of immundepressed group to 9.21 of high-dose donky milk group;Phagocytosis rate increased from 20.9%of the immundepressed group to 37.2%,Phagocytic index increased from 0.31 of immundepressed group to 0.62 of high-dose group of donky milk, increased by nearly two times;Thymus index increased from 0.012 of immundepressed group to 0.02 of high-dose donky milk group;CD4+/CD8+rate increased from 0.62 of immundepressed group to 1.81 of high-dose group of donky milk,IgG increased from 0.453 of the immundepressed group to 0.727.Donkey milk powder can improve the immunity,and alleviate immunodepression caused by cyclophosphamide in mice.
donkey milk powder;cyclophosphamide;immunodepressed mice;immune function modulate
Q936
A
1001-2230(2012)05-0020-04
2011-12-12
新疆维吾尔自治区自然科学基金(No.2010211A04),自治区科技支疆项目计划项目(No.201191255)。
王红娟(1986-),女,硕士研究生,从事生化制药与食品生物学研究。
杨洁

