苏铁珊瑚根结构观察及其内生放线菌分离
曹 妍 ,伍建榕
苏铁珊瑚根结构观察及其内生放线菌分离
曹 妍1,伍建榕2
(1.西南林业大学 林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224;2.国家林业局 西南地区生物多样性保育重点实验室,云南 昆明 650224)
苏铁类是现存最原始的裸子植物类群,被认为是活化石。为了探究清苏铁珊瑚根的结构和内生放线菌的多样性,本研究采用石蜡切片法对苏铁珊瑚根进行显微结构观察,用改良的TWYE(M1)、高氏1号 (M2)和甘油—天冬酰胺(M3)培养基对珊瑚根的内生放线菌进行分离,并通过16S rRNA系列分析鉴定其种属。结果表明:苏铁珊瑚根由周皮、外部皮层、藻胞层、内部皮层和维管柱组成;外部皮层和内部皮层细胞在横切面上呈圆形,而且在有的细胞中能看到被染成暗红色的菌丝团的存在;利用以上三种培养基从苏铁珊瑚根中共分离到了13株放线菌,隶属于链霉菌属和拟诺卡氏菌属。
苏铁;珊瑚根;内生放线菌;分离;16S rRNA
苏铁Cycas revoluta又名铁树,为苏铁科Cycadaceae苏铁属Cycas植物。苏铁被誉为植物界的“大熊猫”和“活化石”,为我国一级保护植物[1]。苏铁类植物全世界仅有苏铁目,现存有3个科,即苏铁科Cycadaceae、蕨铁科Stangeriaceae和泽米铁科Zamiaceae,11属,约280多种[2]。我国苏铁仅有1科1属,自然分布的苏铁属植物约38种,约占世界苏铁属植物总数的30%左右[3]。
苏铁除具有正常根和肉质根以外还发现有珊瑚状根。珊瑚根是苏铁类植物的一类背地性生长的、重复二叉分枝的根丛,可暴露于土壤表面,形似珊瑚,因此得名[4]。苏铁珊瑚根结构与形成一直存在争议,蓝细菌的侵入是否必要成为争议的热点。而珊瑚根的形成是否与内生菌有关,这方面的研究尚未见报道。植物内生菌(endophyte)是一类生活史有部分或整个一生都在健康植物组织细胞内或细胞间生活,并且不会造成明显的致病症状的微生物,包括细菌、放线菌、真菌[5]。由于内生放线菌生长缓慢,分离比较困难,相比内生真菌和细菌研究较少。近年来研究发现,内生放线菌宿主范围广,种类丰富,是放线菌资源的一个重要来源。苏铁为古老的孑遗植物,其研究重点一直是系统进化,而其内生菌的多样性尚未见报道。
本研究旨在从苏铁珊瑚根结构观察及内生放线菌的分离出发,探究清楚其结构和其中的微生物宿住情况及内生放线菌的多样性,从而为促进苏铁快速繁育和生长提供基础研究。
1 材料与方法
1.1 试验材料
实验材料采自昆明市金殿森林保护区,该处土壤酥松,为红壤土,苏铁珊瑚根生长旺盛,大多在地表下2~5cm处或裸露于地表。2011年4月在此处采集珊瑚根,放于冰盒中带回实验室,用自来水将泥土冲洗干净,备用。
1.2 试验方法
1.2.1 苏铁珊瑚根显微结构观察——石蜡切片法
将珊瑚根切成约0.5 cm的小段,用FAA固定液固定24小时以上。固定好的材料经叔丁醇从低浓度到高浓度系列脱水,石蜡包埋,旋转切片机连续切片,厚度8 μm。切片干燥后用番红固绿对染,再用中性胶封片,光学显微镜观察并照相。材料经番红固绿染色后,木质、角质、细胞核等为红色,薄壁细胞为绿色。
1.2.2 苏铁珊瑚根内生放线菌的分离
(1) 材料的消毒 将材料在流水下冲洗干净后,用刀片将二叉状根切开,在无菌操作台中先用75%的酒精对其处理30~60 s,无菌水清洗3次;0.1%的升汞消毒5 min,无菌水清洗3次。
(2) 放线菌的分离 将材料放进1.5 mL的灭菌离心管中,加入0.5 mL的无菌水,用杵棒将其捣碎,静置10 min后吸取0.2 mL菌悬液分别涂布在改良的TWYE(M1)、高氏1号培养基(M2)、甘油—天冬酰胺培养基(M3)上,即分别在3种培养基中添加100 mg/L的重铬酸钾,28 ℃恒温培养。约3周后,根据平板上长出菌落的形态、颜色、大小等挑取不同的菌落进行纯化。
(3) 消毒方法有效性的检测 吸取最后一次清洗过材料的水0.2 mL涂布在培养基上作为对照,将平板于28 ℃培养3周以上,观察是否有菌落长出。以此方法来检测此消毒方法是否将苏铁珊瑚根表面消毒干净。
1.2.3 苏铁珊瑚根内生放线菌的鉴定
用SDS法[6]对分离到的放线菌进行DNA提 取, 然 后 用 引 物: Primer A:5’-CAGAGTTTGATCCTGGCT-3’;Primer B:5’-AGGAGGTGATCCAGCCGCA-3’(北 京 三 博 公司合成)对16S rRNA进行扩增。PCR反应条件:95℃预变性5 min,95℃变性1 min,54℃退火1 min,72℃延伸2 min,共30个循环,最后72℃延伸10 min。取PCR产物5 μL于1%琼脂糖凝胶电泳(电压100 V)30 min,放置于凝胶成像系统中检测照相。
2 结果与分析
2.1 苏铁珊瑚根的外部形态观察
苏铁珊瑚根生长于尚未木质化的幼根组织上,大多产生于生产侧根的部位。观察培养出的幼苗发现,珊瑚根瘤瓣在向外突出根的表皮时往往不是一个瘤瓣,而是多个瘤瓣同时突出根的表皮,呈簇状生长。这时的珊瑚根颜色还是同其着生部位的根的颜色完全一致,呈乳白色。随着瘤瓣的生长,不断进行二叉分枝,最终形成多分枝的球形珊瑚状瘤簇,大多在地表下2~5cm处或裸露于地表(见图1)。形成的瘤簇直径可达2~3 cm以上。成熟的苏铁珊瑚根由于蓝细菌的入侵而使得表面呈蓝绿色,老的周皮上具明显的皮孔,每个二叉状分支长约1 cm,直径约0.15~0.2 cm(见图2)。
2.2 苏铁珊瑚根显微结构观察

图1 苏铁珊瑚根Fig.1 The cycad coralloid roots
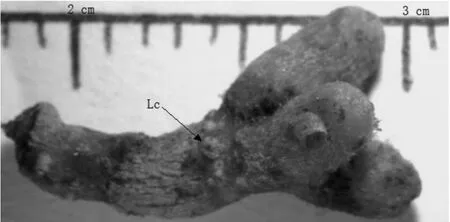
图2 苏铁珊瑚根(皮孔和长度) Lc =lenticelFig.2 The cycad coralloid root (lenticel and length)Lc =lenticel
苏铁珊瑚根横切面呈近椭圆形,由周皮、外部皮层、藻胞层、内部皮层和维管柱组成(见图3)。藻胞层的细胞多为径向延长的大细胞,排列紧密,整个藻胞层被番红和固绿染成了鲜红色,这是由于大量的蓝细菌宿住在此区域。根横切面中空而无法看到完整的维管柱。外部皮层和内部皮层薄壁细胞在横切面上呈近圆形,而且在有的细胞中能看到被染成暗红色的菌丝团的存在。在纵切面上同样可以看到在内外皮层有的细胞中存在被染成暗红色的菌丝团,菌丝团大小不一。(见图3、4)。
2.3 苏铁珊瑚根内生放线菌的分离和鉴定结果
利用M1、M2和M3 3种培养基从苏铁珊瑚根共分离到13株菌。用SDS法[6]提取总DNA,提取的总DNA在19 kb以上。对提取的DNA进行纯化后,用PA和PB引物对其进行PCR扩增后,扩增出的片段大小约为1 500 bp。将PCR产物送北京三博公司测序。测得16S rRNA用DNAMAN软件拼接后,用Eztaxon Server 2.1进行序列比对,在GenBank上找到同源序列,各菌株与近源菌相似性见表1。再用Mega 4.0软件中的Neighbor-Joining法进行系统发育分析(见图5)。根据16S rRNA序列相似性达到98%以上的认为是一个种,达97%以上则认为是同一个属[7],若序列相似性小于96%~97%的可以认为不是同一个种,小于93%~95% 的可以认为不是同一个属[8]的划分,可以得出这13株菌属于链霉菌菌属Streptomyces和拟诺卡氏菌属Nocardiopsis。
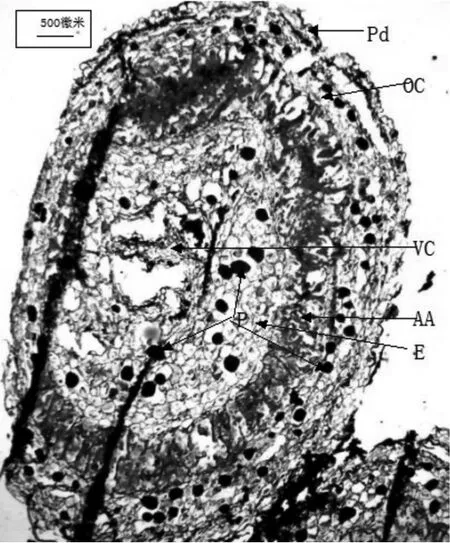
图3 苏铁珊瑚根的横切面结构Fig. 3 The cross section structure of coralloid root in Cycas

图4 苏铁珊瑚的纵切面结构Fig.4 The longitudinal section of coralloid Root in Cycas
3 讨 论
3.1 苏铁珊瑚根显微结构
苏铁珊瑚根由周皮、外部皮层、藻胞层、内部皮层和维管柱组成。外部皮层和内部皮层在横切面上呈圆形。藻胞层的细胞多为径向延长的大细胞,排列紧密。这些结构特征都与苏建英等[4]报道的相一致。艾素云[9]等对珊瑚根进行了解剖学研究,探究了其结构和发育起源,但没有报道除蓝细菌外的其它微生物宿住其中的现象。本研究通过石蜡切片法对苏铁珊瑚根结构观察发现,在皮层细胞中有被番红染成暗红的菌丝团的存在且大小不一。菌丝团可能是菌丝缠绕着细胞核生长形成的。而这些菌丝团是否为真菌或放线菌还有待于进一步的研究。2004年,Jack B. Fisher等[10]报道Zamia pumila根中存在着真菌,并观察到了丛枝。但这与本研究在苏铁珊瑚根中看到的菌丝团又存在一定的差异。因此,我们推测苏铁珊瑚根中菌丝团的形成很可能是内生放线菌侵染形成的。
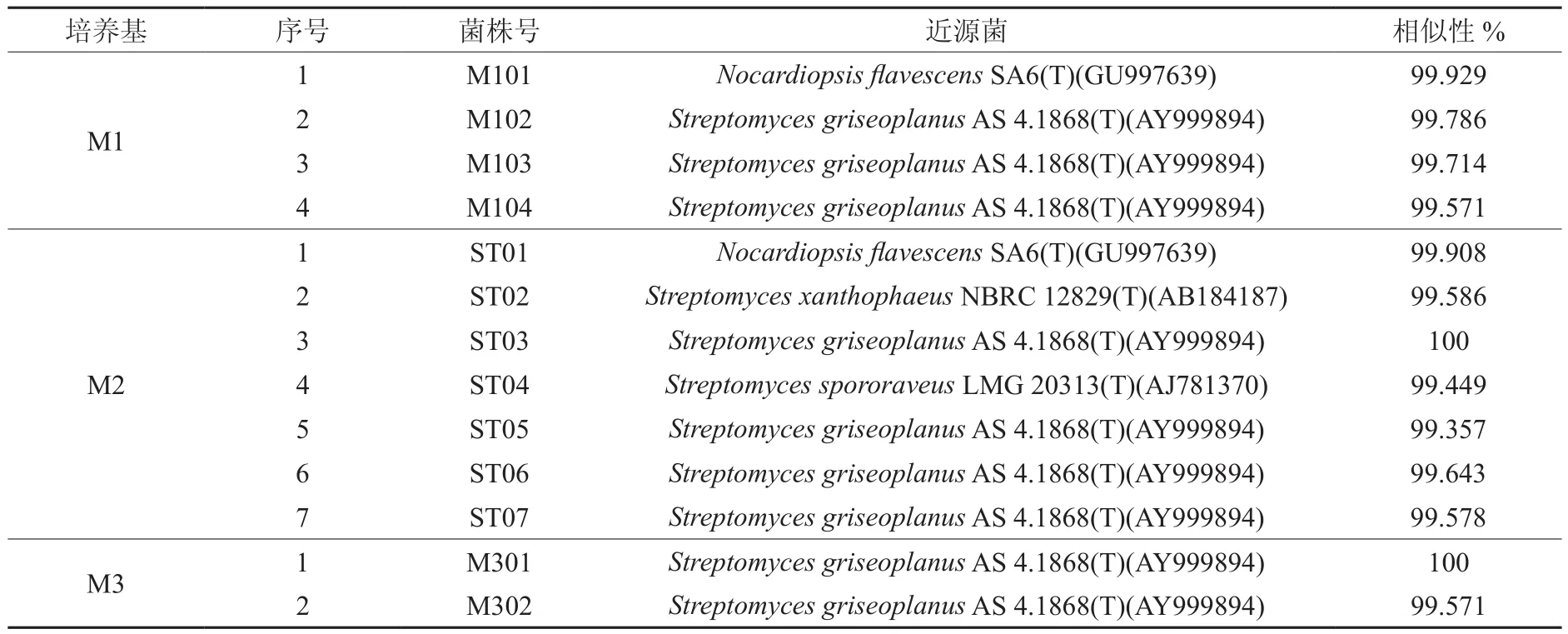
表1 苏铁珊瑚根中可培养内生放线菌16S rRNA系列分析结果Table 1 16S rRNA sequence analysis results of cultivable endophytes actinomycetes in cycad coralloid root

图5 根据16S rRNA基因系列构建部分菌株系统进化树Fig. 5 Neighbor-joining phylogenetic tree based on almost-complete 16S rRNA gene sequences
3.2 苏铁珊瑚根内生放线菌
本研究分离到的13株菌中11株为链霉菌属Streptomyces,占总数的84.6%,说明苏铁珊瑚根内生放线菌的优势种群是链霉菌。这与已有的报道大多数的内生放线菌大部分都是链霉菌属[11-12]相符。利用M1和M2均分离到了两属,而M3只分离到一属,说明M1和M2对分离苏铁珊瑚根内生放线菌优于M3。但3种培养基分离到的种属都比较单一,可能是苏铁珊瑚根中可培养内生放线菌种类较少,有待于用不同方法对其进行分离。
放线菌生长缓慢,往往由于真菌和细菌的干扰而无法成功分离到。要成功分离到放线菌,必须在培养基中加入一些能抑制真菌和细菌的生长但又不影响放线菌生长的抑制剂。本研究选取了高效又便宜的抑制剂重铬酸钾,当在养基中加入100 mg/L的重铬酸钾时,能够有效的抑制真菌和细菌的生长,这与徐丽华等[13]的报道相一致。
另外,植物材料的预处理对于内生菌的分离也至关重要。本研究是直接采用的新鲜植物材料进行分离,效果不是很理想,分离到的种属较少,要分离到尽可能多的内生放线菌可能还要采取不同的预处理方法。
弗兰克氏菌属Frankia是最早被发现的能在非豆科植物根部形成根瘤并具有固氮能力的内生放线菌。而放线菌在苏铁中具有什么样的作用,以及其侵染途径和机制目前还不清楚。曹理想[14]等认为内生链霉菌不仅可促进植物生长、提高作物产量、而且可以增加植物对病原菌的抗性。笔者在野外调查时也发现具有珊瑚根的植株比没有珊瑚根植株要生长旺盛并且病虫害侵染相对较少,但苏铁珊瑚根中的内生链霉菌是否也能够促进苏铁的生长和增强苏铁对病原物的抗性还有待证实。
[1] 国家林业局、农业部令(1999)第4号, 《国家重点保护野生植物名录(第一批)》, 1999.
[2] 吴 萍, 张开平. 云南苏铁植物的现状及保护对策[J]. 林业调查规划, 2008, 33(4): 116-119.
[3] 韦丽君, 吕 平, 等. 中国苏铁属植物保护现状与展望[J]. 热带农业科技, 2006, 29(1): 24-26.
[4] 苏建英, 李 楠, 廖 芬. 苏铁类珊瑚根内藻胞层的解剖观察[J]. 阴三学刊, 2007, 21(1): 54-57.
[5] Tan R X, Zou W X. Endophytes: a rich source of functional metabolites[J]. Nat Prod Rep, 2001, 18: 448-459.
[6] 秦 盛. 滇南美登木内生放线菌多样性及生物活性初步研究[M]北京:2008年中国微生物学会学术年会论文集. 2009.
[7] Devereu X R, He S H, Doyle C L, et al. Diversity and origin of Desulfovibrio species: phylogenetic definition of a family[J].Bacteriol, 1990, 172(7): 3609-3619.
[8] Vaishampayan P, Miyashita M, Ohnishi A, et al. Description of Rummeliibacillus stabekisii gen [J]. International Journal of Systematic and Evolutionary Microbiology,2009,59(5):1094-1099.
[9] 艾素云, 黄玉源, 伍映辉. 贵州苏铁根的解剖学研究[J]. 云南植物研究, 2006, 28(2): 149 - 156.
[10] Jack B. Fisher,Andrew P. Vovides. Mycorrhizae are present in cycad roots[J]. The Botanical Review, 2004, 70(1): 16–23.
[11] 姜 怡, 杨 颖, 陈华红, 等. 植物内生菌资源[J]. 微生物学通报, 2005, 32(6): 146-147.
[12] Verma V C, Gond S K, Kumar A, et al. Endophytic actinomycetes from Azadirachta indica A. Juss. isolation,diversity, and antimicrobial activity[J]. Microb Ecol, 2009, 57: 749-756.
[13] 杨宇容,徐丽华,李启任,等. 放线菌分离方法的研究——抑制剂的选择[J]. 微生物学通报,1995,22(2): 88-91.
[14] 曹理想, 周世宁. 植物内生放线菌研究[J].微生物学通报,2004, 31(4): 93-96.
Structural observations of Cycas revolute coralloid root and disassociation of endophytic actinomycetes
CAO Yan1, WU Jian-rong2
(1. Key Lab. of Forest Disaster and Warning Control of Yunnan Province University, College of Forestry, Southwest Forestry University,Kunming 650224, Yunnan, China; 2. Key Lab. of Biodiversity Conservation in Southwest China of State Forestry Administration,Kunming 650224, Yunnan, China)
Cycad is the most primitive extant gymnosperms, which is considered to be living fossil. In order to explore the structure and the endophytes actinomycetes of cycad coralloid root, the paraffin section was used to do the observation on microstructure; TWYE(M1),Gao one (M2) and Glycerin – asparagine mediums were used to seprate the endophytic actinomycetes in the coralloid roots and through 16S rRNA sequence analysis, the Actinomycetes were identified. The results indicate that the periderm, outer cortex, cyanobacterial zone, internal cortex and vascular cylinder consisted of the cycad coralloid root; the cells of the external and internal cortex presented to be a circular form on the cross section, and pelotons that were stained to be red existed in some cells of them. 13 strains of actionmycetes were separated from the cycad coralloid root through the above three mediums, and they belong to streptomyces and nocardiopsis.
Cycas revoluta; coralloid root; endophytic actionomycetes; disassociation; 16S rRNA
S791.11;Q939
A
1673-923X(2012)11-0047-04
2012-10-10
国家“十一五”科技支撑计划重点项目(2008BAC39B05);西南林业大学重点科研基金项目(BC2010FK01);云南省重点学科森林保护学(XKZ200905)
曹 妍(1987-),女,江西吉安人,硕士研究生,研究方向:森林保护学与资源微生物利用;E-mail:caoyan_612@163.com
伍建榕(1963-),女,福建人,教授,主要从事森林病理学及资源微生物利用研究;E-mail: wujianrong63@Yahoo.com.cn
[本文编校:吴 毅]

