液相色谱-质谱联用分析紫杉醇和多西他赛中流动相体系的优化
钱 隽 郁韵秋
(1复旦大学药学院药物分析教研室 上海 201203;2复旦大学附属肿瘤医院化疗科 上海 200032)
液相色谱-质谱联用(LC-MS或LC-MS/MS)技术是基于色谱的高分离能力及质谱的高灵敏度和专属性的分离检测技术,已经成为生物、制药领域的必备分析手段之一。在用电喷雾离子化(electrospray ionization,ESI)质谱进行分析时,液相色谱流动相的组成已证明是影响化合物离子化的重要因素。其中,流动相中添加剂的化学性质、浓度以及添加剂控制的溶液pH值对分析物的响应值都有明显影响[1-2]。
紫杉醇(paclitaxel)和多西他赛(docetaxel)是临床上常用的紫杉烷类抗癌药物。两者具有相似的理化性质,极性都较弱,在ESI源中不易形成带电荷离子。LC-MS/MS技术用于分析紫杉醇和多西他赛的灵敏度较差,在分析方法开发时必须在流动相中使用添加剂来提高质谱响应[3-4]。如紫杉醇,尽管文献中都采用ESI源正离子模式,但就流动相的水相组分而言,有选择0.1%甲酸[5-7]、0.1%乙酸[8]、10mmol/L 甲 酸 铵[9]、2mmol/L 乙 酸 铵[10]等。由于各实验室仪器型号和配件的不同以及分析方法开发过程的技术差异,各实验室在建立紫杉醇的分析方法时仍需进行流动相条件的优化。
质谱仪的进样方式包括直接进样和色谱进样。前者是指样品通过针泵而不经色谱分离,直接进入离子源电离后进行质谱分析。对于绝大多数质谱仪器而言,从待测物离子产生到获得离子的响应信号仅仅需要毫秒级的时间。但大多数实验室在建立及优化液相条件的过程中往往采用色谱进样,即样品在合适的流动相条件下经色谱柱分离后,由色谱流出液导入质谱。每次流动相条件的改变,意味着对流动相的更换及脱气、色谱柱的平衡及冲洗等步骤,此过程需要数小时的时间。本实验分别通过这两种进样方式,研究紫杉醇和多西他赛在含不同添加剂的溶液或流动相中的离子化规律,探索简化流动相优化过程的可行方法。在此基础上,建立了人血浆中紫杉醇的LC-MS/MS分析方法并进行方法学验证及应用于临床样品测定。
材料和方法
仪器Shimadzu LC-20AD液相色谱系统包括二元梯度泵、真空在线脱气机、柱温箱和自动进样器(日本岛津公司);API 3200Qtrap三重四极杆串联质谱仪(美国AB SCIEX公司),配置TurbolonSpray离子源、HARVARD pumpⅡ针泵及安装 Analyst 1.5软件的微处理机。
试剂紫杉醇对照品(纯度99.9%)和多西他赛标准品(纯度98.8%)均购于中国药品生物制品检定所;甲醇、叔丁基甲醚、甲酸、乙酸、甲酸铵和乙酸铵均为色谱纯(德国 Merck KGaA公司,64271 Darmstadt);纯水由法国Millipore超纯水仪制备。
标准品溶液的配制精密称取紫杉醇和多西他赛各10mg,分别用甲醇溶解,配成各自浓度为400 μg/mL的标准储备液。
于纯水-甲醇(30∶70,v/v)溶剂中加入适量紫杉醇和多西他赛的标准储备液,配制成紫杉醇和多西他赛浓度均为20μg/mL的混合标准品溶液,供针泵直接注射进样。同样,分别以含不同添加剂,如0.1%甲酸、0.1%乙酸、多种浓度乙酸铵、甲酸铵(浓度分别为0.05、0.2、1、5、20mmol/L)、1mmol/L 甲酸铵(pH 3.0、4.0、6.5、7.5)等的水溶液替代前述方法中的纯水,与甲醇以3∶7的比例混合(按此比例配制,以使样品中水-甲醇的配比与LC-MS/MS方式下流动相的配比相似)。按照上述方法配制成紫杉醇和多西他赛浓度均为20μg/mL的混合标准品溶液-A,即得到含各种添加剂的直接注射进样溶液。
取适量紫杉醇和多西他赛的标准储备液,分别用50%的甲醇-水溶液稀释,配制成紫杉醇和多西他赛浓度均为40ng/mL的混合标准品溶液-B,供LC-MS/MS分析。
针泵直接进样的电喷雾质谱(ESI-MS/MS)分析将浓度为20μg/mL的紫杉醇和多西他赛混合溶液-A,通过针泵以10μL/min的流速导入ESI源。通过全扫描确定化合物母离子,以多反应离子监测(multiple reaction monitoring,MRM)选择相对丰度较高且信号稳定的离子对。对去簇电压(declustering potential,DP)、碰撞能量(collision energy,CE)、碰撞室入口电压(colliosion cell entrance potential,CEP)、碰撞室出口电压(colliosion cell exit potential,CXP)等参数进行优化。确定最佳质谱参数为:ESI源,正离子模式;喷雾电压5 500V;离子源温度550℃;雾化气压力20 psi;辅助气压力60psi(1psi=6.895kPa,下同);气帘气压力10psi。MRM监测离子对、去簇电压及碰撞电压等见表1。通过针泵注入紫杉醇、多西他赛与各种添加剂的混合溶液,考察待测物在ESI源正离子模式下的响应情况。

表1 紫杉醇和多西他赛的质谱优化条件Tab 1 The optimaized MS/MS conditions for paclitaxel and docetaxel
LC-MS/MS分析浓度为40ng/mL的紫杉醇和多西他赛混合溶液-B,经液相系统的自动进样器导入。液相分离条件为:Shimadzu Shim-pack XRODS色谱柱(3.0mm×75mm,2.2μm,日本岛津公司),柱温为40℃;流动相组成为甲醇-水体系(73∶27,v/v),流速为0.4mL/min,进样体积为10μL。质谱分析条件采用优化后的质谱条件。通过LCMS/MS系统考察流动相中加入不同添加剂后待测物的质谱响应。
分析人血浆中紫杉醇的LC-MS/MS方法学验证及实际样品测定(以多西他赛作内标)在健康人群的空白血浆样品中加入紫杉醇标准品,配成标示浓度分别为0.5、1.0、2.5、10、50、200、500ng/mL的标准曲线血样,并配制低、中、高浓度分别为1、25和400ng/mL的血浆质控样品。方法学的主要指标包括:特异性、标准曲线、定量下限、准确度、精密度、基质效应、样品稳定性和提取回收率。建立的分析方法应用于临床受试者的药代动力学研究。
血浆样品处理过程如下:吸取50μL血浆样品,加入10μL内标溶液(多西他赛,浓度为1μg/mL),混匀,加入1mL叔丁基甲醚,涡旋提取3min。于4℃条件下14 000r/min离心10min后,吸取上清液并用氮气吹除溶剂,残渣用100μL液相色谱流动相溶解,14 000r/min离心10min后,取上清液进样10μL分析。若临床样品中的紫杉醇浓度超出标准曲线的线性范围上限,用健康人空白血浆对其进行稀释并混匀。取50μL稀释后血样,按以上步骤再进行血样前处理以供分析。
结 果
添加剂种类的影响紫杉醇和多西他赛的分子结构中缺乏氨基或羧基等易电离的基团(图1),所以由针泵注入的混合标准品溶液中未加入添加剂时,在ESI源中的质谱响应相对弱,离子化效率低,表明此时不易形成带电荷离子。图2所示为不同添加剂条件下紫杉醇的离子信号强度,是由质谱直接进样的MRM信号图。当含挥发性溶质如0.1%甲酸、0.1%乙酸、1mmol/L甲酸铵或1mmol/L乙酸铵组成的溶液直接注入质谱后,紫杉醇的离子强度明显提高,其中以1mmol/L甲酸铵的响应强度最大。这是由于加入的溶质促使离子在溶液中预形成,有利于提高待测化合物的离子化效率。按照其作用强弱依次排序,1mmol/L甲酸铵优于0.1%乙酸、1mmol/L乙酸铵和0.1%甲酸。不同添加剂组成的溶液对多西他赛的离子化作用与紫杉醇相似,说明溶质的存在对于此类化合物的离子化程度有重要的影响。比较各种添加剂对待测化合物的离子化效应。可见LC-MS/MS进样与由针泵进样的响应变化趋势相似,均以1mmol/L甲酸铵溶液的作用最强,优于同浓度的乙酸铵。

图1 紫杉醇和多西他赛的结构示意图Fig 1 Chemical structures of paclitaxel and docetaxel
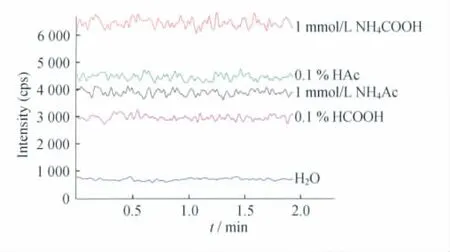
图2 不同添加剂组成溶液由质谱直接进样的紫杉醇离子强度Fig 2 Signal intensity of paclitaxel ion in solutions with different additives by direct sampling to mass spectrometry
通 过 LC-MS/MS 系 统 进 样,在 Shimadzu Shim-pack XR-ODS色谱柱上,实验考察了同样配比(甲醇-水相为73∶27,v/v)、不同水相组成(甲醇-水溶液、甲醇-0.1%甲酸水溶液、甲醇-0.1%乙酸水溶液、甲醇-1mmol/L甲酸铵水溶液、甲醇-1mmol/L乙酸铵水溶液)的流动相体系中紫杉醇和多西他赛的质谱响应。不同流动相条件下紫杉醇的LCMS/MS色谱图(图3)显示,当流动相为甲醇-水时,化合物的色谱峰响应很弱;而在水相中分别加入不同的挥发性溶质后,紫杉醇的响应强度显著增加,说明上述添加剂有利于紫杉醇的离子化,其中甲醇-1 mmol/L甲酸铵水溶液为流动相时的紫杉醇色谱峰响应最大,表明此条件下紫杉醇的离子化效率最高,检测灵敏度最高。各种流动相组成溶液对多西他赛的离子化作用与紫杉醇相似。
甲酸铵浓度的影响紫杉醇和多西他赛的混合标准品溶液中分别加入5种不同浓度的甲酸铵:0.05、0.2、1、5和20mmol/L,由针泵注入,比较其质谱响应。结果显示,甲酸铵浓度为0.05mmol/L时的质谱响应较低,随着添加剂浓度的增加,响应逐渐增强,当浓度为1mmol/L时,待测化合物的离子强度达到最大。之后随着浓度继续增加,响应反而降低,至20mmol/L时响应明显减弱。
通过LC-MS/MS系统进样,考察甲醇与5种不同浓度甲酸铵水溶液(0.05、0.2、1、5和20mmol/L)组成的流动相体系对紫杉醇和多西他赛色谱峰响应的影响。结果显示,随着添加剂浓度的增加,响应进一步增强,在1mmol/L时色谱峰响应达到最大;但是甲酸铵浓度进一步增加后,紫杉醇和多西他赛的响应反而降低。说明溶液中的离子强度对紫杉醇和多西他赛的离子化效率有明显影响,当甲酸铵达到一定浓度时,[M+H]+更易于生成,离子化效率提高;然而浓度过高时,由于电荷密度增加引起的排斥力使得喷雾中心的离子密度降低,待测化合物的离子形成相应减少[1,11],离子化效率因而降低。将两种不同进样方式、不同浓度甲酸铵对紫杉醇和多西他赛的质谱响应强度作图(图5),便于对离子化效应作直观比较。
pH 的影响在pH 值分别为3.0、4.0、6.5、7.5的1mmol/L甲酸铵溶液中,无论是针泵进样还是连接色谱柱液相进样,紫杉醇和多西他赛均以

图4 不同种类添加剂对紫杉醇和多西他赛离子强度的影响Fig 4 Comparison of the signal intensity of paclitaxel and docetaxel based on different sorts of additives
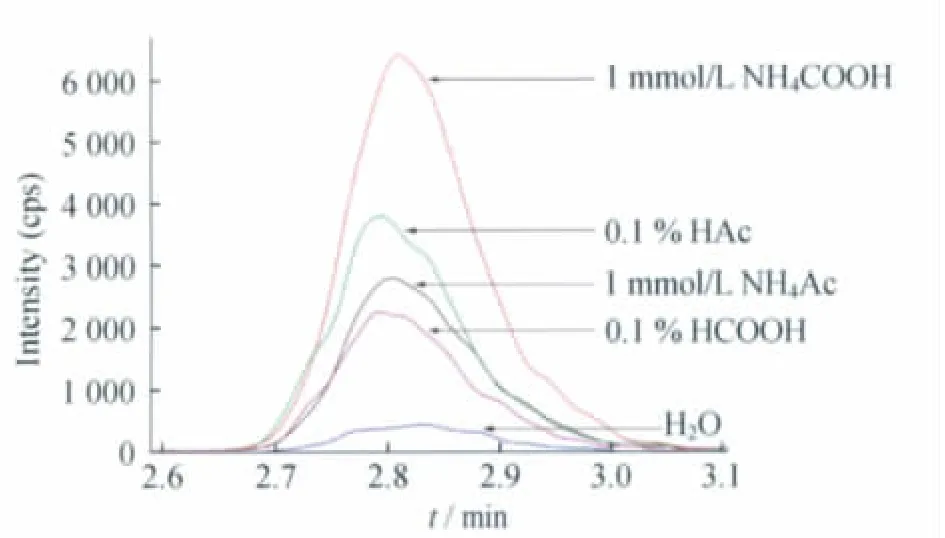
图3 不同添加剂组成的流动相条件下紫杉醇的LC-MS/MS色谱图Fig 3 LC-MS/MS chromatograms of paclitaxel by mobile phases with different additives
将两种不同进样方式、不同种类添加剂对紫杉醇和多西他赛的质谱响应强度作图(图4),可直观1mmol/L甲酸铵水溶液(pH=6.5)的响应强度最大(图6)。紫杉醇和多西他赛均为弱碱性化合物,pKa值相近,分别为11.99和12.02,所以当溶液pH小于10时,化合物已充分解离,并电离为[M+H]+的形式,其离子化效率达到较高程度,检测灵敏度也因此提高。但是,当溶液的pH值继续降低时,化合物的解离度并没有进一步增加,反而由于酸浓度过高时易形成离子对[12],降低了离子化效率。
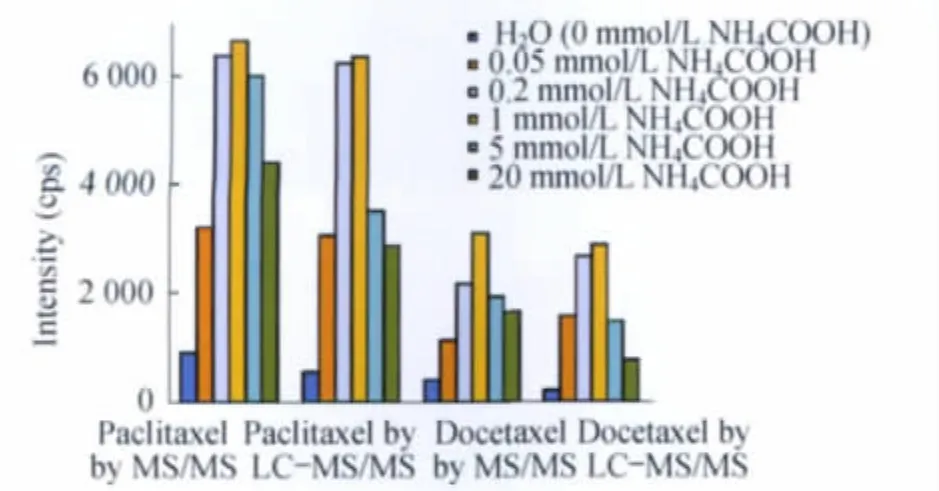
图5 不同浓度的甲酸铵溶液对紫杉醇和多西他赛质谱响应强度的影响Fig 5 Comparison of the signal intensity of paclitaxel and docetaxel based on the ammonium formate solutions with different concentrations
分析方法学评价在上述研究的基础上,建立了人血浆中紫杉醇的LC-MS/MS分析方法(以多西他赛作内标)并进行方法学验证,进而用于临床样品测定。色谱检测结果显示,在服药前的空白血样中未测到紫杉醇和内标(图7A),提示内源性物质对分析无明显干扰;在加入标准品紫杉醇和内标的样品中(图7B)及患者给予紫杉醇注射液175mg/m24h后的血浆色谱图(图7C)结果显示,紫杉醇与内标物的保留时间分别为2.9和3.3min,峰形良好。方法学研究表明,本方法测定紫杉醇的线性范围为0.5~500ng/mL,定量下限为0.5ng/mL,低、中、高浓度质控样品的准确度为99.5% ~104.0%,日内精密度为3.5%~4.4%,日间精密度为0.80%~2.80%,样品的提取回收率高于85%,无明显基质效应。此分析方法以灵敏、准确、快速、可靠的特点满足了生物样品测定的要求。
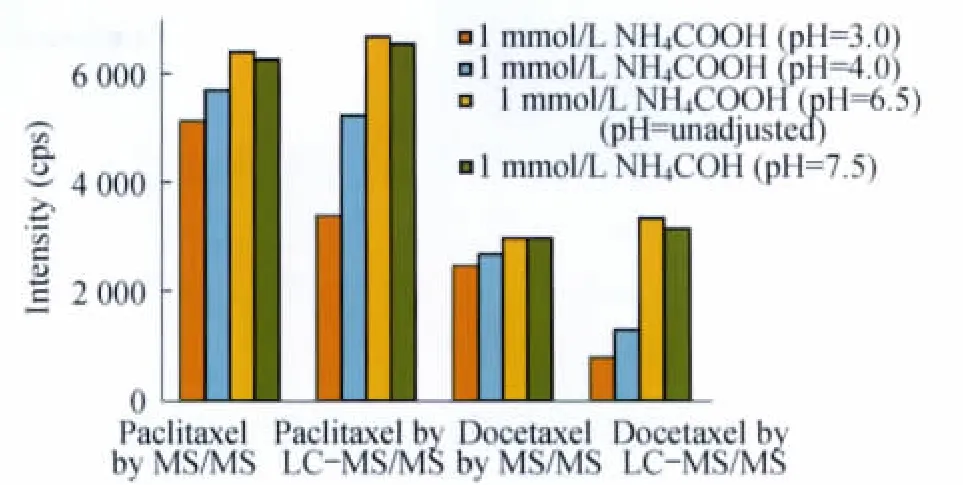
图6 不同pH的甲酸铵溶液对紫杉醇和多西他赛质谱响应强度的影响Fig 6 Comparison of the signal intensity of paclitaxel and docetaxel based on the ammonium formate solutions with different pH

图7 人血浆样品中紫杉醇和内标(多西他赛)的LC-MS/MS色谱图Fig 7 Chromatogram of paclitaxel and docetaxel in human plasma by MRM scan mode A:Blank plasma;B:Blank plasma with paclitaxel and docetaxel;C:A plasma sample from a patient at 4 h after administration of paclitaxel injection.
讨 论
紫杉醇和多西他赛的极性较弱,在ESI源中不易形成带电荷离子。然而通过在液相溶剂体系中添加促电离物质后,可促使待测化合物达到较高的离子化效率,从而有效提高检测灵敏度和改善重现性。此外,流动相中添加剂的种类、浓度以及pH值,都影响着紫杉醇和多西他赛在ESI的离子化过程。在含不同添加剂的溶剂中,待测物的离子化效率有显著差异。通过质谱的直接进样和LC-MS/MS进样对溶液或流动相中添加剂的促离子化作用进行考察,确认两种方式所呈现的质谱响应的变化趋势一致。因此,最终确定以对待测化合物响应最佳的1mmol/L甲酸铵溶液(pH=6.5)作为流动相中的水相组成。
液相色谱流动相中的添加剂不仅明显影响待测化合物在ESI的响应,而且影响其在色谱上的保留时间和峰形。紫杉醇和多西他赛的极性较小,在反相色谱上保留时间和峰形稳定。经试验,当流动相中有机相和水相比例固定时,向水相中加入不同的添加剂如纯水(H2O)、0.1%甲酸、0.1%乙酸、不同浓度与不同pH的甲酸铵和乙酸铵后,比较色谱图发现,紫杉醇保留时间差异小于0.03min,多西他赛的保留时间差异小于0.06min,各色谱峰的拖尾因子均在0.95至1.05之间,说明这两种化合物的色谱保留时间和峰形并不随流动相的离子强度和pH值的不同而发生变化。认为此类色谱保留不易受溶质影响的化合物,尤其适合采用质谱直接进样方式对流动相中的水相组份作筛选。相反,若是极性大的化合物,因其色谱保留时间和峰形易受流动相中溶质的影响,通过质谱直接进样方式优化的流动相组成应用于LC-MS/MS分析时情况较为复杂,需要进一步研究。
本文通过质谱的两种进样方式-直接进样和色谱进样,研究紫杉醇和多西他赛在含不同添加剂的溶液或流动相中的离子化规律,两种方式对溶液中添加剂种类、浓度及pH等条件作出筛选的结果一致。说明在建立紫杉醇或多西他赛的LC-MS/MS定量方法时,采用质谱直接进样方式对流动相中的水相组成进行优化的方法是切实可行的。与常用的LC-MS/MS进样方法相比,质谱直接进样的方式只需将待测化合物配制成各种溶液后直接针泵进样,优化流动相条件时无需反复脱气和平衡色谱柱,方法高效、便捷;而且溶剂用量只需数毫升,节约了成百倍的溶剂,更为经济环保,是紫杉烷类化合物的LC-MS/MS分析方法建立过程中极为有效和可靠的流动相优化方法。ionization process in liquid chromatography-mass spectrometry[J].JChromatogrA,2009,1216(4):685-699.
[2] Zhao JJ,Yang AY,Rogers JD.Effects of liquid chromatography mobile phase buffer contents on the ionization and fragmentation of analytes in liquid chromatographic/ionspray tandem mass spectrometric determination[J].JMassSpectrom,2002,37(4):421-433.
[3] Mortier KA,Zhang GF,van Peteghem CH,etal.Adduct formation in quantitative bioanalysis:effect of ionization conditions on paclitaxel[J].JAmSocMassSpectrom,2004,15(4):585-592.
[4] Mortier KA,Renard V,Verstraete AG,etal.Development and validation of a liquid chromatography-tandem mass spectrometry assay for the quantification of docetaxel and paclitaxel in human plasma and oral fluid[J].AnalChem,2005,77(14):4677-4683.
[5] Tong X,Zhou J,Tan Y.Determination of paclitaxel in rat plasma by LC-MS-MS[J].JChromatogrSci,2006,44(5):266-271.
[6] Zhang SQ, Song YN, He XH,etal. Liquid chromatography-tandem mass spectrometry for the determination of paclitaxel in rat plasma after intravenous administration of poly(L-glutamic acid)-alanine-paclitaxel conjugate[J].JPharmBiomedAnal,2010,51(5):1169-1174.
[7] Zhang SQ,Chen GH.Determination of paclitaxel in human plasma by UPLC-MS-MS[J].JChromatogrSci,2008,46(3):220-224.
[8] Guo W,Johnson JL, Khan S,etal.Paclitaxel quantification in mouse plasma and tissues containing liposome-entrapped paclitaxel by liquid chromatographytandem mass spectrometry: application to a pharmacokinetics study[J].AnalBiochem,2005,336(2):213-220.
[9] Gardner ER,Liau CT,Chu ZE,etal.Determination of paclitaxel in human plasma following the administration of Genaxol or Genetaxyl by LC-MSMS[J].RapidCommun MassSpectrom,2006,20(14):2170-2174.
[10] Basileo G,Breda M,Fonte G,etal.Quantitative determination of paclitaxel in human plasma using semiautomated liquid-liquid extraction in conjunction with liquid chromatography/tandem mass spectrometry[J].J PharmBiomedAnal,2003,32(4-5):591-600.
[11] Constantopoulos TL,Jackson GS,Enke CG.Effects of salt concentration on analyte response using electrospray ionization mass spectrometry [J].JAmSocMass Spectrom,1999,10(7):625-634.
[12] 孙萍,梁琼麟,罗国安.基质影响电喷雾离子化效率的研究[J].分析试验室,2005,24(5):71-76.

