固定化培养对球等鞭金藻生长及其提取物的抑菌效果影响研究
宋文军,王雪青,付秀娟
(a.天津商业大学 生物技术与食品科学学院,天津 300134;b.天津市食品生物技术重点实验室,天津 300134)
固定化培养对球等鞭金藻生长及其提取物的抑菌效果影响研究
宋文军,王雪青,付秀娟
(a.天津商业大学 生物技术与食品科学学院,天津 300134;b.天津市食品生物技术重点实验室,天津 300134)
分别选用液体悬浮培养、海藻酸钙固定培养和海藻酸钠-壳聚糖-海藻酸钠(Alginate-chitosan-alginate,ACA)微胶囊法对球等鞭金藻(Isochrysisgalbana)进行培养,考察不同培养方法对藻细胞生长的影响以及藻细胞经磷酸缓冲液、体积分数95%的乙醇溶液、甲醇与甲苯的混合液(体积比为3∶1)、乙酸乙酯、丙酮5种溶剂提取的提取物对金黄色葡萄球菌(S.aureus)和大肠杆菌(Escherichiacoli)的抑菌活性.结果表明,ACA微胶囊法培养的藻细胞生长周期长,提取物中抑菌物质含量高,抑菌效果最好.
固定化;海藻酸钙;ACA微胶囊;球等鞭金藻;抑菌
微藻中富含大量蛋白质、维生素和矿物质,粗蛋白含量超过60%,生物学产量高于任何作物,已被应用到婴儿食品、老年保健食品及营养补品中.由于微藻种类多、数量大、处于海洋食物链的基础,因此也是筛选抗肿瘤药物的库源[1],其提取物在抑菌方面的作用已有报道[2-4].
球等鞭金藻(Isochrysisgalbana)是一种分布广泛的海洋浮游单细胞藻类,属于金藻门,金藻纲,等鞭金藻目,等鞭金藻科,等鞭金藻属.经常作为海产经济双壳动物幼虫良好的基础饵料[5],对某些海产动物幼虫饲养效果非常好[6-7].球等鞭金藻在生长过程中能合成多种生物活性物质,如叶绿素a、叶绿素c、β-胡萝卜素和叶黄素等色素以及多糖及不饱和脂肪酸等,尤其是细胞内EPA和DHA等多不饱和脂肪酸的含量较高[8-9].研究组从大量的海洋微藻中筛出了对肿瘤细胞系He La,B16-F10有明显毒活性的微藻株:球等鞭金藻H29(Isochrysisgalbana29),该藻的甲醇和甲苯混合萃取物对大肠杆菌、枯草杆菌和金黄色葡萄球菌均具有明显的抑菌效果,故颇具开发的潜力.但此藻个体微小,所用培养基盐度大,不利于离心或过滤收集,而固定化培养有利于解决这一问题.
目前藻类固定化培养的主要方法分为载体法、吸附法、包埋法、共价键结合法和交联法等.该研究以悬浮培养为对照,通过海藻酸钙包埋法[10]和海藻酸钠-壳聚糖-海藻酸钠(Alginate-chitosan-alginate,ACA)液芯包囊法[11]对球等鞭金藻H29进行培养,测定其生长曲线,并且测定不同培养方法所得藻类提取物的抑菌活性.
1 材料与方法
1.1 仪器及试剂
壳聚糖(购自上海卡博工贸有限公司,经本实验室改性),海藻酸钠(上海埃彼化学试剂有限公司),其它试剂均为国产分析纯.
250D光照培养箱 (金坛市新航仪器厂),LW200 T多功能生物显微镜(上海测维光电技术有限公司),ZNCL-B磁力搅拌器(河南爱博特科技发展有限公司).
1.2 藻种来源
球等鞭金藻 H29(Isochrysisgalbana29)(天津商业大学保藏菌种).
1.3 培养条件
采用常规f/2[9]配方,接种为培养至对数期的藻种,接种量为105个/m L,温度22℃,盐度28,光照8 000 lx下进行培养.
1.4 海藻酸钙包埋法
首先将培养至对数期的藻液与海藻酸钠溶液混合,混合后的溶液藻浓度约为105个/m L,海藻酸钠质量分数为2%.用4#针头注射器注射到质量分数2%的氯化钙溶液中,搅拌数分钟,使海藻酸钠液滴钙化成球,进行培养,胶球浓度为3个/m L.培养后收集胶球,加入一定量的55 mmol/L柠檬酸钠溶液解胶,定容后检测藻体浓度.
1.5 ACA微胶囊的制备
首先将培养至对数期的藻液与海藻酸钠溶液混合,混合后的溶液藻浓度约为105个/m L,海藻酸钠质量分数为2%.用4#号针头注射器注射到质量分数2%的氯化钙溶液中,搅拌数分钟,使海藻酸钠液滴钙化成球.洗涤钙化后的胶球,并将其转移至质量分数为1.5%的壳聚糖溶液中,反应10 min成膜.洗涤成膜后的胶球,再将其放入海藻酸钠溶液中反应10 min,进行覆膜处理.洗涤包覆后的胶球,最后用55 mmol/L柠檬酸钠溶液将胶球核液化,制成ACA生物微胶囊.最后微胶囊在3个/m L的浓度下进行培养.
经过培养后收集ACA微胶囊,然后机械破碎并收集上清液.微胶囊碎片用去离子水润洗3次收集上清液,再将收集得到的上清液混合定容测藻体浓度.
1.6 藻体检测
将定容后的藻液用血球计数板在显微镜下观察藻细胞个数,计算藻细胞密度和生长率K[10]:

式中,N t为实验进行td的细胞数目;N0为实验初始的细胞数目.
1.7 藻体收集及物质提取方法
将处理好的藻液经5 000 r/min离心,弃去上清液,收集沉淀得到藻体,用冷冻干燥法得到冻干藻粉.进行研磨,过100目筛.
提取溶剂选用藻类物质提取常用方法所采用的溶剂进行提取[12-15].具体操作方法为:称取5 g藻粉,分别加入100 m L 0.2 mol p H7.0磷酸缓冲液体积分数95%的乙醇溶液、甲醇与甲苯的混合液(体积比为3∶1)、乙酸乙酯、丙酮5种溶液,充分振荡,放入冰箱中浸提3 d后取出,5 000 r/min离心收集上清液,旋转蒸发制得藻体浸膏(样品的旋蒸温度为35℃).浸膏中加入5倍体积去离子水继续旋蒸,重复2次,去除有机溶剂.所得浸膏用去离子水润洗,然后冷冻干燥.所得浸提物加二甲基亚砜(DMSO)充分溶解,配制成不同浓度溶液,过0.22μm膜除菌,放入冰箱备用.
1.8 抑菌实验
该实验所采用的受试菌为金黄色葡萄球菌(S aureus)和大肠杆菌(E.coli).采用纸片法:制备浓度约为105个/m L的菌悬液,取20 m L菌悬液倒入300 m L溶化并已冷却至40~45℃的牛肉膏蛋白胨培养基中,摇匀后迅速分装于培养皿中,每个培养皿15 m L.待凝固后,将20μL各提取液加入已消过毒的圆形纸片(φ6 mm)上,略干后贴于培养基平板上,同时作各溶剂的空白对照,置于恒温培养箱中培养(37℃,24 h).培养完成后观察结果,测量抑菌圈直径.
2 结果与讨论
2.1 生长曲线的测定
图1为不同培养方法下藻细胞的生长曲线.
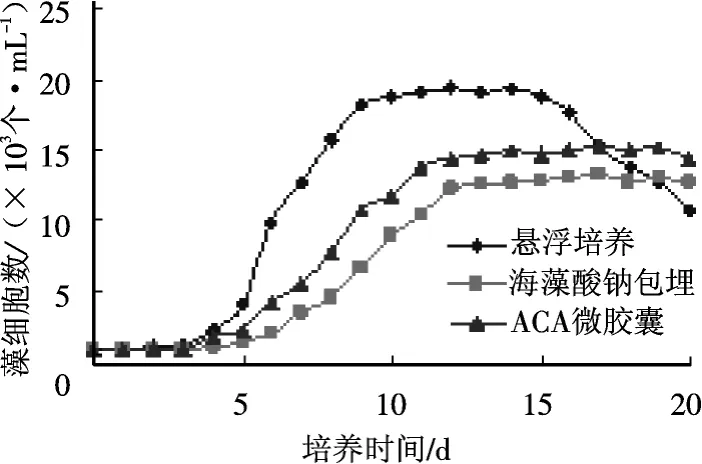
图1 不同培养方法球等鞭金藻H29生长曲线Fig.1 Growth curves of Isochrysisgalbana 29 by using different culture methods
从图1中可以看到,2种固定化培养的藻细胞生长状况比悬浮培养的藻细胞生长状况要滞后2 d左右,悬浮生长的速率明显高于固定化细胞的生长速率.并且悬浮生长的藻细胞数量明显高于固定法所得的藻量,ACA微胶囊法次之,海藻酸钙包埋法最低.
实验发现,悬浮培养法经过第15 d后藻细胞进入衰亡期,生长量开始下降,而2种固定化培养的藻细胞仍处于生长平衡期.由此可知,固定化藻细胞生长周期长,生长较缓慢,具有较长的生产周期.这可能是因为:一方面营养物质和光线进入胶球受到一定程度阻碍使其生长速率减缓;另一方面这种在较低生长速度下生长的藻细胞既减慢了营养物质的消耗,又降低了有害代谢产物的产生速度这对于构建生物反应器,从中获取活性物质及种质保存都是十分有利的.
2.2 抑菌实验结果
表1为不同培养方法所得藻细胞采用不同溶剂浸取所得的浸出物对革兰氏菌的抑菌效果.

表1 抑菌实验结果Tab.1 Results of antibacterial experiment
从表1可以看到,不同培养方法所得的提取物对革兰氏阳性菌金黄色葡萄球菌的抑制作用均优于对革兰氏阴性菌大肠杆菌的抑制作用.除水相提取物对金黄色葡萄球菌没有抑菌作用外,其它有机溶剂所提取的物质均对金黄色葡萄球菌产生抑制作用.而在大肠杆菌的抑菌实验中,只有甲醇/甲苯混合液、丙酮提取物对大肠杆菌有较强抑制作用.
不同溶剂提取物的抑菌效果也有所差别.从实验得出,藻细胞的水相提取物均无抑菌效果,由此可知藻体的抗菌活性产物为非极性化合物.并且甲醇/甲苯混合液提取物的抑菌效果均优于其它溶剂提取物.不同溶剂对藻细胞提取物抑菌活性的影响表明,在筛选具有抑菌活性的微藻时,要对多种有机溶剂进行考察,以选择最合适的提取溶剂.
不同培养方式所得藻提取物的抑菌作用可由表1看出:2种固定化培养方法所得的藻提取物的抑菌效果均达到或高于悬浮式培养的效果.而2种固定化方法所得的藻提取物抑菌效果相近,且ACA微胶囊法效果略高于海藻酸钙包埋法.这主要是由于固定化细胞相比游离培养生长周期长,营养物质处于相对亚适量水平,延迟了藻细胞的衰老;并且由于ACA微胶囊菌体的代谢水平相比游离法较缓慢,在一定程度上降低了分解代谢的活性,有利于次级代谢产物的积累.
3 结论
对不同培养方法的藻细胞生长曲线进行了测定,并对不同培养方法所得的藻细胞提取物的抑菌效果进行了实验.
结果表明:悬浮培养方式细胞生长速率快,细胞生长量高,但15 d后进入衰亡期.固定化培养方法藻细胞生长周期长,可以延迟衰老,有利于抑菌物质积累.两种固定化方法比较,ACA微胶囊方法细胞的生长率高于海藻酸钙包埋法,20 d时藻体浓度为1.5×106个.
固定化培养的藻细胞提取物抑菌效果均优于悬浮培养方法,2种固定化方法所得提取物抑菌效果相近.其中甲醇/甲苯提取物抑菌效果最高,在50 mg/m L质量浓度下对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别达到12 mm和9 mm.
综合分析球等鞭金藻H29的生长及其提取物抑菌效果2方面结果可以得出结论:ACA微胶囊方法固定化培养球等鞭金藻H29可以得到比较理想的效果,优于传统的悬浮培养方法.
[1] 张成武.微藻中的生物活性物质[J].中国海洋药物,1992,43(3):20-29.
[2] CANNELL R J P,OWSIANKA A M,WALKER J M.Re-sults of a large-scale screening programme to detect antibacte rial activity from fresh water algae[J].Br Phyco1 J,1988,23(11):41-44.
[3] 叶锦林,王明兹.紫球藻及其多糖抗菌性能初探[J].亚热带植物科学,2004,33(3):31-33.
[4] 陈晓清,郑怡,林雄平.二种微藻多糖与蛋白质提取物的抗菌活性[J].福建师范大学学报:自然科学版,2005,21(2):76 79.
[5] 陈椒芬,何义潮,谭桂英,等.两种新分离的海洋金藻及其对贻贝幼虫的饲养效果[J].海洋湖沼通报,1985,14(2):44 66.
[6] ENRIGHT C T,NEWKIRK G F,CRAIGIE J S,et al.Eval uation of phytoplankton as diets for juvenileOstreaedalisL[J].J Exp Mar Bio Ecol,1986,96(1):1-13.
[7] SUKENIK A,WAHNON R.Biochemical quality of marine u
nicellular algae with special emphasis on lipid composition(I)
Isochrysisgalbana[J].Aquaculture,1991,97(1):61-72.
[8] 戴俊彪,吴庆余.室内外培养海洋单细胞微藻的生长及生化组分[J].海洋科学,2000,24(6):29.
[9] GRIMA E M,SANCHEZ PEREZ J A,GARCIA CAMACHO F,et a1.Effect of growth rate on the eicosapentaenoic acid and docosahexaenoic acid content ofIsochrysisgalbanain che mostat culture[J].Applied Microbiology and Biotechnology 1994,41(1):23-27.
[10] 仵小南,谭桂英,周百成,等.几种海洋微藻的固定化培养[J].海洋学报,1992,14(1):129-133.
[11] 刘群,薛伟明,于炜婷,等.海藻酸钠一壳聚糖微胶囊膜强度的研究[J].高等学校化学学报,2003,23(7):1417 1420.
[12] 史大永,李敬,郭书举,等.5种南海海藻醇提取物活性初步研究[J].海洋科学,2009,33(12):40-43.
[13] 江红霞,雷红娟,轩文娟.11种微藻提取物对3种植物病原菌抗菌活性的研究[J].安徽农业科学,2008,36(10):4167 4169.
[14] 江红霞,郑怡,雷红娟.4种微藻提取物抗植物病原菌活性的研究[J].河南农业科学,2008(10):83-89.
[15] 李侠,郑法新,程璐.6种海洋微藻提取物抑茵活性研究[J]德州学院学报,2007,23(6):61-64.
Study on effects of different culture methods on growth ofIsochrysisgalbanaand antibacterial activities of its extract
SONGWen-jun,WANGXue-qing,FUXiu-juan
(a.College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China;b.Tianjin Key Laboratory of Food Biotechnology,Tianjin 300134,China)
Suspension culture method,calcium alginate gel,alginate-chitosan-alginate(ACA)microcapsule are used to cultureIsochrysisgalbana,and the effects of different culture methods on the growth ofIsochrysisgalbanaare studied.Phosphate buffer,95%ethanol,methanol/toluene(3∶1,),ethyl acetate,acetone are used as solvent to extract antibacterial materials fromIsochrysisgalbana.S.aureusandEscherichiacoliare used as indicative bacteria to study the antibacterial activities of the extract fromIsochrysisgalbana.The results show thatIsochrysis galbanacultured by ACA microcapsule has long growth cycle,and the extract contains high levels of antibacterial materials and has good antibacterial activities.
immobilization;calcium alginate;ACA microcapsule;Isochrysisgalbana;antibacterial
Q938.8
A
1671-1114(2012)01-0070-04
2010-10-28
天津商业大学基金资助项目(090101Q)
宋文军(1967—),副教授,博士,主要从事生物技术与食品科学方面的研究.
(责任编校 纪翠荣)

