天然沸石和蛭石的离子吸附性能研究
姚咏歌,李 芸,彭 婧,刘毅霖,吴晓芙
(中南林业科技大学 环境科学与工程研究所 ,湖南 长沙 410004)
天然沸石和蛭石的离子吸附性能研究
姚咏歌,李 芸,彭 婧,刘毅霖,吴晓芙
(中南林业科技大学 环境科学与工程研究所 ,湖南 长沙 410004)
以天然沸石和蛭石为吸附剂,采用等温吸附方法,研究其对Cu2+的吸附性能。结果表明,天然沸石对Cu2+的去除率略高于蛭石。天然沸石和蛭石的吸附容量p值分别为8.85 mg/g和6.99 mg/g。在实际应用中,天然沸石的单价低,吸附容量大,单位处理成本低,因此,天然沸石是人工湿地吸附缓冲单元理想的介质填料。
天然沸石;蛭石;Cu2+;吸附容量;去除率;处理成本
人工湿地因其去除污染效果好、运行费用低和易维护等优点,被广泛应用于污水处理[1-6]。研究表明[7-9],采用吸附填料建立吸附缓冲单元可提高人工湿地去除废水中重金属离子的效率。因此,吸附填料的选择及其吸附性能分析是构建人工湿地缓冲单元的基础环节。
天然沸石是由火山喷发的岩浆发生水热反应所形成的一种粘土矿物,是火山灰的沉积物[10]。天然沸石具有巨大的内表面积,孔中有可交换的碱、碱土金属阳离子和中性水分子,因而具有良好的选择吸附和离子交换功能[11]。蛭石是一种天然、无毒的,在高温作用下会膨胀的矿物,具有较大的阳离子交换容量[12]。天然沸石和蛭石作为吸附剂去除废水中污染离子方面的研究有系列报道[13-15]。王靖宇等分析比较了工业废水重金属处理中沸石吸附 Cu2+、Cd2+、Pb2+、Zn2+等离子的效果[16];郭继香等采用蛭石吸附法脱除污水中的重金属,发现当水中初始重金属(Cd2+、Cu2+、Fe2+、Pb2+、Ni+)浓度为10 mg/L时,去除率可达99%[17];吴平霄等试验结果表明蛭石吸附Zn2+离子的能力大于天然沸石[18]。
本文重点研究天然沸石和蛭石对铜离子的吸附性能,通过测试确定这两种粘土矿物的吸附容量、吸附临界点、去除效率以及应用成本,为构建用以治理铜污染的人工湿地吸附缓冲单元提供基础数据。
1 材料与方法
1.1 试验材料
选用天然沸石(浙江缙云县矿物厂,MxDy[Al(x-2y)Sin(x+2y)-O2n]·mH2O) 和 蛭 石( 河 北灵寿县地矿二厂,Mgx(H2O){Mg3-x[AlSiO3O10](OH)2})作为吸附剂。天然沸石和蛭石样品过20~40目筛,用蒸馏水反复洗涤后,置于烘箱中于100~105 ℃烘干,放入干燥器保存备用。
选用Cu2+为测试离子,采用分析纯CuSO4·5H2O配制1000 mg/L Cu2+的标准溶液,试验材料准备的要点是防止阳离子的污染。
1.2 吸附容量测定
吸附剂的吸附容量是吸附剂表面所有吸附位都被离子占据(即吸附达到饱和状态)时的吸附密度x,单位为mg/g或mmol/g。在液(水溶液)固吸附体系中,给定温度、pH和离子种类时,给定吸附剂的吸附容量为常数,因此吸附剂的吸附容量(也称为吸附剂饱和吸附密度,用p表示)是吸附剂重要的特征系数。吸附容量p不仅是选择吸附剂种类的重要依据,也是确定处理系统中吸附剂用量的基本参数,体系总吸附容量或能力是吸附剂用量与p的乘积,因此,p值的测定具有重要的实际应用价值。
定量称取吸附剂样品(2.00,5.00,10.00 g)置于250 mL具塞锥形瓶中,加入质量浓度分别为0.5、1.0、1.5、2.0、3.0、4.0、4.5、6.0 mmol/L 的Cu2+标准溶液100.00 mL,塞紧置于水浴恒温振荡器中恒温(25 ℃)振荡24 h,转速为200 r/min。振荡后静置8 h,用中速定量滤纸过滤。用原子吸收分光光度计测定滤液中Cu2+的浓度。
1.3 吸附临界点测定
吸附临界点是吸附体系中所有离子都被吸附到固体表面,液相离子浓度为零时固相(即吸附剂)的吸附密度x,常用单位为mg/g。在液(水溶液)固吸附体系中,当给定温度T、pH、离子种类和起始离子浓度时,吸附剂的吸附临界点也为常数。因此吸附剂的吸附临界点(相当于吸附剂最小的吸附密度,用xc表示)也是吸附剂重要的特征系数。当体系吸附密度等于吸附临界点值时,液相的离子浓度为零,离子的去除率等于100 %,因此,确定吸附体系的吸附临界点在控制离子污染中具有特殊意义。
使用250 mL具塞锥形瓶准确称取3组质量分 别 为 0.00,1.00,2.00,5.00,7.50,10.00,12.50,15.00 g蛭石样品系列,3组系列Cu2+标准溶液的质量浓度分别为20.00,50.00,100.00 mg/L,溶液体积为100.00 mL,塞紧置于水浴恒温振荡器中恒温(25 ℃)振荡24 h,转速为200 r/min。振荡后静置8 h,用中速定量滤纸过滤。用原子吸收分光光度计测定滤液中Cu2+的浓度。
上述试验进行两次重复。用Microsoft Excel软件进行数据分析和作图。标准差(SD)和相对误差(RD)分析表明平行试验的精确度高和试验的重现性好。
1.4 计算公式
平衡吸附量和去除率分别用式(1)、(2)计算:
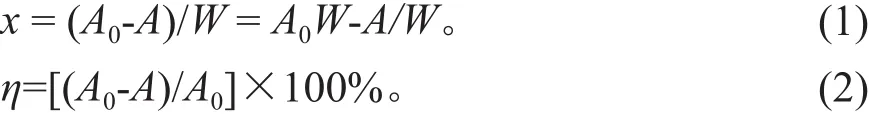
式中,x为吸附密度(mg·g-1);A0为起始离子浓度(mg·L-1);A为平衡时液相离子浓度(mg·L-1);W为吸附剂浓度(g·L-1);η为去除率(%)。
2 结果与讨论
2.1 吸附容量与吸附临界值
理论上,所有吸附系统都存在两个潜在的分别由A0(单位体积系统中可供吸附的离子的总量,亦即起始离子浓度)和B0(单位体积系统具有的总吸附容量,等于吸附剂的浓度W与吸附剂吸附容量p的乘积,B0=Wp)决定的吸附极限点[19]。这两个极限值用单位体积系统的吸附量(X)来表示时,即为起始离子浓度A0和系统总吸附容量B0,其原因是给定单位体积系统,A0和B0是X潜在的最大值。当这两个极限值用单位吸附剂的吸附密度(每克吸附剂吸附的离子量x)来表示时,则为吸附剂的吸附容量参数p和吸附临界值参数q。x、p和q与X、B0和A0的基本关系为,

在给定温度T、溶液pH和吸附剂浓度W条件下,体系的吸附容量B0为定值,随体系中离子的起始浓度A0增大,体系实际的吸附量X将增大,体系将逐步趋向饱和,在饱和吸附点上,X将不再增大,其值等于体系的饱和吸附容量B0,吸附密度x等于吸附极限值p,即
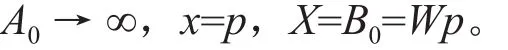
相反,在给定温度T、溶液pH和起始离子浓度A0条件下,单位体积系统可供吸附的离子总量A0为定值,随体系中吸附剂浓度W增大,体系的吸附总量增大,体系液相离子的浓度将逐步降低并趋向零,在临界吸附点上,液相离子浓度A等于零,单位体积系统的吸附总量X等于体系的起始离子浓度A0,吸附密度x等于其临界值q,即
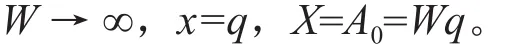
图1给出了不同W点上天然沸石(见图1a)和天然蛭石(见图1b)的等温吸附曲线(x-A0曲线),总体趋势是,在所有测试的W水平上,吸附密度x随起始离子浓度A0增大而增大,而x-A0曲线的斜率随A0增大而降低,在给定A0点上,两种吸附剂的x值均与W成反相关,W越大,x值越小。
由于天然沸石和蛭石的吸附容量较大,要使吸附达到饱和,则要求体系中A0足够大或W足够小。本试验中最大的A0值仅为6.0 mmol/L(381.24 mg/L),因此,即使是在最小的W体系(W=20 g/L)(见图1),也只能观察到x上升逼近吸附容量p的趋势,但其值与极限值p的差异很大,说明体系远远没有达到饱和状态。理论上,要获得饱和吸附体系,使X等于B0,x等于p,还需成倍地增大A0或成倍地降低W。然而,成倍地增大A0会相应增大平衡溶液的离子浓度A,当A水平过高以至超过原子吸收分析精确度允许的范围时,测定值的可靠性会很低,而若成倍地降低W,又会影响吸附剂称量的精确度而增大试验的随机误差。吸附容量参数可采用吸附反应化学势变极限点[20]或离子吸附组分模型模拟[21]的方法来确定。本试验采用上述方法确定的天然沸石和蛭石的吸附容量p值分别为8.85 mg/g和6.99 mg/g(见图1)。
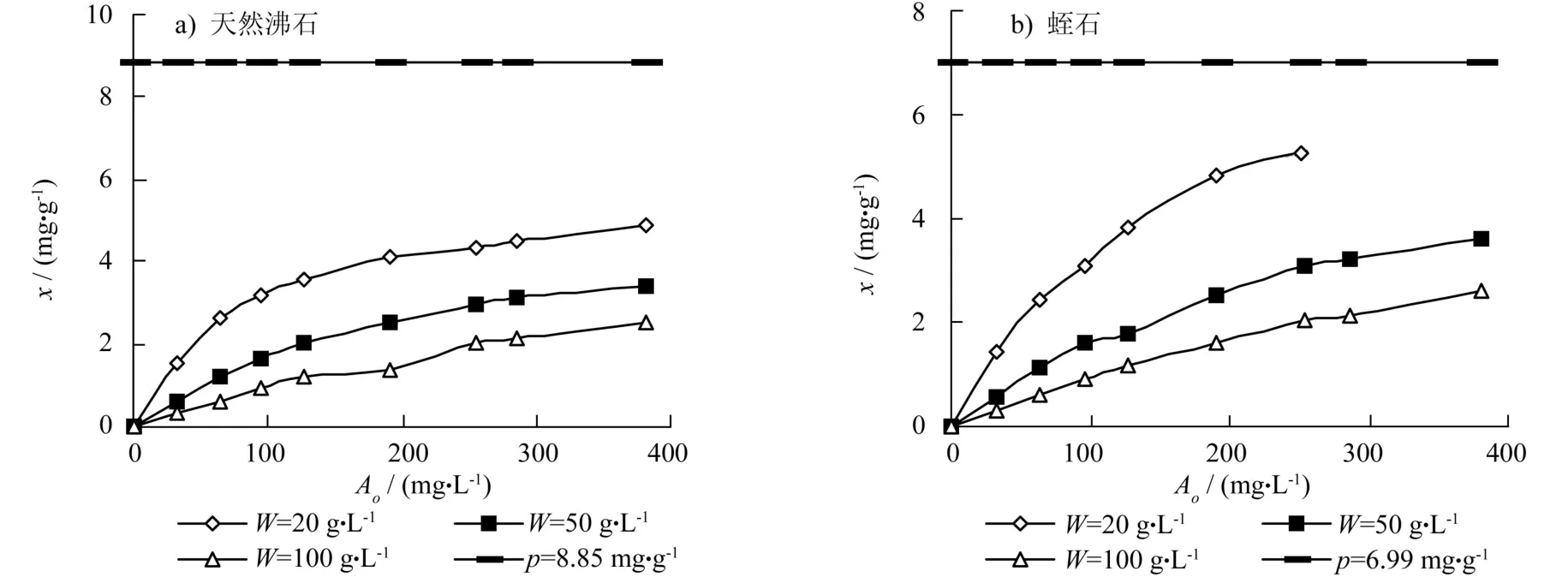
图1 吸附密度(x)与起始离子浓度(A0)和吸附容量(p)的关系Fig. 1 Relationship among adsorption density(x), initial ion concentration (A0) and adsorption capacity (p)
图2 展示了在给定起始离子浓度A0的条件下,体系吸附总量X随吸附剂浓度W增大而增大并趋向A0的趋势。要使X趋向A0,则要求W足够大或A0足够小。自图2中可看出,虽然两种吸附剂的吸附能力有差异,但X与A0重叠的起始点均随A0增大而向W增大的方向移动,说明吸附临界点的位置取决于A0与W的比值,这与式(5)给出的临界关系相符,在X=A0点上,x=A0/W=q。然而,式(5)定义的临界点是理论极限值,在实践应用中要使吸附达到这一理论极限,需要增大吸附剂浓度,相应会增大处理成本,因此,可根据实际需要选择处理后出水的浓度(A)达到国家标准时的吸附密度值,例如参考国家排放标准[GB 18918-2002],取出水铜离子浓度0.5 mg/L作为允许排放的值,定义一个达标点的吸附密度,

与式(5)比较,式(6)更具有实际应用价值。
图2的曲线反映了一个重要的理论问题。在吸附科学与技术领域,所有经典方程(例如Henry、Langmuir、Freundlich方程以及相应的修正模型)描述的都是吸附密度x与平衡溶液离子浓度A的关系(即x-A曲线),其给出的临界点x与A对应的值是:A=0,x=0。与经典曲线给出的结论不同,试验测定的结果表明,当吸附剂浓度W足够大时,系统液相中所有离子都将被吸附到吸附剂表面,则A等于零,X等于A0,离子去除率(R)达到100%,x等于A0与W的比值,既:A=0,x=A00/W≠0。事实上,因为起始离子浓度A0等于零没有意义,而当A0大于零时,“x=0”不可能对应于“A=0”,因为“A=0”说明所有体系中的离子都被吸附,而“x=0”却是指吸附量为零,因此,经典方程给出的临界关系不成立。图2展示的试验结果证明经典吸附曲线存在明显的理论缺陷,图1曲线也表明x不是A的单变量函数,因此离子吸附不能简单地用x-A曲线来描述。
2.2 吸附体系离子的吸附容量
吸附体系中离子的去除率可用下式计算:
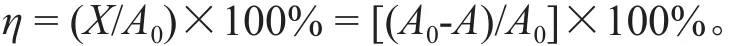
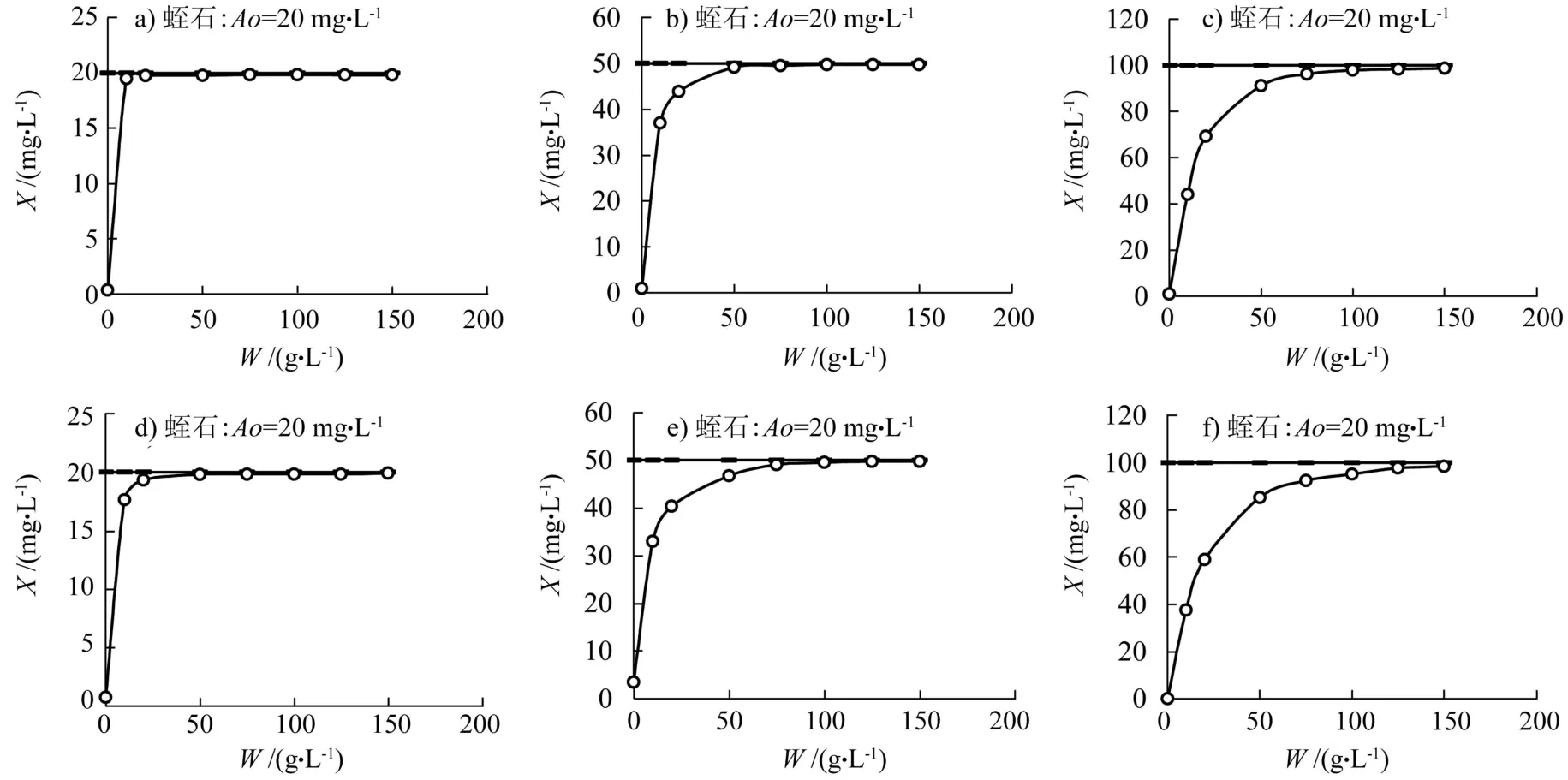
图2 吸附量(X)与吸附剂浓度(W)的关系Fig. 2 Relationship between adsorption quantity (X) and adsorbent concentration (W)
式中,η为离子去除率(%)。表1列出了试验测定的Cu2+离子去除率。试验数据说明天然沸石和蛭石均具有较强的Cu2+离子去除能力,在初始离子浓度A0为20~50 mg/L,吸附剂浓度W为125~150 g/L的范围内,天然沸石和蛭石对Cu2+离子的去除率高达99.0%以上。由于天然沸石的吸附容量p值大于蛭石的,天然沸石对Cu2+离子的去除率略高于蛭石。
赵芳等[22]基于液/固离子吸附体系中的基本反应关系给出了平衡吸附密度x的预测公式:
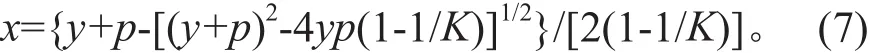
式中,p为吸附容量;y=A0/W;K为平衡常数。由于
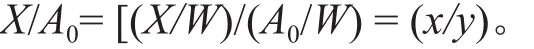
用试验测定的p值和K=1.01代入,可将(3)式转换为去除率公式,
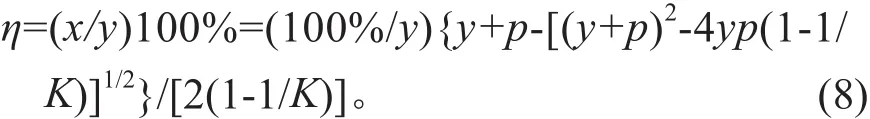
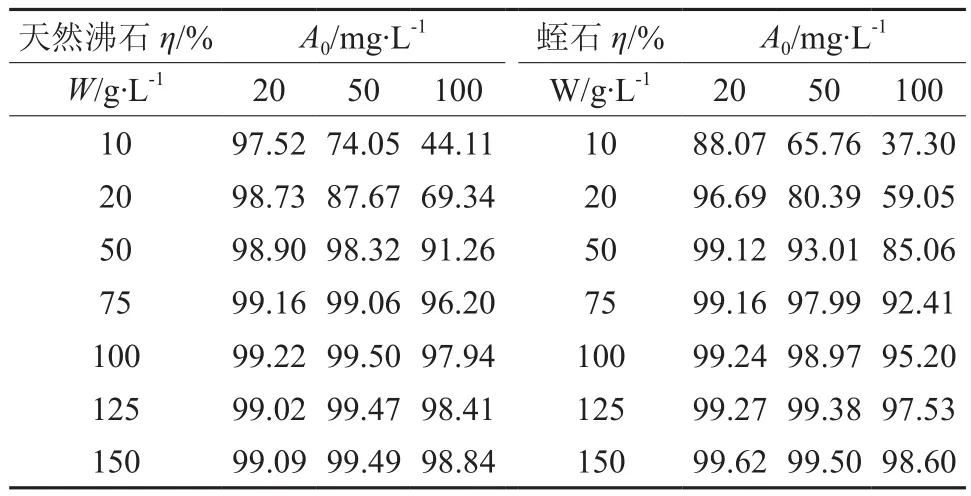
表1 天然沸石和蛭石对Cu2+离子的去除率Table 1 Removal rate of natural zeolite and vermiculite to Cu2+ ion
应用式(8)可计算出任意起始离子和吸附剂浓度点上的理论去除率。图3给出了采用式(8)的计算值描绘的去除率曲线。在实践中,一旦给定待处理废水,则可依据处理目标通过图3查出所需的吸附剂浓度,因此图3曲线在处理系统设计中具有一定的参考价值。
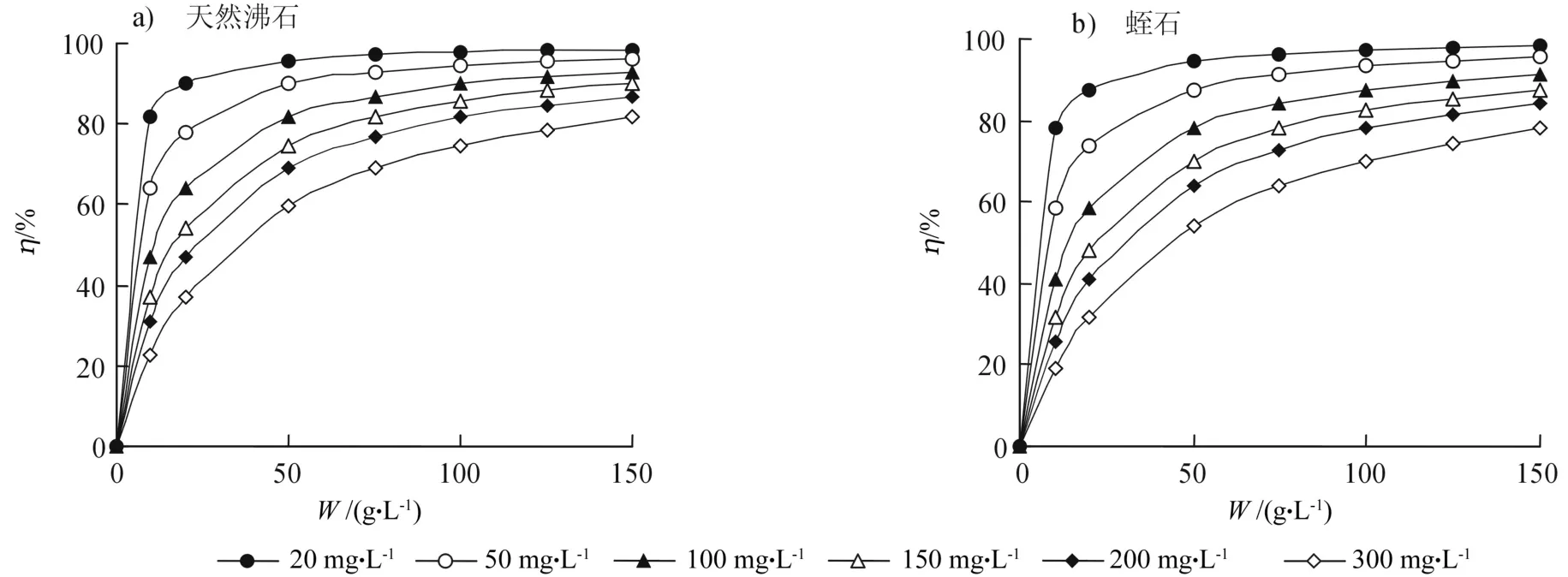
图3 不同吸附剂浓度点上Cu2+离子的去除率Fig. 3 Removal rate of adsorbents to Cu2+ ions with different concentrations
2.3 成本效益
介质填料的成本效益是构建吸附缓冲体系必须考虑的关键问题之一。设待处理废水铜离子的初始离子浓度A0为50 mg/L,目标去除率η为90%,天然沸石的吸附容量p为8.85 mg/g,蛭石的吸附容量p为6.99 mg/g,天然沸石价格为400元/t,运费为250元/t;蛭石价格500元/t,运费300元/t。表2给出了处理1 m3水所需要的成本。天然沸石的单价低,吸附容量大,单位处理成本比蛭石低,因此在人工湿地缓冲吸附单元设计中,天然沸石应该是优于蛭石的介质填料。

表2 不同吸附剂的处理成本†Table 2 Estimated costs with different absorbents
3 结 论
(1)天然沸石和蛭石的吸附容量p值分别为8.85 mg/g和6.99 mg/g,天然沸石的Cu2+离子吸附能力强于蛭石。
(2)由于天然沸石的吸附容量大,天然沸石对Cu2+离子的去除率略高于蛭石。
(3)由于天然沸石的单价低,吸附容量p值大,单位处理成本低于蛭石,因此,天然沸石是人工湿地吸附缓冲单元理想的介质填料。
[1] 吴晓芙,陈明利,蒋丽娟,等.生态型组合人工湿地污水处理工艺[J].城市环境与城市生态,2006,19(2):36-39.
[2] 陈明利,张艳丽,吴晓芙,等.人工湿地植物处理含重金属生活废水的实验研究[J].环境科学技术,2008,31(12):164-168.
[3] 胡胜华,张 婷,周巧红,等.武汉三角湖复合垂直流人工湿地对重金属元素的去除研究[J].生态环境学报,2010,19(10):2468-2473.
[4] Yu Y H, Fang W S, Shen Y F,et al. Use of microbial community to evaluate performance of a wetland system in treating Pb/Zn mine drainage[J]. Environmental Management, 2005,36(6):842-848.
[5] Sardar K, Irshad A, Shah M T,et al. Use of constructed wetland for the removal of heavy metals from industrial wastewater[J].Journal of Environmental Management, 2009, 90(3):451-457.
[6] Aisling D O S, Declan A M, Marinus L O. Removal of sulfate,zinc, and lead from alkaline mine wastewater using pilot-scale surface-flow wetlands at Tara Mines, Ireland[J]. Water and the Environment, 2004, 23(2):58-65.
[7] 黄忠良,胡曰利,吴晓芙,等.人工湿地污水处理系统的蛭石缓冲单元及缓冲能力生物再生研究[J].环境科学学报,2007,27(12):2006-2013.
[8] 黄淦泉,杨昌凤,靳立军,等.人工湿地处理重金属Pb、Cd污水的机理探讨[J].应用生态学报,1993,4(4):456-459.
[9] 周海兰.人工湿地在重金属废水处理中的应用[J].环境科学与管理,2007,32(9):89-91.
[10] 赵振国.吸附作用原理[M].北京:化学工业出版社,2005.
[11] 邹照华,何素芳,韩彩芸,等.吸附法处理重金属废水研究进展[J].环境保护科,2010,36(3):22-24.
[12] 赵杏媛,张有瑜.粘土矿物与粘土矿物分析[M].北京:海洋出版社,1990.
[13] 连亚欣,李科林,肖剑波,等.蛭石吸附及解吸锌离子特性研究[J].环境科学与管理,2009,34(8):65-68.
[14] Mathialagan,Viraraghavan. Adsorption of cadmium from aqueous solutions by vermiculite[J]. Separation Science and Technology,2003,38(1):57-76.
[15] 袁俊生,王静康.钠型斜发沸石Na+-K+离子交换特性研究(I)-离子交换过程热力学特性[J].离子交换与吸附,2004,20(6):541-547.
[16] 王靖宇,刘敬勇,裴媛媛,等.吸附剂在工业废水重金属处理中的应用研究进展[J].安徽农学通报,2011,17(16):128-130.
[17] 郭继香,等.用蛭石吸附法脱除污水中的重金属[J].石油大学学报,1998,22(2):54-57.
[18] 吴平霄,廖宗文,毛小云.高表面活性矿物对Zn2+的吸附机理及其环境意义[J].矿物学报,2001,21(3):335-340.
[19] Wu X F, Zhao F, Chen M L,et al. Factors Affecting the Adsorption of Zn2+and Cd2+ions from Aqueous Solution onto Vermiculite[J]. Adsorption Science and Technology, 2008,26(3):145-155.
[20] Wu X F, Zhao F, Chen M L,et al. A Simple Way of Calculating the Change in the Gibbs’Free Energy of Ion Adsorption Reactions[J]. Adsorption Science and Technology, 2009,27(1):1-17.
[21] Wu X F, Hu Y L, Zhao F,et al. Ion adsorption components in liquid/solid systems[J]. Journal of Environmental Sciences,2006,18(6):1167-1175.
[22] 赵 芳,吴晓芙,黄中子,等.液/固离子吸附体系中的强度因子[J].中南林业科技大学学报(自然科学版),2007,27(1): 109-117.
Adsorptive properties of natural vermiculite and zeolite to Cu2+ion
YAO Yong-ge, LI Yun, PENG Jing, LIU Yi-lin, WU Xiao-fu
(Institute of Environmental Science and Engineering, Central South University of Forestry & Technology, Changsha 410004, Hunan, China)
Vermiculite and zeolite are two common natural minerals with high level of cation exchange capability and surface. The adsorption behaviors of natural zeolite and vermiculite to copper ion were studied. The Cu2+ ion removal rate of natural zeolite was slightly higher than that of the vermiculite. The adsorption capacity (p) of the natural zeolite sample to adsorb Cu2+ and that of the vermiculite to adsorb Cu2+ were found to be 8.85 and 6.99 mg/g. In practical applications, natural zeolite is the ideal medium fi ller in wetlands, because the adsorption capacity of natural zeolite is strong and the unit price and treatment costs of the natural zeolite is lower than that of vermiculite.
natural zeolite; vermiculite; copper ion; adsorption capacity; removal rate; cost of treatment
S714.7
A
1673-923X(2012)12-0083-05
2012-06-13
国家环保部[200909066]、科技部[2012BAC09B03-4]、国家林业局[2010-43];湖南省教育厅重点学科与重点实验室资助
姚咏歌(1987-),女,湖南吉首人,硕士研究生,主要从事环境化学方面的研究;E-mail:yaoyongge.good@163.com
李 芸(1966-),女,湖南省长沙人,副教授,主要从事环境科学的教学与科研工作;E-mail:hnly5659@163.com
[本文编校:罗 列]

