金属硫蛋白对热应激奶牛血淋巴细胞凋亡基因和HSP70基因表达的影响
罗佳捷,吴宗明,张彬*,李丽立,吴力专,陈宇光,肖定福,毕小艳
(1.湖南农业大学动物科学技术学院,湖南 长沙410128;2.中国科学院亚热带农业生态研究所动物生态营养与健康养殖联合实验室 农业生态工程重点实验室,湖南 长沙410125)
热应激对奶牛生产性能、繁殖性能及免疫性能等方面均有不利影响[1-3],探索减少或缓解热应激的途径一直是奶牛饲养业的重大课题之一。金属硫蛋白(metallothionein,MT)是一种低分子量、富含金属和半胱氨酸的功能性结合蛋白,是遍布于哺乳动物各个组织且具有广泛而重要生理学和生物学功能的天然生物活性物质[4]。MT的主要作用是参与微量元素储存、转运和代谢,重金属解毒,拮抗电离辐射,清除羟基自由基,增强机体免疫力,提高抗应激和抗氧化能力,参与DNA的复制、转录和能量代谢的调节过程,其中尤以清除羟基自由基、抗应激和抗氧化的作用大,其研究和开发涉及农业、医药保健、生物工程和环境保护等诸多领域[5-10]。近年来,有关学者初步研究了MT在奶牛体内的代谢规律及其对奶牛抗热应激调控的机理,发现MT能通过提高奶牛体内超氧化物歧化酶(super oxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)基因的表达水平来显著提高奶牛的抗热应激和抗氧化能力[11-14],但此类研究较少,且欠深入。有研究指出,热休克蛋白HSP70和抗细胞凋亡基因Bcl-2均能有效提高机体对抗热应激的能力[15,16],Bax和p53基因则能通过促进机体细胞凋亡来削弱机体抗应激的能力[17-19],而MT对奶牛体内HSP70和细胞凋亡基因表达的影响尚未见报道。本研究拟探索外源性MT对奶牛体内HSP70、Bcl-2、Bax和p53基因表达的影响,为揭示MT调控奶牛抗热应激机理的理论研究及其在奶业安全生产中的应用提供科学依据。
1 材料与方法
1.1 材料及其来源
金属硫蛋白使用湖南农业大学畜禽品质改良实验室建立的方法诱导合成、分离和纯化的奶牛肝脏锌金属硫蛋白(Zn-MT)[20],并用该实验室建立的间接竞争型酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)法定量[21]。
1.2 试验动物的选择、分组与试验设计
本试验于2010年7月27日-8月17日在湖南省畜牧兽医研究所奶牛场进行,选取年龄、体重、胎次、产犊时间、泌乳量及以往泌乳期产奶成绩相近的中国荷斯坦奶牛经产泌乳母牛25头,随机均分为A、B、C、D、E 5组,每组5头。其中A组为对照组,B、C、D、E组为试验组,分别在正式试验开始的当天(1d)每头颈静脉注射经生理盐水溶解的Zn-MT 16.0,24.0,32.0和40.0mg。试验期为15d(1~15d)。
1.3 饲养管理方式
试验奶牛在同一牛舍以双列对尾栓系式饲养,每头牛1个牛床。各组奶牛饲喂相同日粮,日粮系奶牛场参照美国国家研究委员会(national research council,NRC)(2001)和《中国奶牛饲养标准》(2004)自行配制,其组成为(kg/头):玉米3.136、麦麸0.728、豆粕0.504、棉粕0.448、菜粕0.280、酵母粉0.280、磷酸氢钙0.056、石粉0.056、碳酸氢钠0.056、稻草10、象草20;日粮营养水平:产奶净能(net energy for lactation,NEL)86.60MJ/(头·d)、奶牛能量单位(Nainiu Nengliang Danwei,NND)27.60/(头·d)、粗蛋白质(crude protein,CP)1 585.60 g/(头·d)、Ca 57.44g/(头·d)、P 32.80g/(头·d)。专人饲养管理,各组饲养管理方式一致,每天记录产奶量。
1.4 采样
在试验期的第1(注射MT前),7和14天分别从供试奶牛的尾静脉采血。每次采血约为20mL,用肝素钠(3.2mL,250U/mL)抗凝全血,马上分离淋巴细胞或放入4℃冰箱保存待用。
1.5 基因表达分析
1.5.1 引物设计及合成 基因表达分析采用荧光定量逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)法,根据网上(http://www.ncbi.nlm.nih.gov/)发表的基因序列,以Beta-actinmRNA和3-磷酸甘油醛脱氢酶基因(glyceraldehyde-3-phosphate dehydrogease gene,GAPDH)mRNA 作内参,根据GenBank中奶牛的HSP70、Bcl-2、Bax、p53、GAPDH和Beta-actin的基因登陆序列(依次为 BTU09861、BTU92434、BTU92569、BC102440.1、BTU85042和BC142413),用Primer Premier 5.0软件设计引物(表1)。引物均由上海生工生物工程技术服务有限公司合成。
1.5.2 血液淋巴细胞及总RNA的提取 血液淋巴细胞用北京索莱宝科技有限公司生产的淋巴细胞分离液进行提取,所有过程均在无菌操作台上进行。

表1 HSP70、Bcl-2、Bax、p53、GAPDH 和Beta-actin基因的引物设计Table 1 Primer design for HSP70,Bcl-2,Bax,p53,GAPDHand Beta-actin
1.5.3 反转录cDNA 采用 Revert AidTM First Strand cDNA Systhesis Kit反转录试剂盒,按试剂盒说明书操作。
1.5.4 cDNA的RT-PCR反应体系HSP70、Bcl-2、Bax和p53的荧光定量RT-PCR反应体系各成分及加样量见表2。反应条件为:95℃预变性1min,进行如下循环:95℃15s,60℃15s,72℃45s;35个循环后,72℃延伸7min,4℃保存。
1.5.5 RT-PCR产物的检测与相对定量 所得产物用1%琼脂糖凝胶电泳检测条带,条件为:90V,60 min,凝胶电泳成像系统成像,以50bp Marker作对照检验目标条带大小是否与β-actin产物大小相同。本试验中将cDNA 样品进行1,5,25,125,625,3 125倍稀释,对目的基因和内参基因进行PCR扩增,以cDNA稀释倍数取对数值为横坐标,△Ct值为纵坐标作图,得到回归线y=0.062 9x+6.058,R2=0.55,曲线斜率为0.062 9,说明目的基因和内参基因扩增效率基本一致,可以用2-△△Ct法计算本试验中基因相对表达量,即以对照组基因表达量为1倍,处理组表达量为相对于对照组的表达倍数。
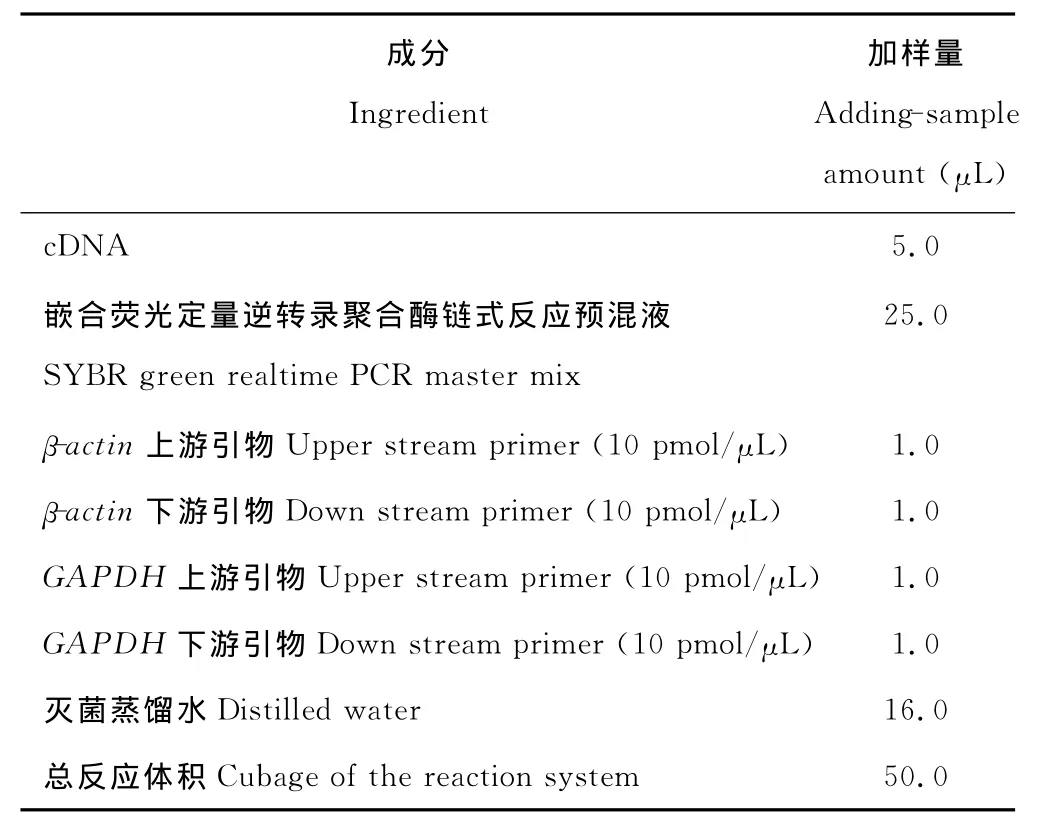
表2 RT-PCR反应体系各成分及加样量Table 2 Ingredients and adding-sample amount of RT-PCR reaction system
1.6 数据处理与统计分析
数据用Excel进行初步处理后,再使用SPSS 16.0统计软件进行成对样本差异显著性检验,结果用平均值±标准误表示,检验误差为5%和1%水平。
2 结果与分析
2.1 不同剂量MT对奶牛产奶性能的影响
注射外源性MT后,各试验组奶牛的产奶性能较A组均有提高(表3),其中B、C组在试验期第7和14天的产奶量均显著(P<0.05)或极显著(P<0.01)高于A组;D、E组在试验期第7天的产奶量虽然较A组有所提高,但差异不显著(P>0.05),而到试验期第14天时差异均达到显著(P<0.05)水平。这说明较低剂量(16.0和24.0mg)的MT在注射后马上发挥了效用,而较高剂量(32.0和40.0mg)的 MT在注射7d后才开始发挥功效。从各试验组奶牛在正式试验期产奶量的平均值看,B、C、D和E组的产奶量比对照组分别高出20.94%(P<0.05)、15.83%(P>0.05)、10.94%(P>0.05)和8.85%(P>0.05)。说明16.0mg的 MT注射量对热应激奶牛产奶性能的改善作用最为显著。

表3 不同剂量MT对奶牛产奶性能的影响Table 3 Effects of MT in different dosages on milk producing ability of dairy cattle kg/d
2.2 不同剂量MT对奶牛HSP70基因表达水平的影响
在正式试验开始的当天(补给外源性MT前),各组奶牛血液中HSP70基因的表达水平均无显著(P>0.05)差异(表4)。补给MT后,4个试验组奶牛HSP70基因的表达水平均有一定程度的提高,其中C组在试验期第14天、D组在试验第7和14天HSP70基因的表达水平均显著(P<0.05)高于对照组。就正式试验期所测奶牛HSP70基因表达水平的平均值看,D组较对照组有显著(P<0.05)提高,而B、C、E组虽高于对照组,但差异不显著(P>0.05)。说明通过注射32.0mg剂量的外源性MT对奶牛HSP70基因表达量产生了积极的影响。

表4 不同剂量MT对奶牛HSP70基因表达水平的影响Table 4 Effects of MT in different dosages on HSP70gene expression levels of dairy cattle
2.3 不同剂量MT对奶牛Bcl-2基因表达水平的影响
补给外源性MT前,各组奶牛血液淋巴细胞中Bcl-2基因的表达水平差异不显著(P>0.05)(表5)。注射MT后,C组在试验期第7和14天、D组在试验期第7天及E组在试验期第14天Bcl-2基因的表达水平均显著(P<0.05)或极显著(P<0.01)高于对照组;而B组Bcl-2基因的表达水平与对照组差异不显著(P>0.05)。从正式试验期各组奶牛Bcl-2基因表达水平的平均值看,C组显著(P<0.05)高于对照组。说明24.0mg剂量的MT对奶牛Bcl-2基因表达的诱导作用最为显著。

表5 不同剂量MT对奶牛Bcl-2基因表达水平的影响Table 5 Effects of MT in different dosages on Bcl-2gene expression levels of dairy cattle
2.4 不同剂量MT对奶牛Bax基因表达水平的影响
在正式试验开始时(注射外源性MT前),各组奶牛血液淋巴细胞中Bax基因的表达水平均无显著(P>0.05)差异(表6)。注射MT后,B组奶牛在试验第7天、D组奶牛在试验期第14天Bax基因的表达水平均显著(P<0.05)低于对照组;B、E组奶牛在试验期第14天及D组奶牛在试验期第7天Bax基因的表达水平虽然较对照组有所降低,但未达到显著(P>0.05)水平;而C组在试验期第7和14天Bax基因的表达水平比对照组有所提高,但差异也不显著(P>0.05)。就正式试验期各组奶牛Bax基因表达水平的平均值看,尽管B、D两组Bax基因的表达水平分别较对照组下降了22.00%(P>0.05)和13.00%(P>0.05),但各组之间差异均未达到显著水平。
2.5 不同剂量MT对奶牛p53基因表达水平的影响
在试验开始时(注射外源性MT前),各组奶牛血液淋巴细胞中p53基因的表达水平均无显著(P>0.05)差异(表7)。注射MT后,B组奶牛在试验期第7天、C组奶牛在试验期第7和14天、D组奶牛在试验期第14天及E组奶牛在试验期第7和14天p53基因的表达水平要显著(P<0.05)或极显著(P<0.01)低于对照组。就正式试验期各组奶牛p53基因表达水平的平均值看,C、E两组分别较对照组下降了22.00%(P>0.05)和34.00%(P>0.05)。说明24.0和40.0mg剂量的外源性MT能对奶牛血液淋巴细胞中p53基因的表达产生一定的抑制作用。

表6 不同剂量MT对奶牛Bax基因表达水平的影响Table 6 Effects of MT in different dosages on Baxgene expression levels of dairy cattle

表7 不同剂量MT对奶牛p53基因表达水平的影响Table 7 Effects of MT in different dosages on p53gene expression levels of dairy cattle
3 讨论
3.1 MT对奶牛产奶性能的影响
张彬等[11]认为,MT是机体内清除自由基能力最强的一种蛋白质,能够有效调控奶牛泌乳量和抗氧化能力,及时清除体内自由基,修复细胞氧化损伤。当牛舍的温湿指数(THI)大于72时,奶牛就处于热应激状态[22],奶牛受热应激的影响,直肠温度、呼吸频率和脉搏等3项生理常数指标均会显著升高,直接影响到奶牛的采食量,并最终导致产奶量的显著下降[23]。在本研究中,试验期间奶牛舍的THI均大于76,说明奶牛一直处于热应激状态。对照组奶牛产奶量的逐步减少反应了热应激对奶牛产生的不利影响,而MT注射组奶牛的产奶量却有不同程度的提高,4个试验组全期产奶量的平均值分别比第1天高出4.41%,4.12%,3.70%和0.97%,分别比对照组高出20.94%,15.83%,10.94%和8.85%,说明MT对奶牛热应激有很好的缓解作用,能有效清除热应激产生的过量自由基,增强奶牛机体抗氧化功能,进而增加采食量,提高奶牛的产奶性能。此外,吴力专等[5]研究发现,奶牛血清中胰岛素(INS)、胰岛素样生长因子Ⅰ(IGF-Ⅰ)和甲状腺素(T3)的含量在注射MT后均显著升高,说明外源性MT还能通过控制奶牛机体产能来调节体温,从而提高奶牛的产奶性能。在本研究中,高剂量的MT发挥作用较晚可能是因为机体对高剂量的外源性物质有一定的排斥性,需要一定的时间来接受和适应;MT提高产奶量的效果随剂量的增加依次降低可能是受到试验期长度的局限,因为高剂量MT发挥作用较晚,因此在试验结束时还没有完全发挥出作用。
3.2 MT对奶牛HSP70基因表达的影响
有研究发现,HSP的合成在细胞应激时会增加,而其他蛋白的合成则减少,并认为HSPmRNA优先翻译是因为细胞内存在识别HSPmRNA 5′前导区特异结构的系统,可以选择性地将其翻译出来[24];Wang和E-dens[25]通过培养牛、羊、马和鸡的淋巴细胞发现,HSP70和HSP90在热应激条件下的表达显著增加。HSP70可以维持细胞内的稳态,以分子伴侣的形式调节其他蛋白质的代谢,HSP70家族在细胞内的高表达或数量的增多可以改善细胞的生存能力,提高热应激耐受力。当机体受到热应激时,HSP70的表达水平一般会立即提高,以保护组织细胞免受氧化应激损伤。MT和HSP70作为2种重要的抗应激蛋白,一般在机体内的表达呈明显的正相关关系,两者之间相互作用,共同增强细胞对各种损害的耐受程度[26]。本研究中,各试验组奶牛体内HSP70基因的表达水平在注射MT后均立刻提高,且平均值比对照组分别提高了19.00%,57.00%,130.00%和17.00%,说明外源性MT可能通过抗氧化途径进一步激活了HSP70基因的表达,从而达到更好缓解奶牛热应激的目的,且存在明显的剂量效应。其中,D组的水平明显好于其他组,表明32.0mg的MT注射量对于提高HSP70基因的表达是最为有利的;而E组的水平与D组相比又陡然下降,这可能是因为E组外源性MT的注射剂量过高,使动物机体由于排斥性等问题不能完全的将其利用,致使其效应反不如注射剂量稍低的D组。
3.3 MT对奶牛Bcl-2、Bax和p53基因表达的影响
本研究之所以探索MT对奶牛血淋巴细胞Bcl-2、Bax和p53基因表达水平的影响,是基于MT及细胞凋亡基因对机体抗热应激的重要性。Bcl-2是动物机体内重要的抗凋亡基因,能够有效延长细胞周期[27];Bax属于Bcl-2家族,通过与Bcl-2形成二聚体抑制Bcl-2的功能,从而促进细胞凋亡;p53调控一些仅有BH3区域的蛋白,作为Bax的上游调控基因,诱导细胞凋亡的功能十分显著[28,29]。p53作为促细胞凋亡因子,其高表达能上调Bax的表达和减少Bcl-2的表达,促进细胞凋亡;而Bcl-2又能抑制p53介导的细胞凋亡。当p53基因失活时,引起Bcl-2家族基因调控失衡,凋亡抑制基因Bcl-2的表达水平升高,导致靶细胞不易诱发细胞凋亡[30],因而p53与Bcl-2家族基因的调控作用是相互联系的。热应激能增加HSP的释放而增加机体免疫力,抑制细胞凋亡,HSP70和HSP90通过与p53形成复合体来阻碍p53进入细胞核,从信号传导途径上抑制了细胞凋亡[31]。孙忠东等[32]研究表明,MT的高表达可以抑制心肌细胞凋亡,Bcl-2表达增多同时Bax和Fas表达明显减少;Shimoda等[33]也曾提出MT是细胞凋亡的抑制剂。本研究中,各剂量的MT均使Bcl-2基因的表达水平明显升高,基本上与HSP70基因表达水平升高的趋势相一致,其中24.0mg剂量组达到显著水平;在Bcl-2基因表达水平升高的同时,Bax和p53基因的表达水平也呈现下降的趋势,说明外源性MT能通过增加HSP70的表达来抑制p53基因的促凋亡功能。但B组在试验期第14天和D组在试验期第7天p53基因的表达呈现出相对较高的水平,B组可能是因为外源性MT剂量不够,而D组则可能是由于试验前期MT要大量清除氧化自由基,促进细胞凋亡,加速修复热应激所致细胞损伤,因而促进了p53基因过表达,试验后期奶牛应激趋于平稳,细胞应激敏感性降低,为维持机体稳定代谢,抑制细胞凋亡,p53基因的表达水平逐步降低。
[1]West J W.Effects of heat-stress on production in dairy cattle[J].Journal of Dairy Science,2003,86:2131-2144.
[2]李建国.热应激对奶牛生理常值、血液生化指标、繁殖及泌乳性能的影响[J].河北农业大学学报,1998,21(4):69-74.
[3]Gwazdauskas F C.Effects of climate on reproduction in cattle[J].Journal of Dairy Science,1985,68:1568-1578.
[4]吴力专,李丽立,张彬.金属硫蛋白在动物营养学上的应用[J].长江大学学报(自然科学版),2006,3(1):156-160.
[5]吴力专,陈海燕,张彬,等.外源性金属硫蛋白对中国荷斯坦奶牛产能性能和内分泌的影响[J].草业学报,2011,20(1):183-188.
[6]Ajij H R,Kojima Y.Chemistry and biochemistry of metallothionein[J].Experimental Biology,1987,52:25-61.
[7]De S K,McMaster T,Andrews G K.Endotoxin indution of metallothionein in gene expression[J].Journal of Biochemistry,1990,265(25):1526-1538.
[8]Green E M,Adams H R.New perspectives in circultory shock:Pathophysiologic mediator of the mammalian response to endotoxemia and sepsis[J].Journal of American Veterinary Medicine,1992,200(12):1817-1826.
[9]Miura T,Muroaka S,Ogiso T,et al.Antioxidant activity of metallothionein compared with reduced glurathione[J].Life Science,1997,60(21):301.
[10]Kondoh M,Inoue Y.Specific induction of metallothionein synthesis by mitochondrial oxidative stress[J].Life Science,2001,69:2137-2146.
[11]张彬,谭琼,肖兵南,等.外源性金属硫蛋白对奶牛生产性能和抗氧化状况的影响[J].草业学报,2009,18(6):137-143.
[12]张彬,肖定福,李丽立,等.金属硫蛋白在奶牛公犊体内的代谢规律研究[J].草业学报,2008,17(6):178-184.
[13]张彬,薛立群,李丽立,等.外源金属硫蛋白对奶牛抗热应激调控及SOD基因表达的影响[J].应用生态学报,2007,18(1):193-198.
[14]张彬,谭琼,李丽立,等.金属硫蛋白对奶牛血液抗氧化酶GSH-Px和CAT基因表达的影响[J].草业学报,2010,19(3):132-138.
[15]Xu C S,Xin Z H,Yuan J Y.Advance in research on biological function and transcriptional control of heat shock proteins[J].Developmental and Reproductive Biology,2002,11(2):88-94.
[16]宋学立,钱令嘉,李凤芝,等.Bcl-2基因转染对热应激心肌细胞保护作用的机制探讨[J].中国应用生理学杂志,2002,18(4):347-349.
[17]Santini D,Tonini G,Vecchio F M,et al.Prognostic value of Bax,Bcl-2,p53,and tunel staining in patients with radically resected ampullary carcinoma[J].Journal of Clinical Pathology,2005,58(2):159-165.
[18]Karin A,Marsha V,Mieke B B,et al.Estrous cycle dependent changes in expression and distribution of Fas,Fas ligand,Bcl-2,Bax,and active caspase-3in the rat ovary[J].Journal of Endocrinology,2006,188(2):179-192.
[19]Sheard M A.Lonizing radiation as a response-enhancing agent for CD95-mediated apoptosis[J].International Journal of Cancer,2001,96(3):213-220.
[20]李丽立.一种猪肝金属硫蛋白提取方法:中国,ZL 200410013212.X[P].2006-04-17.
[21]张彬,吴力专,李丽立.一种猪金属硫蛋白的测定方法:中国,ZL 200410061265.9[P].2007-05-07.
[22]Lemerle C,Goddard M E.Assessment of heat stress in dairy cattle in Papua New Guinea[J].Tropical Animal Health and Production,1986,18(4):232-242.
[23]杨毅,梁荣嵘,刘庆华.轻微至中度热应激对荷斯坦奶牛生理指标及产奶性能的影响[J].中国农学通报,2009,25(24):28-31.
[24]McGarry T J,Lindquist S.The preferential translation of Drosophila HSP70mRNA requires sequences in the untranslated leader[J].Cell,2005,42(17):903-910.
[25]Wang S,Edens F W.Stress-induced heat shock protein synthesis in peripheral leukoeytes of turkeys,Meleagris gallopavo[J].Comparative Biochemistry and Physiology,1993,106:621-628.
[26]邱恩惠.慢性鼻窦炎嗅觉障碍嗅上皮中HSP70、MT及NSE的表达及意义[D].福州:福建医科大学,2009.
[27]Vaux D L,Cory S,Adams J M.Bcl-2gene promotes haemopoietic cell survival and cooperates witn c-myc to irnrnortalize pre-B cell[J].Nature,1988,335(6189):440-442.
[28]Alvarez S,Drane P,Meiller A.A comprehensive study of p53transcriptional activity in thymus and spleen of gamma irradiated mouse:High sensitivity of genes involved in the two main apoptotic pathways[J].International Journal of Radiation Biology,2006,82(11):761-770.
[29]Vanlandingham J W,Tassabehji N M,Somers R C,et al.Expression profiling of p53-target genes in copper-mediated neuronal apoptosis[J].Neuromolecular Medicine,2005,7(4):311-324.
[30]Zhan Q,Alamo I,Yu K,et al.The apoptosis-associated gamma-ray response of Bcl-xl depends on normal p53function[J].Oncogene,1996,13(10):2287-2293.
[31]林如辉,刘健.热疗与肿瘤细胞凋亡相关基因的研究进展[J].实用临床医药杂志,2006,10(3):12-15.
[32]孙忠东,高尚志,毛志福.金属硫蛋白对供心细胞Bcl-2、Bax和Fas蛋白表达的影响[J].中华实验外科杂志,2005,22(3):375.
[33]Shimoda R,Achanzar W E,Qu W,et al.Metallothionein is a potential negative regulator of apoptosis[J].Toxicological Sciences,2003,73(2):294-300.

