青藏高原东缘中国沙棘的克隆多样性及克隆结构
许璐,苏雪,董莉娜,张辉,陈纹,江龙龙,刘泾霞,孙坤
(西北师范大学生命科学学院,甘肃 兰州730070)
*无性生殖习性是植物界普遍存在的一种现象,具无性生殖习性的植物(克隆植物)具有可塑性强、繁殖速度快的特点,可在短期内占据各种不同生境,尤其是不良环境[1],对物种的生存具有重要的意义。很多植物种类可以通过克隆生长产生与母株遗传上完全相同的后代[2,3],产生的无性系分株成活率高,提高了其在非最适条件,尤其是在恶劣环境条件(如高山和极地地区)下的生存力[4]。植物种群的克隆结构及克隆多样性是进化过程中适应环境的结果,深入研究种群的克隆结构及克隆多样性对了解克隆植物的种群形成、维持和衰退机制等有重要意义[5,6]。由于在野外精确鉴定克隆基株存在很大难度,严重制约了植物克隆结构和克隆多样性的研究。近年来,一些基于PCR的DNA分子标记技术的发展为准确鉴定克隆基株提供了可靠的技术保障,已开始被用于植物克隆多样性及克隆结构的研究[7-9]。
中国沙棘(Hippophaerhamnoidesspp.sinensis)为我国的特有类群,是群落演替的先锋物种,具有重要的水土保持和经济价值,主要分布于海拔400~3 100(3 900)m的山坡、草甸、谷地、河岸或干涸河床,在青藏高原东缘至黄土高原极为普遍。中国沙棘可通过根的萌蘖进行克隆繁殖,其根系主要由垂直根系和水平根系组成,克隆繁殖主要通过水平根系进行。迄今为止,对中国沙棘克隆生长的研究主要集中在外源激素、土壤水分对中国沙棘栽培群体克隆生长的影响[10,11]、中国沙棘克隆生长的生态学意义[12]和种群稳定性维持途径[13]等方面,而对自然生长的中国沙棘居群克隆结构和克隆多样性仍缺乏了解。为此,本研究使用RAPD作为遗传标记,对青藏高原东缘甘南藏族自治州的8个中国沙棘自然居群的克隆多样性和克隆结构进行了初步研究,旨在揭示沙棘属植物的克隆繁殖能力和克隆分布特点,并为探讨高山克隆植物对环境的适应性策略提供科学依据。
1 材料与方法
1.1 研究区概况
研究地点位于青藏高原东缘的甘肃省甘南藏族自治州合作市境内,平均海拔3 000m,属典型的高原大陆性气候,年平均降水量400~800mm,多集中于5-9月,年平均气温1~3℃[14]。分布于甘南的中国沙棘群落平均株高为1~5m,灌木层盖度60%~95%,草本层盖度50%~80%。在合作市郊和党智沟分别选取中国沙棘自然居群各4个,设置大小为5m×6m的样方,在样方内间隔1m进行个体采样,并详细绘制所采个体在居群内的位置(图1),摘取新鲜、无虫斑和病斑的幼嫩叶片,硅胶快速干燥后用于DNA提取。在野外调查并记录中国沙棘居群平均株高、群落优势种及生境的特征。具体采样地点及居群特征见表1。
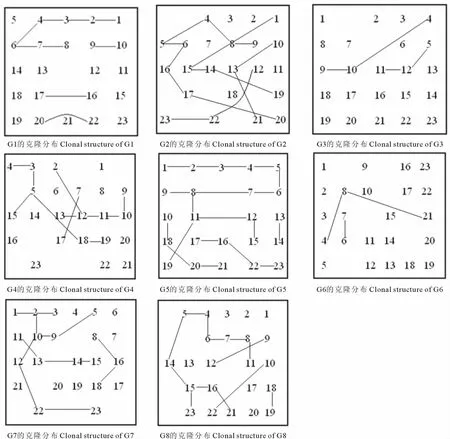
图1 8个中国沙棘居群的克隆空间分布Fig.1 Clonal spatial distribution of eight H.rhamnoides populations
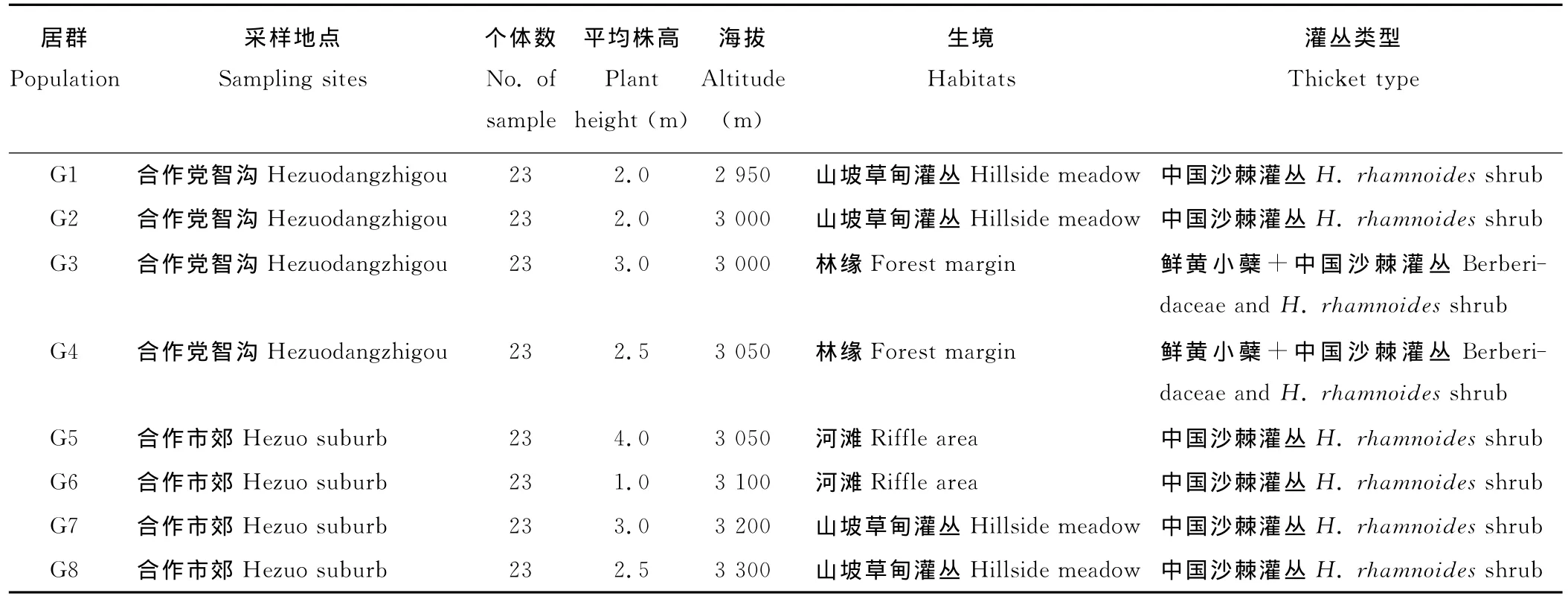
表1 中国沙棘采样地点及生境条件Table 1 The habitats in sampling sites of H.rhamnoides spp.sinensis
1.2 总DNA的提取与检测
采用改良的 CTAB法提取样品总 DNA[15],0.8%琼脂糖凝胶检测DNA样品浓度,用去离子的灭菌水稀释DNA至20ng/μL左右,置于4℃冰箱备用。
1.3 引物的筛选及PCR扩增和产物检测
采用陈纹[16]在沙棘属遗传多样性研究中筛选出的14条可以在中国沙棘居群内扩增形成清晰、稳定、重复性高、多态性丰富的随机引物作为扩增引物(表2)。
每个居群对全部个体进行PCR扩增。采用10 μL的反应体系:DNA模板(5ng/μL)2μL;10×扩增缓冲液(500mmol/L Tris-HCl pH 8.3,2.5mg/mL的牛血清白蛋白(BSA),20mmol/L MgCl2)1μL;各200μmol/L dNTPs(上海Sangon生物工程公司)1μL;ED(10mmol/L Tris-HCl pH 8.3,2.5mg/mL BSA)1 μL;0.1μL(5U/μL)TaqDNA聚合酶(上海Sangon生物工程公司);15ng/μL引物(上海Sangon生物工程公司)2μL;10%Ficoll(10mmol/L酒石黄,75μg/μL Ficoll 400)1μL;灭菌水1.9μL。PCR反应在德国产Biometra PCR仪上进行。扩增程序为:95℃60s;95℃5s,37℃40s,72℃70s,1个循环后,95℃5s,37℃40s,72℃70s,39个循环,最后延伸72℃4min。PCR产物用1.5%的琼脂糖凝胶电泳分离,溴化乙锭染色,UVI凝胶图像分析仪观察并照相。

表2 用于中国沙棘克隆结构研究的引物及序列Table 2 Sequences of primers used in analysis of H.rhamnoides spp.sinensis clonal structure
1.4 数据统计与分析
根据产物在电泳图谱中的位置,按扩增阳性(1)和扩增阴性(0)记录电泳谱带,出现扩增条带的记为1,相应位置无扩增条带的记为0,形成RAPD表型的0/1数据矩阵。应用NTSYS软件计算J&C遗传距离。居群内个体间遗传距离为0表示基因型相同,确定为同一基株克隆形成的不同分株。
中国沙棘的克隆多样性水平用以下3个指数来判断:
1)基因型比率(PD)[17]:PD=G/N,其中G表示应用RAPD标记所能检测到克隆繁殖的基因型,即基株数;N表示样本数;由于PD受采样策略和分株数目的影响,所以同时采用另一个更为客观的指数来衡量克隆多样性,即G/n,其中n为克隆繁殖形成的分株个数[18]。
2)Simpson’s多样性指数(D):通过Simpson多样性指数可以估计居群内克隆的多样性水平[19]。公式为:D=1-{∑ni(ni-1)]/[N(N-1)]}[20]。式中,ni表示基株i形成的分株数目;N为检测的样本数。D的变化范围在0(居群由1种基因型构成)~1(居群内每一分株都由不同的基株形成)。
3)Fager’s指数(E)[21]:用来描述居群内不同基因型分布的均度。可由下式计算得出:E=D/Dmax,其中Dmax=[N(n-1)]/[n(N-1)]。n表示每克隆繁殖形成的克隆数;N表示检测的样本数。
2 结果与分析
2.1 中国沙棘RAPD扩增
用14条随机引物对8个中国沙棘居群共184个个体进行PCR扩增,14条随机引物平均形成55.75种条带,平均有15.13种条带在中国沙棘居群内表现出多态性,平均多态条带百分率为27.64%。
2.2 克隆多样性
中国沙棘居群不同基因型比例(G/n)从0.15到0.67不等(表3),平均为0.35,G6居群最高,G5居群最低;基因型比率(PD)平均为0.14;Simpson’s多样性指数在G3、G6居群最高(0.99),G5居群的最低(0.69),平均为0.85。中国沙棘居群的Fager’s均匀度指数(E)的平均值为0.87,各居群的E值为0.70~1.00。
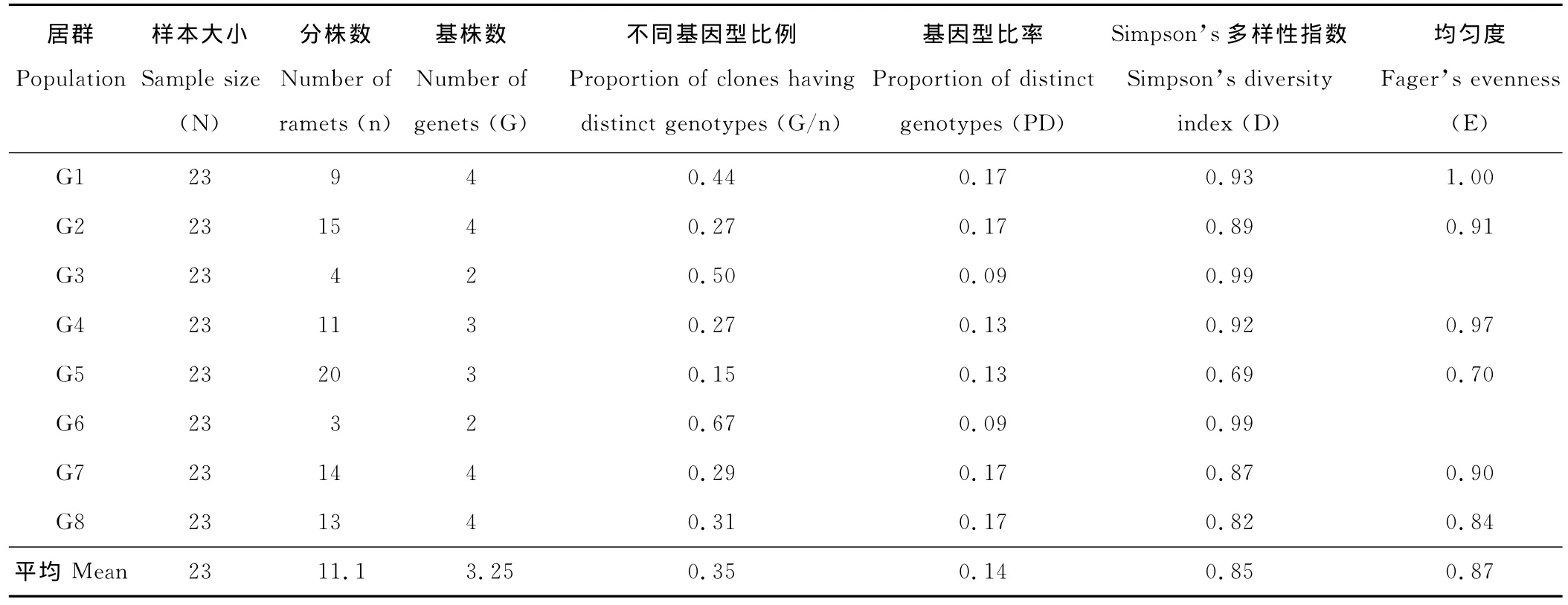
表3 中国沙棘居群的克隆多样性Table 3 Clonal diversity in populations of H.rhamnoides spp.sinensis
2.3 克隆大小与克隆分布
8个中国沙棘居群共鉴别出26种不同的基因型(基株)。26种基株通过克隆繁殖形成的分株数分别为1~12个,共形成89个分株(表4)。中国沙棘各居群可检测到的产生克隆分株的基株数平均为3.25个,平均克隆大小为每基株形成3.4个分株,65%的基株可形成1个以上的分株。
中国沙棘居群内同一基株形成两分株间的最大距离为5.8m,最小距离为1.0m。每基株形成分株之间最大距离的平均为3.4m。26种基株形成的89个分株间的总距离为138.2m,每克隆内分株间的平均距离为1.75 m;同一克隆内分株间的总距离为1.0~15.3m。8个中国沙棘居群的具体克隆分布情况如图1。总体上,中国沙棘同一基株产生的克隆分株间的距离较大,分株的分布比较离散,即克隆分布主要为游击型(guerilla growth form)分布。中国沙棘居群内能够进行克隆繁殖的基株数目(克隆数目)为2~4个,但各居群内的克隆繁殖却主要是由其中1种基株为主进行的,如基株类型g1-1、g2-1、g4-1 、g4-2 、g5-1 、g7-1 和g8-1在各居群中产生的分株数和分株的扩散能力都占优势(表1,图1)。不同基株形成分株的能力和分布特点表明中国沙棘的克隆繁殖主要是以某一优势基株类型为主的方式。
2.4 居群株高和群落结构对中国沙棘克隆多样性的影响
中国沙棘的克隆多样性指数与居群株高之间表现出一定的相关性。除居群G3(平均株高3m)外,随着居群平均株高的增加,克隆多样性水平有下降的趋势(图2)。居群G5的平均株高最大,在4m左右,但Simpson’s多样性指数(D)、G/n值在8个居群间最低。最年轻的居群G6(平均株高1m)的G/n和D值最高。另外,分布于林缘灌丛类型为鲜黄小蘗+中国沙棘的G3和G4居群相对于其他以中国沙棘为单优势种的灌丛中分布的中国沙棘居群具有较高的Simpson’s多样性指数,D值分别为0.99和0.92。同一地点的中国沙棘自然居群,克隆多样性与海拔之间并未表现出规律性的变化。
3 讨论
3.1 中国沙棘克隆多样性
植物的克隆多样性与其繁殖特性有关[22],中国沙棘为雌雄异株、风媒传粉的木本植物,可通过根的萌蘖进行克隆繁殖。与同是木本、雌雄异株的植物[如栎属的Quercuschrysolepis、欧洲山杨(Populustremula)[18,23]]相比,青藏高原东缘的中国沙棘自然居群检测到的克隆多样性指数较低:基因型比率(PD)平均值为0.14;Simpson’s多样性指数(D)平均值为0.85;Fager’s均匀度指数(E)平均值为0.87。水生植物具有很强的克隆繁殖能力,Chen等[24]应用RAPD分子标记对水生植物宽叶泽苔草(Caldesiagrandis)克隆多样性的检测结果为PD=0.37,D=0.91,E=0.78。本研究结果表明,中国沙棘居群的克隆多样性也低于水生植物宽叶泽苔草的克隆多样性水平。可见,中国沙棘的克隆繁殖能力较强。本研究的8个中国沙棘居群都生长于高山环境,克隆繁殖占有一定的优势是其适应高寒环境的繁殖对策。克隆生长可以使克隆植物同一基因型内资源共享与风险分摊,通过顶端优势减小克隆分株内的竞争,相对精确的分株放置和空间入侵,并迅速吸收有限资源并储备供将来使用以及能有效地寻找空间,利用异质性生境,增加了种群适合度[25,26]。

表4 中国沙棘各居群内的克隆数及克隆分株间的距离Table 4 Clones number and the distance between ramets in populations
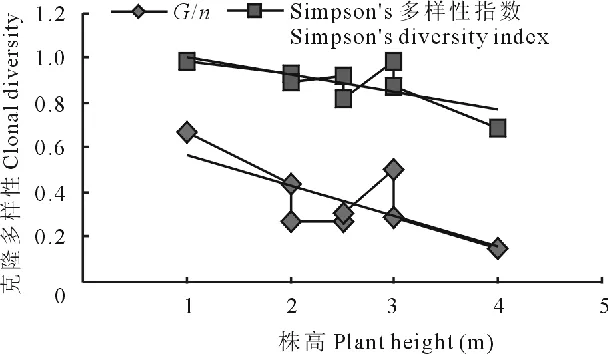
图2 居群内平均株高与克隆多样性的关系Fig.2 Relationship between average plant height and clonal diversity
3.2 中国沙棘克隆大小和分布
本研究的8个中国沙棘居群均表现出一定的克隆扩散能力(表4),表现为每克隆内分株间的平均距离为1.75m,同一克隆内分株间的最大距离可达到15.3m,平均克隆大小为每基株形成3.4个分株,65%的基株可形成1个以上的分株。Suvanto和Latva-Karjanmaa[23]研究发现风媒传粉雌雄异株的木本植物欧洲山杨每基株可形成分株2.1个,能够形成1个以上分株的基株占64%。同为风媒传粉、雌雄异株的木本植物中国沙棘居群的平均克隆大小要高于欧洲山杨。中国沙棘同一基株的克隆分株间的距离较大,分株的分布比较离散,其克隆分布主要表现为游击型的分布特点。游击型克隆植物具有很强的克隆扩散能力,宜于利用分散分布的资源,属于资源开拓型[27,28]。这一分布特点有助于其在异质的高原环境下积极寻找适宜的生存条件。
青藏高原东缘的中国沙棘克隆繁殖主要表现为居群内存在以优势基株为主的克隆扩增。不同居群包含的克隆数目虽然为2~4个,但是每基株拥有的分株数却从1~12个不等,并且在多数的居群中都有1~2种基因型占据相当大的比例。青藏高原边缘自然分布的中国沙棘往往形成密集的沙棘灌丛,群落形成过程中的竞争主要是在种内个体之间进行,个体间的自疏现象影响了中国沙棘的克隆大小。不同的克隆(基因型)对环境具有不同的适应性,那些适应生长环境的克隆个体势必会在整个居群中长期占有优势,这可能是中国沙棘克隆繁殖过程中存在优势基株类型的原因。
3.3 中国沙棘克隆多样性和克隆结构的影响因素
种群年龄和生态因子等都会影响植物的遗传分化、克隆多样性和克隆分布[6]。研究表明,中国沙棘居群的定居时间可能对克隆多样性存在有明显的影响。中国沙棘居群的平均株高在一定程度上可以反映居群的相对定居时间。总体上中国沙棘居群在定居的早期(如居群G6),其克隆多样性较高,克隆繁殖现象不明显。当居群内的植株形成高大乔木,整个居群处于稳定的生长阶段时,克隆繁殖则占有绝对优势。这可能是由于随着定居时间的增加,居群内竞争能力较强的植株通过克隆繁殖,形成更多的分株,获得最佳的生存资源,排挤居群内的其他植株并抑制其克隆繁殖,形成了某一优势基株占优势的分布特点。草本植物蛇莓(Duchesneaindica)的克隆繁殖也表现出在种群建立不久有最高的克隆多样性,随着时间的推移,种群中克隆多样性逐渐降低[29]。环境的变化可以调节有性繁殖和克隆繁殖之间的平衡,是影响居群克隆多样性和克隆结构的一个机制[30]。中国沙棘的克隆多样性与生境之间表现出一定的联系。例如,居群G5是生长于河滩的以中国沙棘为优势种的沙棘灌丛,水源充足,不存在种间竞争,其长势旺盛,克隆繁殖现象明显,Simpson’s多样性指数和均匀度E在8个居群中都最低,且同一克隆分株间的总距离高达15.3m,由1个优势基株(G5-1)形成了12个分株。而分布于林缘阴坡和半阴坡的居群G3和G4则表现出了较弱的克隆繁殖能力。这2个居群均生长于以鲜黄小蘗和中国沙棘为共优种的灌丛,群落内存在较强的种间竞争可能是中国沙棘居群内克隆繁殖受到一定程度抑制的原因。Nicotra和Rodenhouse[31]也提出植物对资源可利用性的竞争会影响克隆植物的多样性。另外,前人对蛇莓[29]和菊科Rutidosis leiolepis[32]的研究表明,其克隆繁殖能力随着海拔的升高而增强。但本研究对合作党智沟和市郊2个样地不同海拔中国沙棘克隆多样性的研究表明,其克隆多样性与海拔之间没有表现出明显的相关性。本研究中,两样地中国沙棘的海拔仅有100~250m,海拔不明显可能是未检测到其克隆多样性与海拔之间相关性的原因,今后还需要进行更深入的研究才能揭示中国沙棘克隆多样性与海拔之间是否存在相关性。
[1]Barret S C H,Shore J S.Isozyme variation in colonizing plants[A].Soltis D E,Soltis P E.Isozymes in Plant Biology[M].Portland:Dioscorides Press,1989:106-126.
[2]董鸣.资源异质性环境中的植物克隆生长:觅食行为策[J].植物学报,1996,38:828-835.
[3]李洁英,解安霞,白昌军,等.周期性去叶对地毯草克隆生长的影响[J].草业学报,2011,20(3):115-121.
[4]Kudoh H,Shibaike H,Takasu H.Genet structure and determinants of clonal structure in a temperate deciduous wood land herb,Uvulariaperfoliata[J].Journal of Ecology,1999,87:244-257.
[5]阮成江,何祯祥,周长芳.当前分子生态学的研究热点和展望[A].植物分子生态学[M].北京:化学工业出版社,2005.
[6]李海燕,李建东,徐振国,等.内蒙古图牧吉自然保护区羊草种群营养繁殖特性的比较[J].草业学报,2011,20(5):19-25.
[7]Hangelbroek H H,Ouborg N J,Santamara L,etal.Clonal diversity and structure within a population of the pondweedPota-mogetonpectinatusforaged by Bewick’s swans[J].Molecular Ecology,2002,11:2137-2150.
[8]Li A,Ge S.Genetic variation and clonal diversity ofPsammochloavillosa(Poaceae)detected by ISSR markers[J].Annals of Botany,2001,87:585-590.
[9]Ruggiero M V,Reusch T B H,Procaccini G.Local genetic structure in a clonal dioecious Angiosperm[J].Molecular Ecology,2005,14:957-967.
[10]李甜江.木本植物中国沙棘克隆生长对外源激素的响应[D].昆明:西南林学院,2008.
[11]贺斌,李根前,李周岐,等.木本克隆植物中国沙棘种群数量与结构对土壤水分的响应[J].西北农林科技大学学报:自然科学版,2007,3:183-187.
[12]贺斌,李根前,徐德兵.沙棘克隆生长及其生态学意义[J].西北林学院学报,2006,21(3):54-59.
[13]徐德兵,李根前,贺斌,等.克隆植物中国沙棘种群稳定性维持途径的探讨[J].国际沙棘研究与开发,2006,4(4):44-48.
[14]王莺,夏文韬,梁天刚.基于CASA模型的甘南地区草地净初级生产力时空动态遥感模拟[J].草业学报,2011,20(4):316-324.
[15]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemistry Bulletin,1987,9:11-15.
[16]陈纹.沙棘属几个中国特有类群的遗传多样性研究[D].兰州:西北师范大学,2004.
[17]Ellstrand N C,Roose M L.Patterns of genotypic diversity in clonal plant species[J].American Journal of Botany,1987,74(1):123-131.
[18]Montalvo A M,Conard S G,Conkle M T,etal.Population structure,genetic diversity,and clone formation inQuercus chrysolepis(Fagaceae)[J].American Journal of Botany,1997,84:1553-1564.
[19]Parker E D.Ecological implications of clonal diversity in Parthenogenetic microspecies[J].American Zoologist,1979,19:753-762.
[20]Pielou E C.The measurement of diversity in different types of biological collections[J].Journal of Theoretical Biology,1966,13:131-144.
[21]Fager E W.Diversity:a sampling studying[J].American Naturalist,1972,106:293-310.
[22]Navas M L,Gasquez J.Genetic diversity and clonal structure ofRubiaperegrinain Mediterranean vineyard and unmanaged habitats[J].Weed Research,1991,31:247-256.
[23]Suvanto L I,Latva-Karjanmaa T B.Clone identification and clonal structure of the European aspen (Populustremula)[J].Molecular Ecology,2005,14(9):2851-2860.
[24]Chen J M,Gituru W R,Wang Y H.The extent of clonality and genetic diversity in the rareCaldesiagrandis(Alismataceae):Comparative results for RAPD and ISSR markers[J].Aquatic Botany,2006,84:301-307.
[25]罗学刚,董鸣.匍匐茎草本蛇莓克隆构型对土壤养分的可塑性反应[J].生态学报,2001,21(12):1957-1963.
[26]董鸣,张淑敏,陈玉福.匍匐茎草本蛇莓对基质养分条件的克隆可塑性[J].植物学报,2000,42(5):518-522.
[27]陆建英,马瑞君,孙坤.珠芽蓼种群克隆多样性及克隆结构的初步研究[J].植物生态学报,2007,31(4):561-567.
[28]宋明华,董鸣.群落中克隆植物的重要性[J].生态学报,2002,22(11):1960-1967.
[29]李钧敏,金则新.匍匐茎草本植物蛇莓小尺度克隆结构[J].生态学报,2009,29(7):3540-3548.
[30]Jacquemyn H,Brys R,Honnay O,etal.Local forest environment largely affects below-ground growth,clonal diversity and fine-scale spatial genetic structure in the temperate deciduous forest herbParisquadrifolia[J].Molecular Ecology,2005,14:4479-4488.
[31]Nicotra A B,Rodenhouse N L.Intraspecific competition inChenopodiumalbumvaries with resource availability[J].American Midland Naturalist,1995,134:90-98.
[32]Young A G,Hill J H,Murray B G.Breeding system,genetic diversity and clonal structure in the subalpine forbRutidosisleiolepisF.Muell(Asteraceae)[J].Biological Conservation,2002,106:71-78.

