虎杖根茎中蒽醌类成分的体外抗氧化活性
王桂芹,郑玉华,钱进芳
衰老的自由基学说是 1956年提出的,此后,人们逐步认识到人体的衰老以及许多疾病都与体内氧化过程中产生的自由基有关[1]。过剩的自由基可作用于血液、细胞、组织等,产生脂质过氧化物,这些过氧化物可以使细胞膜丧失功能,造成细胞活力下降、组织器官功能衰退。细胞内自由基产生的损伤可以导致癌症、心血管疾病和免疫系统衰退等多种退变性疾病[2]。因此,补充外源性抗氧化物对人体健康非常重要,其中以天然抗氧化物为佳[3]。
虎杖 (ReynoutriajaponicaHoutt.)隶属于蓼科(Polygonaceae)虎杖属 (ReynoutriaHoutt.),为多年生草本植物,其根茎可药用,具有活血、散瘀、通经及镇咳等功效[4]。虎杖体内含有多种生物活性物质,蒽醌类化合物是其主要成分之一[5]。目前,关于虎杖的研究多集中于总醌和白藜芦醇的提取及分布规律方面[6],有关虎杖体内蒽醌类成分抗氧化活性方面的研究鲜见报道。
鉴于此,作者通过体外实验体系对虎杖根茎中蒽醌类成分的抗氧化活性进行了研究,以期为虎杖资源的深度开发和利用提供一定的实验依据。
1 材料和方法
1.1 材料
供试新鲜虎杖根茎取自安徽科技学院药用植物园;所用小白鼠 (MusmusculusA lbus)由安徽科技学院动物科学学院提供。
所用仪器有:GL-20G-11型高速冷冻离心机(上海安亭仪器厂生产)、FA 2004型电子天平 (上海天平仪器厂生产)和 7230G可见分光光度计(上海分析仪器厂生产)。
主要试剂有:1,1-二苯基苦基苯肼 (DPPH·) (Sigm a公司产品)、菲咯嗪 (Ferrozine)(Fluka公司产品)、谷胱甘肽过氧化物酶(GSH-px)试剂盒及丙二醛 (MDA)试剂盒(南京建成生物工程研究所生产)、1,8-二羟基蒽醌 (批号:0829-9702,由中国药品生物制品鉴定所提供),其他试剂均为国产分析纯。
1.2 方法
1.2.1 蒽醌类成分的提取、纯化和含量测定方法
1.2.1.1 标准曲线的制作 准确称量 1,8-二羟基蒽醌 5.00m g,用乙醚溶解并定容至50mL,配成质量浓度为 0.1m g·mL-1的对照品溶液。精密吸取对照品溶液 0.00(CK)、0.20、0.40、0.60、0.80、1.00和 1.20mL,于 60℃水浴中蒸除乙醚,用质量分数0.5%乙酸镁 -甲醇溶液溶解并定容至 10 mL。摇匀,于波长510 nm处测定溶液的吸光值。以对照品质量浓度为横坐标x、吸光值为纵坐标y绘制标准曲线。
1.2.1.2 蒽醌类成分的提取与纯化 将虎杖的新鲜根茎用自来水洗净、切片,于55℃电热恒温鼓风干燥箱中干燥至恒质量,粉碎并过 40目筛。共取 10 g干粉,按照 1 g干粉加45mL的比例加入体积分数80%乙醇,混合后置于 40℃条件下超声提取 30 m in, 4 500 r·m in-1离心 10 m in,上清液即为蒽醌类成分的粗提液。
采用 D 101大孔吸附树脂对粗提液进行纯化。参照文献[7]的方法对大孔吸附树脂进行预处理,然后加入 15倍树脂床体积的粗提液,参照文献[8]的方法洗脱,洗脱液流速 2mL·m in-1。此过程中使用0.01mo l·L-1NaOH溶液进行跟踪检测,收集所有活性洗脱液,混合均匀后作为待测液。按照标准曲线的测定方法测定待测液的吸光值并根据标准品的回归方程计算出待测液中蒽醌类成分的质量浓度。
1.2.2 体外抗氧化活性测定方法
1.2.2.1 肝组织匀浆中 GSH-px活力的测定 按照文献[9]的方法制备小白鼠肝组织匀浆,取上清液, -20℃保存、备用。分别取肝组织匀浆上清液 280μL,各加入质量浓度 10、20、30和 40μg·mL-1待测液 40μL(用蒸馏水配制),阳性对照则各加入质量浓度 10、20、30和 40μg·mL-1VC溶液 40μL。参照文献[9]的实验流程及试剂盒说明书上的操作方法及计算公式测定和计算 GSH-px活力。实验重复 3次。
1.2.2.2 H2O2诱导的MDA含量的测定 分别取小白鼠肝组织匀浆上清液 1.2 mL,各加入质量浓度为10、20、30和 40μg·mL-1的待测液 0.2mL(用双蒸水配制),阳性对照则各加入质量浓度 10、20、30和40μg·mL-1的VC溶液 0.2mL,参照文献[9]的实验流程及试剂盒说明书上的操作方法和计算公式测定并计算MDA含量。实验重复3次。
1.2.2.3 对 H2O2诱导的红细胞 (RBC)氧化溶血抑制率的测定 按照文献[10]的方法制备体积分数为0.5%的红细胞悬液。取 0.5%红细胞悬液 1 mL和100mmo l·L-1H2O2溶液 0.1m L,分别加入 0.05mL质量浓度 10、20、30和 40μg·mL-1的待测液 (用生理盐水配制),阳性对照则分别加入 0.05 mL质量浓度 10、20、30和 40μg·mL-1的 VC溶液,阴性对照仅加入 0.05mL生理盐水,参照文献[10]的实验流程进行操作并测定溶液在波长 415 nm处的吸光值,计算溶血抑制率。抑制率 =〔(A0-A)/A0〕×100%,式中:A0为阴性对照的吸光值;A为待测液或阳性对照的吸光值。实验重复 3次。
1.2.2.4 对 DPPH·自由基清除能力的测定 取 1mL 0.2mmo l·L-1DPPH·,分别加入 0.1mL质量浓度 2、4、6和 8μg·mL-1待测液(用体积分数 70%乙醇配制),阳性对照则分别加入 2、4、6和 8μg·mL-1的VC溶液 0.1m L,以 0.1m L体积分数 70%乙醇为阴性对照,参照文献[11]的实验流程操作并于波长517 nm处测定吸光值,根据吸光值计算 DPPH·自由基的清除率。清除率 =〔(A0-A)/A0〕×100%,式中:A0为阴性对照的吸光值;A为待测液或阳性对照的吸光值。实验重复 3次。
1.2.2.5 对 Fe3+还原能力的测定 采用普鲁士蓝法[12]进行测定。分别取 1 m L质量浓度为 6、8、12和 16μg·mL-1的待测液 (用体积分数 70%乙醇配制),阳性对照则分别取 1 mL 6、8、12和 16μg· mL-1的VC溶液,参照文献[12]的实验流程操作并于波长 700 nm处测定溶液的吸光值。实验重复 3次。
1.2.2.6 与 Fe2+的螯合能力测定 采用 Decker等的方法[13]进行测定。在各试管中加入 2 m L质量浓度为 5、10、15和 20μg·mL-1的待测液(用体积分数70%乙醇配制),阳性对照分别加入 2m L 5、10、15和20μg·m L-1的 VC溶液,阴性对照则加入 2m L体积分数 70%乙醇,参照文献[13]的实验流程进行操作并于波长 562 nm处测定吸光值,根据吸光值计算螯合率。螯合率 =〔(A0-A)/A0〕×100%,式中:A0为阴性对照的吸光值;A为待测液或阳性对照的吸光值。实验重复 3次。
1.3 统计分析
采用 SPSS软件进行差异显著性检验。
2 结果和分析
2.1 虎杖根茎中蒽醌类成分的含量
测定结果显示:1,8-二羟基蒽醌标准曲线的回归方程为y=0.930 7x+0.102(R2=0.998 7),根据该回归方程计算得到的虎杖根茎中蒽醌类成分粗提物的含量为 55.86m g·g-1,经大孔吸附树脂分离纯化后其含量为 44.77 m g·g-1。与含蒽醌类成分的唐古特大黄 (RheumtanguticumM axim.ex Balf.)、决明 (CassiatoraL.)、芦荟〔Aloevera(L.)N.L.Burm an var.chinensis(Haw.)Berg.〕等植物相比[14-16],虎杖根茎中蒽醌类成分含量较高。方法学考察结果显示:本研究采用的标准曲线测定方法精密度良好、重复性高,在 2 h内基本保持稳定,适用于虎杖根茎中蒽醌类成分的测定。
2.2 虎杖根茎中蒽醌类成分的体外抗氧化活性分析
2.2.1 对 GSH-px活力的增加作用 GSH-px是动物体内存在的一种含硒的清除自由基和抑制自由基反应的酶系,如果机体内 GSH-px等酶的含量不足,体内就会产生过多的羟自由基[17],因此,GSH-px含量是衡量机体抗氧化能力大小的重要指标之一。来源于虎杖根茎的蒽醌类成分对小白鼠肝组织匀浆中 GSH-px活力的影响结果见图 1。
由图 1可知:与阳性对照(VC)相比,不同质量浓度的蒽醌类成分均可显著增强小白鼠肝组织匀浆中GSH-px的活力;在质量浓度相同的条件下,蒽醌类成分对 GSH-px活力的增强效果均明显高于VC,且低质量浓度 (10μg·m L-1)的蒽醌类成分对 GSH-px活力的增强效果已经十分明显;随质量浓度的提高,蒽醌类成分和VC各处理组的 GSH-px活力均逐渐升高,但蒽醌类成分处理组的 GSH-px活力增加幅度大于VC。当质量浓度为 40μg·m L-1时,蒽醌类成分处理组 GSH-px活力最高,是VC的 3.3倍。
2.2.2 对 H2O2诱导的MDA含量的降低作用 作为氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的产物,MDA含量的变化可间接反映机体组织中氧化自由基含量的变化[18],因此,MDA含量的高低能够反映机体细胞受到氧化自由基攻击的严重程度。虎杖根茎中的蒽醌类成分对 H2O2诱导的MDA含量的影响结果见图2。
由图 2可知:随着蒽醌类成分质量浓度的提高, MDA含量逐渐减少,表明蒽醌类成分的抗氧化活性逐渐增强,机体细胞受到的损伤程度逐渐减小,阳性对照(VC)组的MDA含量也表现出相同的变化趋势。在质量浓度相同的条件下,VC组的MDA含量均明显高于相应质量浓度的蒽醌类成分处理组,其中当质量浓度为 40μg·mL-1时,VC组的MDA含量与蒽醌类成分处理组差异最大,是后者的 2.1倍。说明虎杖根茎中的蒽醌类成分对MDA含量的抑制作用大于VC,也说明其抗氧化活性高于VC。
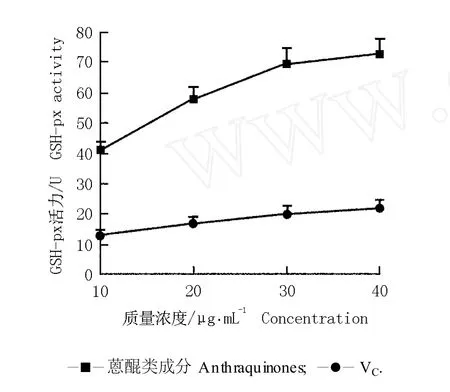
图1 虎杖根茎中的蒽醌类成分和 VC对肝组织匀浆中 GSH-px活力的影响F ig.1 Effectof an thraqu inones from rh izom e of Reynou tria japon ica Hou tt.and VC on GSH-px activ ity in liver tissue hom ogena te
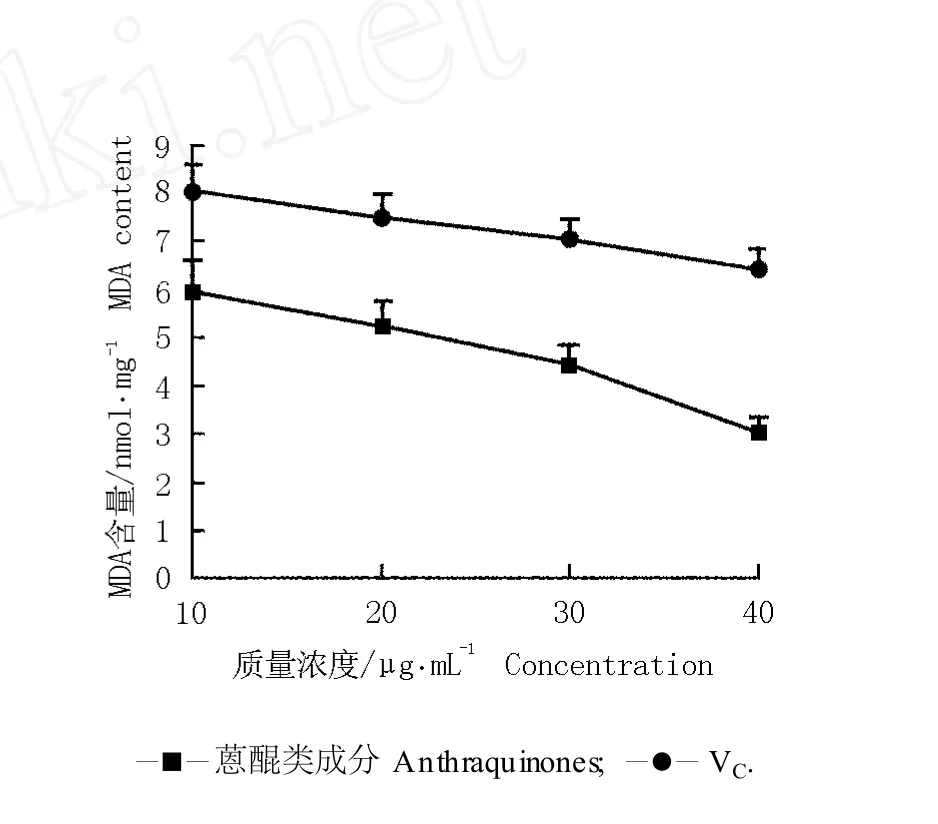
图2 虎杖根茎中的蒽醌类成分和 VC对 H2O 2诱导的M DA含量的影响F ig.2 Effectof an thraqu inones from rh izom e of Reynou tria japon ica Hou tt.and VC on M DA con ten t induced by H2O 2
2.2.3 对 H2O2诱导的红细胞 (RBC)氧化溶血的抑制作用 过多的氧自由基会导致红细胞膜破裂,使其内的血红蛋白释放出来,从而损伤红细胞,引起某些疾病或衰老[19]。虎杖根茎中的蒽醌类成分对 H2O2诱导的红细胞(RBC)氧化溶血的影响见图 3。
由图 3可知:与阳性对照 (VC)组相比,虎杖根茎中的蒽醌类成分能明显抑制 H2O2诱导的红细胞氧化溶血,且这种作用呈明显的量效关系,即随质量浓度的提高,蒽醌类成分对 H2O2诱导的红细胞氧化溶血的抑制率均逐渐增加。随质量浓度的提高,VC组的抑制率也逐渐增加,但增加幅度明显小于蒽醌类成分;且在质量浓度相同的条件下,蒽醌类成分对 H2O2诱导的红细胞氧化溶血的抑制效果明显优于 VC,当质量浓度为 40μg·m L-1时,蒽醌类成分处理组的抑制率最高,是 VC的 1.8倍。说明虎杖根茎中的蒽醌类成分对 H2O2导致的红细胞氧化应激损伤有较明显的保护作用,且这种保护效应大于VC。
2.2.4 对DPPH·自由基的清除能力 虎杖根茎中的蒽醌类成分对DPPH·自由基的清除率见图4。在一定浓度范围内,虎杖根茎中的蒽醌类成分对DPPH·自由基具有明显的清除作用且呈现较好的量效关系,即蒽醌类成分的质量浓度与 DPPH·自由基的清除率成正比,而阳性对照(VC)也具有类似的趋势,即随质量浓度的提高,蒽醌类成分和 VC对 DPPH·自由基的清除率均逐渐增加,但蒽醌类成分处理组清除率的增加幅度大于VC组;且在质量浓度相同的条件下,蒽醌类成分对DPPH·自由基的清除率均高于VC。当质量浓度为 8μg·mL-1时,蒽醌类成分对 DPPH·的清除率最高,是 VC的 1.3倍。表明虎杖根茎中的蒽醌类成分对DPPH·自由基的清除效果强于VC。
2.2.5 对 Fe3+的还原能力 还原力是反映抗氧化物质提供电子能力的重要指标之一,物质的还原力越强,说明其抗氧化能力越强[12]。通常情况下,抗氧化剂的吸光值越大表示还原力越强。根据实验结果(图5)可知:随质量浓度的提高,虎杖根茎中的蒽醌类成分和VC对 Fe3+的还原能力均逐渐增加,且在相同质量浓度条件下,蒽醌类成分反应液的吸光值均明显高于阳性对照VC,当质量浓度为 16μg·mL-1时,蒽醌类成分对 Fe3+的还原能力最强,反应液吸光值是VC的1.6倍。说明虎杖根茎中的蒽醌类成分对 Fe3+的还原能力高于VC。
2.2.6 与 Fe2+的螯合能力 Fe2+可以催化脂质过氧化并能和活性氧反应产生羟基自由基,从而破坏生物体内的生物大分子,造成细胞或组织氧化损伤,因此,与 Fe2+的螯合能力也是评价抗氧化剂活性的重要指标之一。Ferrozine试剂能够与 Fe2+反应生成紫红色络合物,当反应体系中存在抗氧化剂时,部分 Fe2+被抗氧化剂螯合,使得络合物的颜色变浅,故通过络合物颜色的变化,可以评价抗氧化剂与 Fe2+的螯合能力。采用此方法测定的虎杖根茎中的蒽醌类成分及阳性对照VC与 Fe2+的螯合能力见图 6。
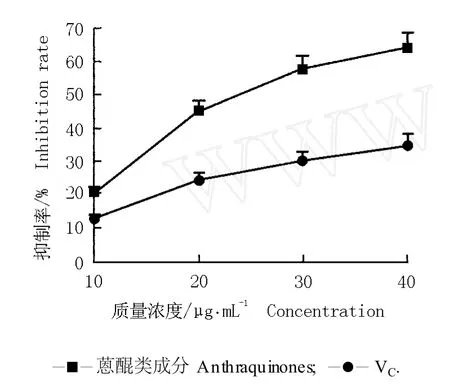
图3 虎杖根茎中的蒽醌类成分和 VC对 H2O 2诱导的红细胞(RBC)氧化溶血的抑制率F ig.3 Inh ib ition ra te ofan thraqu inones from rh izom e of Reynou tria japon ica Hou tt.and VC to ox ida tive hem o lysis of red b lood cells (RBC)induced by H2O 2
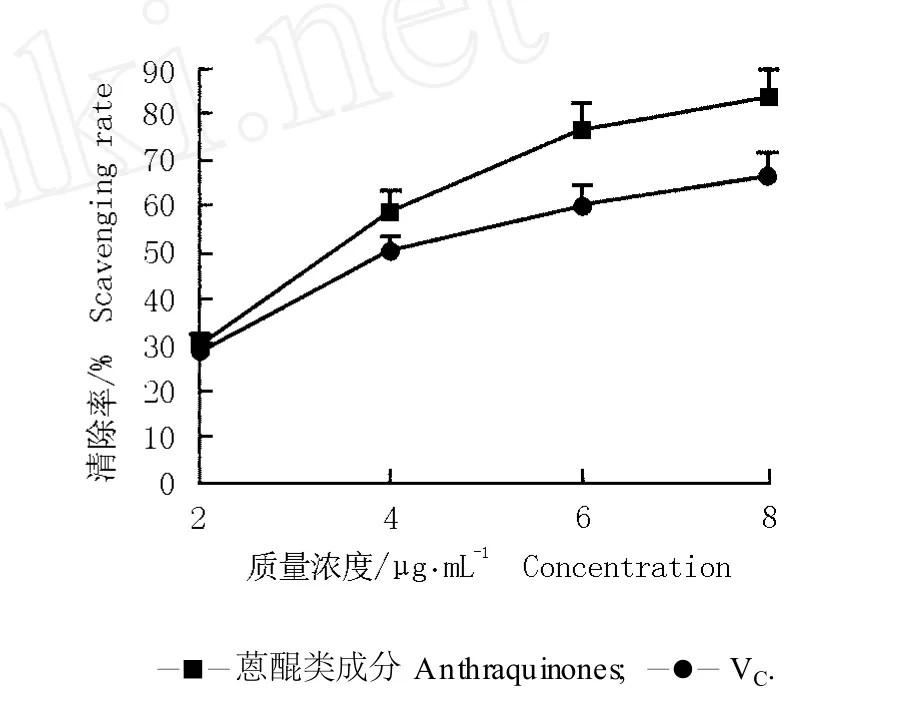
图4 虎杖根茎中的蒽醌类成分和 VC对DPPH·自由基的清除率Fig.4 Scaveng ing ra te of an thraqu inones from rh izom e of Reynou tria japon ica Hou tt.and VC to DPPH·free rad ica l
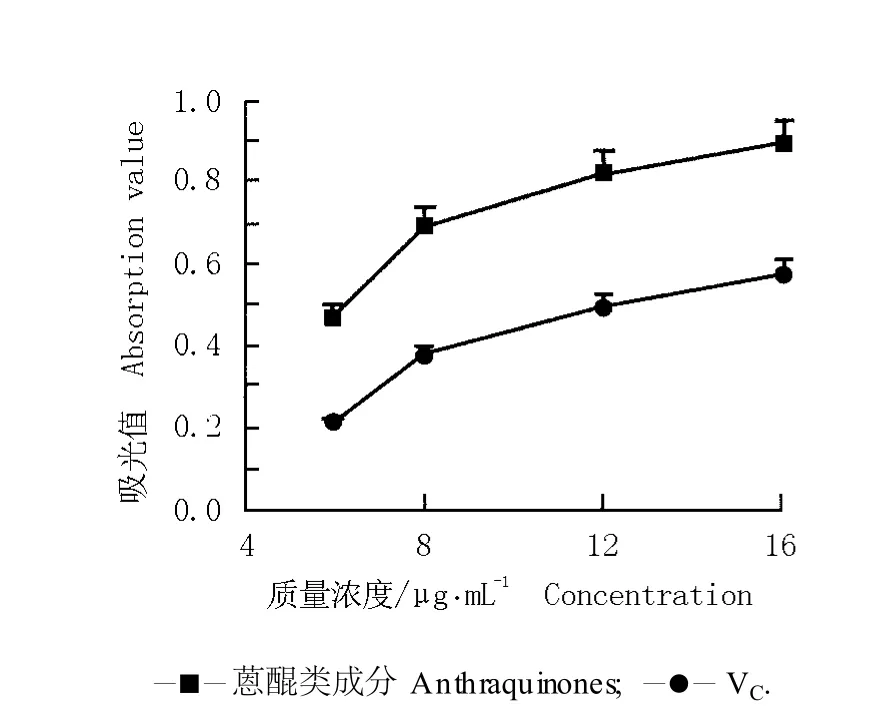
图 5 虎杖根茎中的蒽醌类成分和 VC对 Fe3+的还原能力F ig.5 Reduction ab ility of an thraqu inones from rhizom e of Reynou tria japon ica Hou tt.and VC to Fe3+
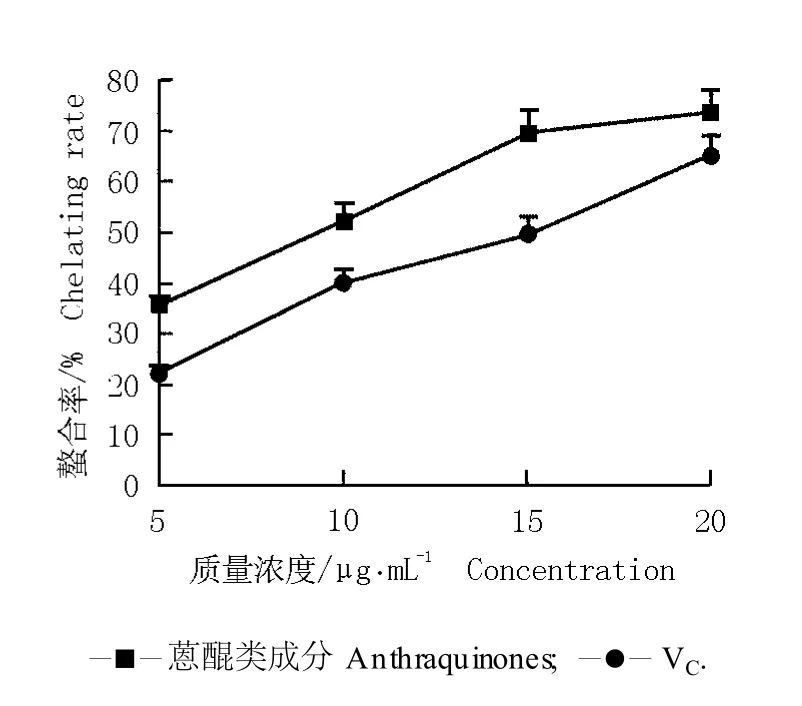
图 6 虎杖根茎中的蒽醌类成分和 VC对 Fe2+的螯合能力Fig.6 Chela ting ab ility of an thraqu inones from rh izom e of Reynou tria japon ica Hou tt.and VC to Fe2+
由图 6可见:随质量浓度的提高,虎杖根茎中的蒽醌类成分及VC与 Fe2+的螯合率均逐渐增加;且在质量浓度相同的条件下,蒽醌类成分与 Fe2+的螯合率均大于VC与 Fe2+的螯合率;当质量浓度为 20μg· mL-1时,蒽醌类成分对 Fe2+的螯合能力最强,螯合率是VC的 1.1倍。表明虎杖根茎中的蒽醌类成分对Fe2+具有较强的螯合能力,且这种螯合能力强于VC。
3 讨论和结论
研究结果表明:虎杖根茎中的蒽醌类成分具有增强小白鼠肝组织匀浆中 GSH-px活力、抑制 H2O2诱导的MDA含量和红细胞氧化溶血、清除DPPH·自由基的作用,同时还具有较强的对 Fe3+的还原能力以及与Fe2+的螯合能力。虎杖根茎中蒽醌类成分对细胞膜的保护作用可能与蒽醌类成分和膜上的蛋白质结合有关,这在一定程度上延缓由细胞膜损伤导致的溶血现象。但由于实验中使用的血红细胞是经过分级离心获得的,其环境与动物体内已有较大差异,因此,低质量浓度时能够与细胞膜蛋白质结合的蒽醌类成分较少,故氧化溶血现象较易发生。由于DPPH·有 1个游离电子并在波长 517 nm处有较强的吸收,其乙醇溶液呈深紫色,但是若有其他物质提供 1个电子与DPPH·上的游离电子配对,其色泽将会消退,褪色程度与其接受的电子呈定量关系[20],也就表现出对DPPH·的清除率,由于在较低质量浓度条件下蒽醌类成分能够给出的电子数目有限,因此,只表现出较弱的清除DPPH·自由基的能力。研究结果还表明:虎杖根茎中蒽醌类成分的抗氧化活性与其含量表现出高度的相关性,均随其质量浓度的提高而增加,且其作用效果均优于阳性对照 VC,表明来源于虎杖根茎中的蒽醌类成分具有很强的体外抗氧化活性。
生物体内的抗氧化作用与提高机体内源性抗氧化酶活性及清除自由基有关[21]。虎杖根茎中的蒽醌类成分通过 2条途径实现抗氧化作用。一是具有较强的自由基清除能力,能够直接清除过量的自由基,在化学上具有降低过氧化自由基的有效浓度以及打断脂质过氧化链反应的作用;二是通过增强细胞内的抗氧化系统活性以抑制自由基的产生。
虎杖根茎中的蒽醌类成分含量十分丰富,粗提物含量为 55.86 m g·g-1。蒽醌类成分主要含有大黄素、大黄素甲醚、大黄酚、蒽苷 A和蒽苷 B等多种成分[5],其中的哪些成分在抗氧化活性方面发挥主要作用还有待进一步探讨。有文献报道:蒽醌类成分不仅存在于虎杖的根茎中,在其幼叶内含量也很丰富,含量仅次于根茎[5]。因此,作为天然抗氧化剂,虎杖根茎所含的蒽醌类成分具有很好的开发潜力,而且从合理利用及保护野生资源的角度考虑,也应对虎杖地上部分的抗氧化活性加以深入研究,扩大和提高虎杖资源的利用率。
[1]Saltm an P.Oxidative stress:a radical view[J].Sem inars in Hem ato logy,1989,26(4):249-256.
[2]Jiang SH,W ang C L,Chen ZQ,et al.Antioxidant p roperties of the extractand subfractions from old leaves ofToonasinensisRoem (M eliaceae)[J].Journal of Food B iochem istry,2009,33(3): 425-441.
[3]申海进,郭巧生,房海灵.野菊花 60%乙醇提取物的酚类成分组成及其清除自由基和防霉变能力分析[J].植物资源与环境学报,2010,19(1):20-25.
[4]中国科学院中国植物志编辑委员会.中国植物志:第二十五卷第一分册[M].北京:科学出版社,1998:105-106.
[5]夏海武,吕柳新.虎杖不同部位白藜芦醇含量的分析[J].植物资源与环境学报,2005,14(3):55-56.
[6]么春艳,刘文哲.虎杖营养器官蒽醌类化合物含量的季节变化[J].西北植物学报,2005,25(1):179-182.
[7]刘 丹,汤海峰,张三奇,等.大孔吸附树脂吸附纯化虎杖有效部位的研究[J].中国中药杂志,2007,32(11):1019-1024.
[8]黄 园,徐雄良,张志荣,等.大黄总蒽醌纯化工艺的研究[J].中成药,2003,25(10):783-785.
[9]夏道宗,励建荣,刘杰尔,等.高良姜总黄酮的超声萃取及其体外抗氧化作用研究[J].中国食品学报,2009,9(3):63-69.
[10]刘培勋,高小荣,徐文清,等.银耳碱提多糖抗氧化活性的研究[J].中药药理与临床,2005,21(4):35-37.
[11]张 强,周正义,储 俊,等.大蒜、生姜、洋葱醇提物抗氧化活性的比较[J].食品与发酵科技,2010,46(1):93-96.
[12]王海敏,虞海霞,董 蕊,等.苕子蜜总酚酸和总黄酮含量测定及抗氧化活性的研究[J].食品科学,2010,31(1):54-57.
[13]Decker EA,W elch B.Role of ferritin as a lip id oxidation catalyst inmuscle food[J].Journal of Agricultural and Food Chem istry, 1990,38(3):674-677.
[14]车国冬,李玉林,王凌云,等.栽培唐古特大黄蒽醌含量的季节动态变化[J].西北植物学报,2006,26(11):2378-2382.
[15]黎海彬,方昆阳,李续娥.中药决明子蒽醌类成分含量测定的研究[J].食品科学,2007,28(7):427-429.
[16]王红星,古红梅,支 君.3种芦荟蒽醌类物质含量的比较[J].周口师范学院学报,2010,27(2):81-83.
[17]沈启良.参术片抗氧化作用的实验研究[J].中医学报,2010, 25(3):481-482.
[18]Amem iya S,Kam iya T,N ito C,et al.Anti-apop totic and neurop rotective effectsof edaravone fo llow ing transient focal ischem ia in rats[J].European Journal of Pharm acology,2005,516(2): 125-130.
[19]施建敏,俞志雄,庞会忠,等.华木莲叶黄酮类化合物抗氧化作用[J].江西农业大学学报,2006,28(5):693-697.
[20]CotelleN,Bernier JL,Catteau JP,etal.Antioxidantp ropertiesof hydroxy-flavones[J].Free Radical B io logy and M edicine,1996, 20(1):35-43.
[21]方允中,郑荣梁.自由基生物学的理论与应用[M].北京:科学出版社,2002:752-758.

