自黑鲷肠道分离一株发光细菌的种类鉴定及其发光特性的研究
毛芝娟,杨季芳,王晶,黄桔珏
(浙江万里学院 生物与环境学院,浙江 宁波 315100)
自黑鲷肠道分离一株发光细菌的种类鉴定及其发光特性的研究
毛芝娟,杨季芳,王晶,黄桔珏
(浙江万里学院 生物与环境学院,浙江 宁波 315100)
从浙江省象山港网箱养殖黑鲷(Sparus macrocephlus)肠道分离到一株发光细菌LB01,经过形态观察、生理生化特性测试和16S rRNA基因序列分析,确定这株菌属于鳆发光杆菌(Photobacteria leiognathi)。同时对这株菌的发光条件和发光特点进行了初步研究,结果表明,LB01在470 nm左右出现最大发射波长,在pH值 5.0~6.0,温度20℃左右,NaCl浓度3%左右等条件下发光最强。
鳆发光杆菌;鉴定;发光特性
发光细菌是一类在正常的生理条件下能够发射在黑暗处肉眼可见荧光的异养细菌[1]。目前,全世界已发现和命名的发光细菌有11种[2,3],分别属于异短杆菌属(Xenorhabdus)、发光杆菌属(Photobacterium)、希瓦氏菌属(Shewanella)和弧菌属(Vibrio)。不同种类发光细菌的发光机理相同,由分子氧作用,胞内荧光酶催化,将还原态的黄素单核苷酸(FMNH2)及长链脂肪醛氧化为FMN 及长链脂肪酸,同时释放出最大发光强度在波长为450~490 nm处的蓝绿光。
发光细菌在一定的实验条件下发光强度是恒定的,但与外来受试物接触后,由于毒物具有抑制发光的作用,发光细菌的发光强度即有所改变,发光强度的变化可以用生物毒性发光测定仪测出。目前,发光细菌生物测试法已经在环境监测、食品安全检测、医学卫生等领域中得到广泛应用[4-7]。发光细菌检测有毒物质具有费时较少且敏感性较好、操作简便、结果准确等优点。
本研究自象山港网箱养殖黑鲷(Sparus macrocephlus)肠道内分离到一株发光细菌,对这株菌进行了形态学观察、生理生化特性测试和分子生物学鉴定,并对其生长条件及发光特性进行了初步研究,旨在为该菌在生物传感器中可能的应用提供部分基础。
1 材料与方法
1.1 材料
1.1.1 培养基的种类和配方 实验中用到海水2216E培养基、发光固体培养基、发光液体培养基、LB(Luria-Bertani)培养基和TCBS培养基。
海水 2216E培养基配方如下:蛋白胨5 g,酵母粉1 g,磷酸铁0.01 g,加陈海水1 000 mL,调pH值 7.6,121℃,灭菌20 min。固体培养基则加入1.6 %的琼脂粉。
发光固体培养基和发光液体培养基参照杜宗军等[8]的配方。
LB培养基配方如下:胰蛋白胨10 g,酵母提取物5 g,NaCl 5 g(固体培养基加琼脂粉 16 g),加蒸馏水1 000 mL,调pH值 7.2~7.4,121℃,灭菌20 min。
TCBS培养基采用杭州天和微生物试剂有限公司的成品培养基TCBS琼脂。
1.2 方法
1.2.1 发光菌株的分离 以无菌方法取出一健康黑鲷(重 150 g,取自浙江省象山港养殖网箱)的肠道内容物,以无菌生理盐水进行10倍梯度稀释,取稀释液涂布海水 2216E平板和发光固体平板,28℃,黑暗条件下培养,观察发光菌落的出现情况。24 h后出现发光菌落,转接,分离,得到稳定发光的菌株LB01。
1.2.2 发光菌株的形态和理化特性鉴定 对分离的发光细菌菌株进行形态和生理生化特征测定,测定方法参照文献[9,10],微量生化反应管购自杭州天和微生物试剂有限公司。
1.2.3 发光菌株的16S rDNA序列的PCR及序列同源性分析 选用细菌通用16S rRNA引物[11],序列为 p1:5’AGAGTTTGATCCTGGCTCAG 3’,p2:5’GGTTACCTTGTTACGACTT 3’,以发光细菌基因组DNA为模板,PCR反应程序为:94℃,初始变性 4 min,94℃,变性 30 s,55℃,退火 45 s,72℃,延伸90 s,进行30个循环后,72℃终延伸7 min。PCR产物经1%琼脂糖凝胶电泳检测后纯化回收,送交英潍捷基(上海)贸易有限公司测序,所得序列经BlastN比对后以MEGA 4.0采用邻接法构建系统发育树,进行同源性分析。
1.2.4 发光特性的检测
1.2.4.1 发光菌株的发光波长、发光强度检测检测仪器为可见光荧光分光光度计(Hitachi F-4 500),检测发光波长时,扫描波长范围为350~600 nm,检测相对发光强度 I(a.u)。
1.2.4.2 NaCl浓度对菌株发光的影响 配制浓度分别为 0、1%、2%、3%、5%、7.5%和 10%的NaC1缓冲液;挑 LB01单菌落接入 5 mL 海水2216E液体培养基中,30℃ 振荡培养5 h,取 LB01菌培养液100 µL,加入到0.9 mL不同浓度的NaC1盐水缓冲液中,测定发光强度。
1.2.4.3 PH 值对菌株发光的影响 取 100 µL LB01培养液接入0.9 mL pH值分别为4.0、5.0、6.0、7.0、8.0含3%NaC1的缓冲液中,测定发光强度。
1.2.4.4 培养时间对菌株发光的影响 取 LB01培养液100 µL转接入25 mL海水2216E液体培养基,28℃恒温,暗处培养 3~48 h,定期用肉眼观察记录发光情况。
1.2.4.5 温度对菌株发光的影响 取 100 µL LB01培养液,加入到0.9 mL温度分别为4℃、20℃、30℃、35℃、40℃的3%NaC1缓冲液中,测定发光强度。
1.2.4.6 细菌密度对发光的影响 取5、10、20、50、100、200 µL LB01 培养液,分别加入到 5 mL 3%的NaC1缓冲液中,测定发光强度和OD600值。
2 结 果
2.1 LB01的形态学和理化特性鉴定
通过2216E平板和发光平板培养观察,自黑鲷肠道内容物中分离得到一株发光细菌,命名为LB01。该菌株在 2216E固体培养基上的菌落为圆形,乳白色,不透明,表面湿润,边缘整齐,黑暗处发出蓝绿色荧光。在TCBS培养基上的菌落为绿色,呈扩散状生长,不发光。革兰氏染色阴性,菌体呈杆状。
以微量生化管法对LB01菌株的主要理化特性进行了检测,结果见表1。该菌4℃生长,对O/129(150 µg/mL)不敏感,发酵葡萄糖产酸不产气,氧化酶、过氧化氢酶、精氨酸双水解酶、硝酸盐降解阳性;不产生脂酶、淀粉酶和脂肪酶;生长需钠;能发酵乙酸盐、纤维二糖、半乳糖、甘露糖等碳水化合物作为单一碳源。除 4℃生长、赖氨酸脱羧反应阳性、8% NaCl胨水中生长、发酵利用纤维二糖等几项外,与鳆发光杆菌(Photobacterium leiognathi)[12]的特性最为接近。对照《伯杰氏细菌鉴定手册》(第八版)[9],该菌株可以初步鉴定为发光杆属中的鳆发光杆菌。
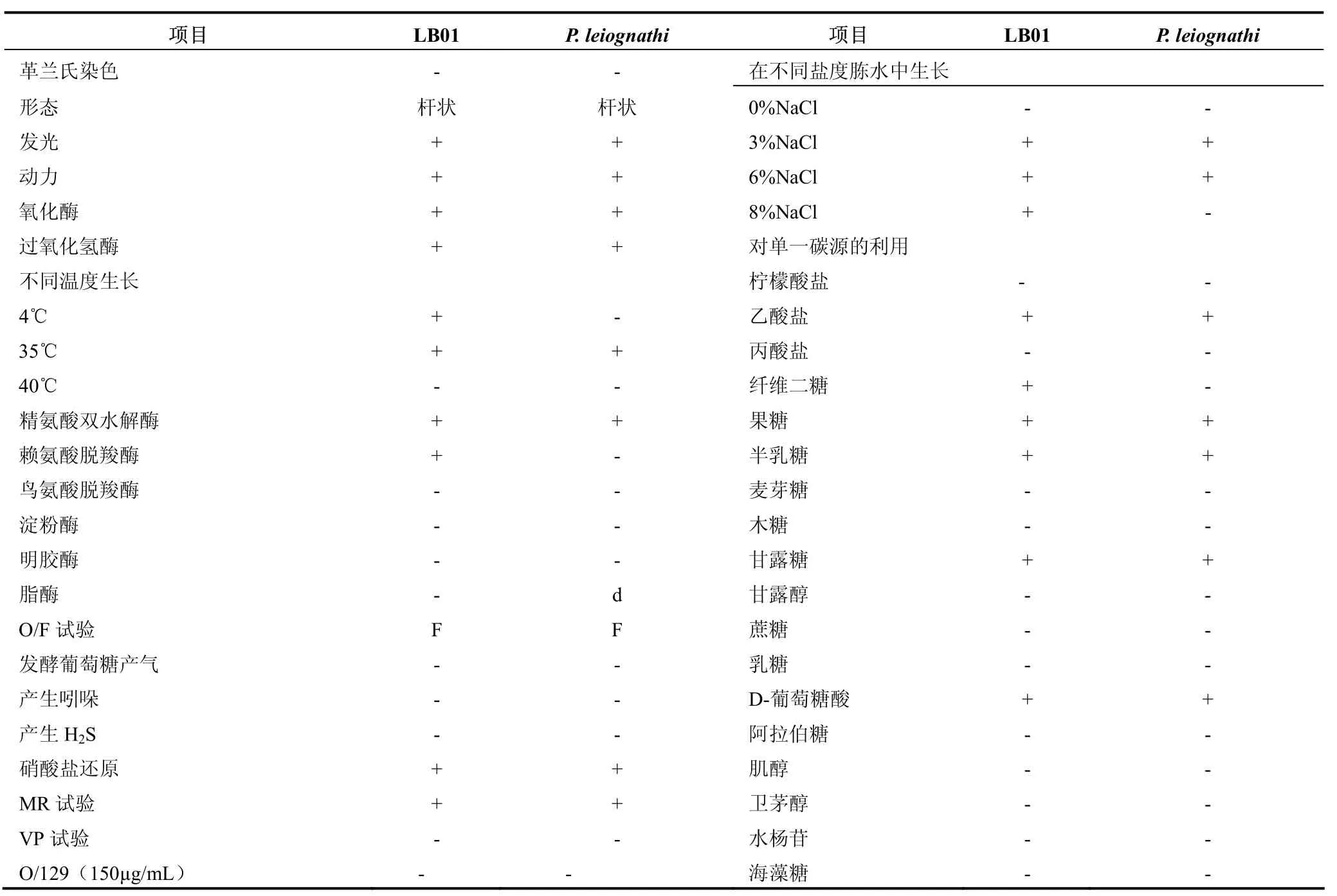
表1 菌株LB01的形态和理化特性Tab. 1 Morphological, physical and biochemical characteristics of strain LB01
2.2 LB01的分子生物学鉴定
采用细菌16S rDNA通过引物,以LB01基因组DNA为模板,进行PCR,获得了特异性的目的片段,长约1 500 bp(图1)。PCR产物直接测序后获得1 419 bp的序列,BlastN比对结果表明,该序列与数种发光细菌包括鳆发光杆菌、P. kishitanii、明亮发光杆菌和P.iliopiscarium等相应序列的相似性均在99%以上,其中与鳆发光杆菌(基因登录号:AY292947)16S rRNA基因序列100%同源。选取同源性最高的序列构建了系统发育图(图 2),图中可以看出,LB01株16S r RNA基因与发光杆菌P.leiognathi聚为一类,与 P. kishitanii、P.phosphoreum等高度相似性序列(99%以上)则聚为一大类,而与P.iliopiscarium(AY849430)距离稍远,成为两个分枝。
结合理化特性鉴定的结果,LB01菌株可以鉴定为鳆发光杆菌。
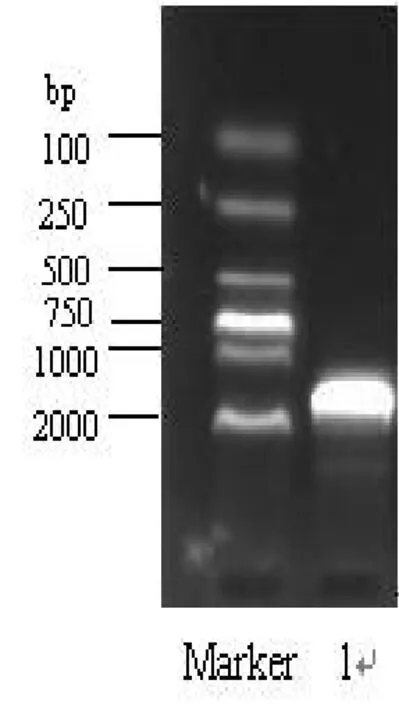
图1 LB01 16S rRNA基因的PCRFig. 1 PCR amplifying of 16S rRNA gene of strain LB01 1:LB01 16S rRNA基因的PCR产物; Marker:DNA 分子量标准
2.3 LB01的发光特性
对LB01菌株的发光特性展开了初步的研究,结果见表2-3和图3-7。从图中可以看出,LB01的最大发光波长在470 nm左右;在pH值6.0,温度20℃,NaCl浓度为3.0%左右时,发光强度最高。LB01菌株正常发光的温度范围在15~25℃,pH值范围在5.0~7.5,适应范围较广。该菌株在细胞密度达到一定值(如OD600值=0.09)后,发光强度迅速增强;液体培养4 h开始发光,培养7 h左右时,发光达到峰值,持续发光时间长,可达26 h。
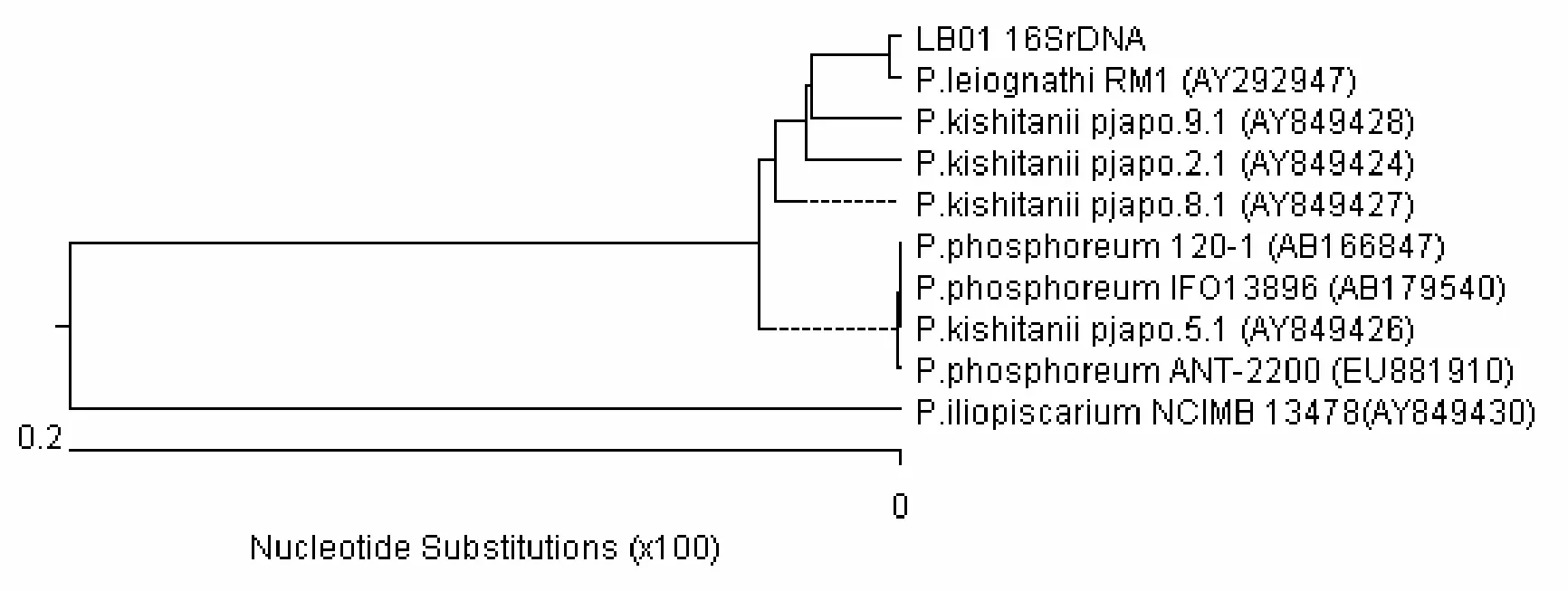
图2 LB01 16S rDNA序列的系统发育树Fig. 2 Phylogenic tree of 16S rDNA of strain LB01
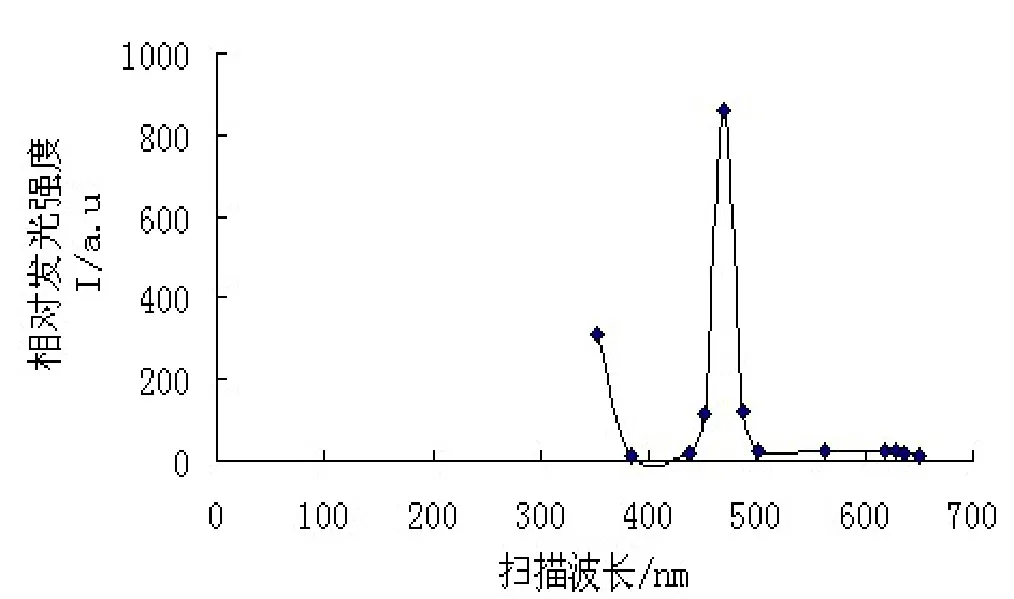
图3 LB01菌株的扫描波长与相对发光强度Fig. 3 Scanning wavelength and the relative luminescence strength of strain LB01
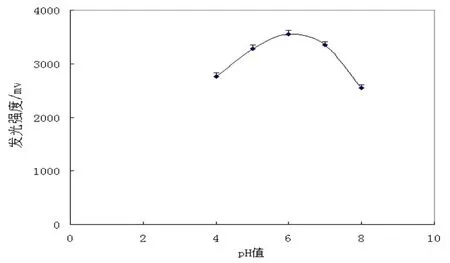
图4 PH值与LB01发光强度的关系Fig. 4 Effects on the luminescence of LB01 by the pH value
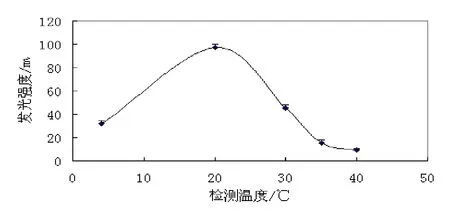
图5 温度与LB01发光强度的关系Fig. 5 Effects on the luminescence of LB01 by temperature
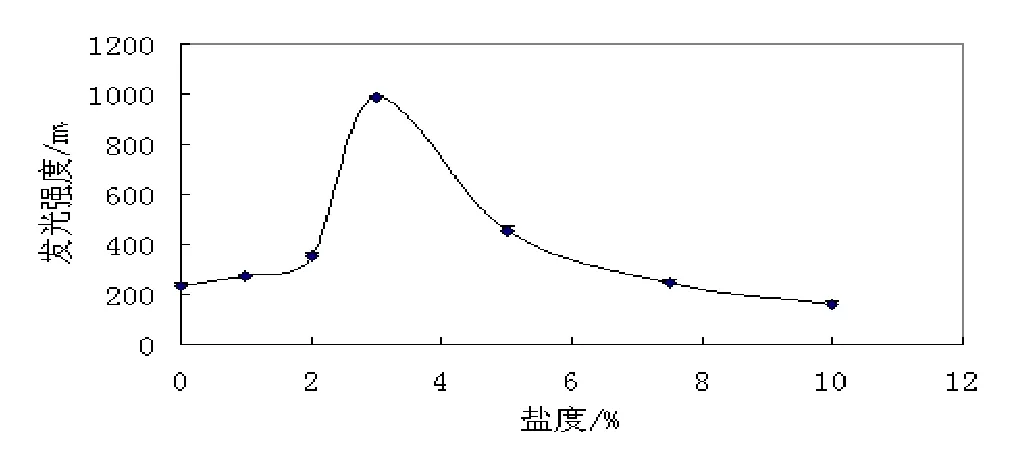
图6 盐度与LB01发光强度的关系Fig. 6 Effects on the luminescence of LB01 by salinity
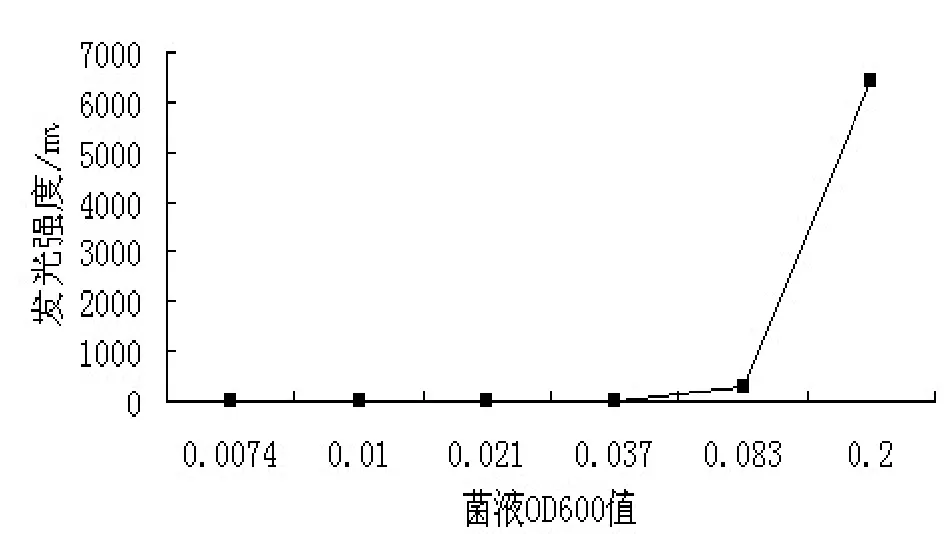
图7 LB01菌液密度与发光强度的关系Fig. 7 Effects on the luminescence of LB01 by the density of bacteria suspension

表2 培养时间对发光的影响Tab. 2 Effects on the luminescence of LB01 by culture time
3 讨 论
自黑鲷肠道分离到一株发光细菌 LB01,对其进行了形态学观察、生理生化特性鉴定及16S rRNA基因序列的分析。该菌株为革兰氏阴性杆菌,具有运动性,氧化酶和过氧化氢酶阳性、硝酸盐降解阳性、发酵葡萄糖不产气,符合《伯杰氏细菌鉴定手册》[9]对发光杆菌属的描述;其它主要理化特性如下:精氨酸双水解酶阳性,生长需Na+,4℃生长,不产生淀粉酶、脂酶和明胶酶;能利用纤维二糖、半乳糖、甘露糖等作为单一碳源;对照《伯杰氏细菌鉴定手册》[9]和相关文献[12],LB01可以初步鉴定为发光杆菌属的鳆发光杆菌。
16S rRNA基因序列比对结果表明,LB01与数种发光杆菌属种类的同源性均很高,达到 99%以上,包括鳆发光杆菌、P. kishitanii、明亮发光杆菌和 P. iliopiscarium等。系统发育分析表明,LB01与鳆发光杆菌(AY292947)聚为一类,同源性达100%。已有研究表明,上述4种发光杆菌本身在生理生化特性上极为相似,16S rDNA序列同源性也极高,但在部分遗传特性及宿主特性上存在显著差异,属于不同的种[12-15];其中后三者的理化特性极为相近,P. kishitanii和P. illopiscarium是最近才从明亮发光杆菌中分离出来的[13,14];鳆发光杆菌和明亮发光杆菌在数种理化特性上存在明显差异,前者氧化酶反应阳性,发酵葡萄糖不产气;而后者氧化酶试验阴性,发酵葡萄糖产气[9,13]。分析比较LB01与鳆发光杆菌和明亮发光杆菌的理化特性,LB01更接近于鳆发光杆菌;结合16S rRNA序列同源性分析,可以判断为鳆发光杆菌。
中国学者于20世纪80年代对国内沿海的发光细菌资源进行了调查,发现了包括鳆发光杆菌、发光性哈维氏弧菌(V. harveyi)和费氏发光弧菌(V.fischeri)等主要种类的发光细菌,其中鳆发光杆菌在我国沿海海域自南到北皆有分布[16-19]。本研究则首次自东海网箱养殖海水鱼—黑鲷肠道内分离到一株鳆发光杆菌,验证了该菌在海水动物体内的定殖;发光细菌在海洋动物发光器官与肠道中的定殖其实与这些菌种在海水中的分布是对应的[15,20]。
已经报道的海洋发光细菌发射波长为 450~490 nm[1],本研究中LB01菌株在培养条件下发出蓝绿色光,在黑暗条件下肉眼可见,最大发射波长在470 nm左右,与已有报道相符。在pH 值6.0左右,温度20℃,NaCl浓度3%,发光最强,与明亮发光杆菌的发光条件相近[21,22];与国内方宏达等报道的一株海洋发光弧菌 D2的发光条件也比较接近[23],而与杜宗军等分离的一株发光哈维氏弧菌D40发光条件则略显差异,后者发光温度和pH值范围更广一些[8]。鳆发光杆菌作为一种海洋细菌,其生长和发光均需较高的盐度,研究中观察到,LB01在2216E培养基、发光培养基上均能正常生长,发光情况则是后者优于前者,这是由于在培养基中添加了甘油和钙盐等有利于发光反应的进行的缘故。
明亮发光杆菌与费氏弧菌均为生物发光传感器中应用的重要菌种[22,24,25];目前国内应用的主要是国外分离株[4-7]。本研究自东海海域网箱养殖黑鲷肠道内分离到一株鳆发光杆菌,其发光条件和发光特性与明亮发光杆菌相近,有可能在生物发光传感器中获得应用。
[1] Edward A M. Bacterial bioluminescence: organization, regulation,and application of the lux genes [J]. FASEB J, 1993, 7: 1016-1022.
[2] 杜宗军, 王祥红, 李海峰, 等. 发光细菌的研究和应用 [J]. 高技术通迅,2003,(12): 103-106.
[3] 张进兴, 逢爱梅, 孙修勤, 等. 海洋发光细菌的发光及其应用[J]. 发光学报, 2007, 28(2): 167-172.
[4] 朱文杰, 郑天凌, 李伟民. 发光细菌与环境毒性检测 [M]. 北京:中国轻工业出版社, 2009.
[5] 韦东普, 马义兵, 陈世宝, 等. 发光细菌法测定环境中金属毒性的研究进展 [J]. 生态学杂志, 2008, 27(8): 1413-1421.
[6] 王亚群, 王静雪, 林洪, 等. 发光细菌法检测水产品中氯霉素体系的建立 [J]. 中国海洋大学学报, 2009, 39(1): 66-70.
[7] 凌云, 赵渝, 徐亚同, 等. 发光细菌法在食品安全性检测中的应用 [J]. 食品与生物技术学报, 2005, 24(6): 106-110.
[8] 杜宗军, 王祥红, 李海峰, 等. 一株海洋发光细菌的分离鉴定及其发光条件的初步研究 [J]. 海洋湖沼通报, 2003, (2): 58-63.
[9] Holt J G, Krieg N R, Sneath P H A, et a1. Bergey’S Manual of Determinative Bacteriology 8th ed [M]. Baltimore, USA: Williams& Wilkins, 1994.
[10] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册 [M]. 北京:科学出版社, 2001.
[11] 刘文强, 贾玉萍, 赵宏坤. 16S rRNA在细菌分类鉴定研究中的应用 [J]. 动物医学进展, 2006, 27(11): 15-18.
[12] Chiu H H, Chou H H, Jean W D, et al. Isolation and characterization of marine luminous bacteria from shallow coastal waters of Taiwan[J]. J Microbio Immunol Infect, 2007, 40: 14-23.
[13] Ast J C, Dunlap P V. Phylogenetic resolution and habitat specificity of members of the Photobacterium phosphoreum species group [J].Environ Microbiol, 2005,7(10): 1641-1654.
[14] Ast J C, Cleenwerck I, Engelbeen K, et al. Photobacterium kishitanii sp. nov., a luminous marine bacterium symbiotic with deep-sea fishes [J]. Int J Syst Evol Microbiol, 2007, 57: 2073-2078.
[15] Ruby E G, Morin J G. Luminous enteric bacteria of marine fishes: a study of their distribution densities and dispersion [J]. Appl Environ Microbiol, 1979, 38(3): 406-411.
[16] 王定华, 杨颐康. 一株海洋发光细菌的鉴定 [J]. 华东师范大学学报(自然科学版), 1985, (2): 108-112.
[17] 沈建伟, 杨颐康. 黄海发光细菌的分离鉴定 [J]. 海洋与湖沼,1987, 18(4): 333-340.
[18] 沈建伟, 朱文杰, 吴自荣, 等. 南海中国沿海发光细菌的分离鉴定 [J]. 海洋与湖沼, 1988, 19(1): 76-80.
[19] 许鸿章. 烟台海域发光细菌的分离鉴定 [J]. 山东师范大学学报(自然科学版), 1989,4(4): 34-40.
[20] Orndorff S A, Colwell RR. Distribution and identification of luminous bacteria from the Sargasso sea [J]. Appl Environ Microbiol, 1980, 39(5): 983-987.
[21] O'Kane D J, Karle V A, Lee J. Purification of lumazine proteins from Photobacterium leiognathi and Photobacterium phosphoreum:bioluminescence properties [J]. Biochemistry, 1985, 24(6):1461-1467.
[22] Hassan S H, Oh S E. Improved detection of toxic chemicals by Photobacterium phosphoreum using modified Boss medium [J]. J Photochem Photobiol B, 2010, 101(1): 16-21.
[23] 方宏达, 董燕红, 袁茵, 等. 海洋发光弧菌生长和发光条件的研究 [J]. 海洋通报, 2007, 26(4): 66-70.
[24] Faria E C, Treves Brown B J, Snook R D. Water toxicity monitoring using Vibrio fischeri: a method free of interferences from colour and turbidity [J]. J Environ Monit, 2004, 6(2): 97-102.
[25] Parvez S, Venkataraman C, Mukherji S. A review on advantages of implementing luminescence inhibition test (Vibrio fischeri) for acute toxicity prediction of chemicals [J]. Environ Int, 2006, 32(2):265-268.
Isolation and identification of a luminous bacterium LB01 and primary studies on its luminescent conditions
MAO Zhi-juan, YANG Ji-fang, WANG Jing, HUANG Ju-jue
(Biological and Environmental College, Zhejiang Wanli University, Ningbo 315100, China)
A luminous bacterium, LB01, was isolated from the gut of a net caged black sea bream (Sparus macrocephlus). Based on the morphology profiles, the physiological and biochemical characteristics and 16S rDNA sequencing analysis,strain LB01 was identified as Photobacterium leiognathi.And the luminescent conditions were preliminary determined. The strain irradiated fluorescent light at a wavelength of about 470nm. In liquid culture, under the following conditions, pH value of 5.0~6.0, detection temperature at 20℃, with 3 % NaCl in the detection buffer,the luminous bacterium LB01 showed the strongest luminescence.
Photobacterium leiognathi; identification; luminescent conditions
S942.1
A
1001-6932(2011)04-0441-06
2010-8-31;
2011-2-15
海洋公益性行业科研专项基金 ( 200705014)。
毛芝娟(1973-),女,博士,主要从事海洋病原微生物学研究。电子邮箱:zhijuanmao@tom.com。

